14醇酚醚醛酮醌
- 格式:ppt
- 大小:1.78 MB
- 文档页数:44

第十章 醇、酚、醚一 基本内容1. 定义和分类(1) 醇醇即是烃分子中碳原子上的氢原子被羟基取代而成的化合物(不包括某些化合物的烯醇式)。
羟基-OH 是醇的官能团。
根据分子中所含羟基的数目,可分为一元醇、二元醇、三元醇和多元醇。
根据分子中羟基所连烃基的类型不同,可分为饱和醇、不饱和醇、脂环醇、芳香醇等。
根据羟基所连碳原子的不同类型,可分为伯、仲、叔醇。
值得注意的是,在多元醇分子中,两个或三个羟基连在同一个碳原子上的化合物不稳定,容易失水生成醛、酮或羧酸;羟基连在双键碳原子上的醇为烯醇,烯醇与醛或酮形成动态平衡: (2)酚酚为芳烃中芳环上的氢原子被羟基取代而成的化合物。
根据分子中所含羟基的数目,可分为一元酚(如苯酚)、二元酚(如对苯二酚)和多元酚(如1,3,5-间苯三酚)。
(3)醚醚可以看作是水分子中两个氢分子被烃基取代而生成的化合物。
两个烃基相同的称为简单醚,通式为ROR ;两个烃基不同的称为混合醚,通式为ROR ˊ。
随着烃基的结构不同可分为:二烷基醚、二芳基醚、烷芳混合醚、乙烯醚、环醚等。
2. 反应(1)醇的反应主要发生在羟基上,由C-OH 键和O-H 键的断裂而引起的反应。
(ⅰ)酸碱性:醇分子中含有极化的O-H 键,电离时生成烷氧基负离子和质子而具有微弱的酸性;羟基上的氧原子有孤对电子,也能接受质子,因而又有一定的碱性。
由于烷氧基在溶剂中的溶剂化程度不同,所以醇的酸性次序有H 2O>CH 3OH>伯醇>仲醇>叔醇。
醇分子中烷基上的氢被电负性大的原子取代,其酸性增强,如:2,2,2-三氟乙醇(pK a =12.4)的酸性比乙醇(pK a =15.9)强得多。
这样的取代基越多及距离羟基越近,取代醇的酸性越强。
醇的酸性虽然很弱,但能与K 、Na 、Mg 、Al 等活泼金属、NaH 、RMgX 、RLi 及其他强碱作用生成醇金属化合物。
如:CH 3OH + Na +H - → CH 3O -Na + H 2↑。

醌酮醛知识点总结一、醌酮醛的结构醌酮醛是一类化合物,由醌和醛两个官能团组成,有着特定的分子结构。
在有机化学中,醌是一个含有两个酮基团(C=O)的化合物,通式为C6H4O2,常见的有萘醌、苯醌、喹啉醌、吲哚醌等。
而醌酮醛则是在醌的基础上,加上一个醛基团(CHO),形成一种含有一个羰基和两个羟基的官能团。
这种结构的化合物通常具有较强的化学反应性和活性。
二、醌酮醛的命名根据国际化学命名法,醌酮醛的命名通常采用“醌+醛”的方式,即首先按照醌的命名规则确定醌的名称,然后在其后加上醛基团的名称。
例如,苯醌醛、吲哚醌醛等。
此外,还可以根据醌酮醛中所含的醌和醛的种类和数量对其进行更为精确的命名。
三、醌酮醛的制备方法1. 氧化醌酮法:醌酮醛可以通过将醌进行氧化反应,得到相应的醌酮醛。
这种方法可以通过氧化剂如过氧化氢(H2O2)、高氯酸盐(Cl2O)、过硼酸钠(NaBO3)等进行氧化反应,得到相应的醌酮醛产物。
2. 光加成反应法:醌酮醛还可以通过光化学反应产生。
在紫外光照射下,醌可以与醛发生光加成反应,生成相应的醌酮醛。
3. 羰基化合物与羟基化合物的缩合反应法:醌酮醛可以通过羰基化合物(如醛、酮)与羟基化合物(如醇)发生缩合反应,生成相应的醌酮醛产物。
四、醌酮醛的化学性质1. 醌酮醛的氧化性:醌酮醛具有较强的氧化性,在氧化剂的作用下可以发生氧化反应,生成相应的醌或酸。
2. 醌酮醛的还原性:在还原剂的作用下,醌酮醛可以发生还原反应,生成相应的醌或醇。
3. 醌酮醛的加成反应性:由于醌酮醛中含有一个醛基和两个羟基,它具有较强的加成反应性,可以与多种亲电试剂发生加成反应。
4. 醌酮醛的重排反应性:在适当的条件下,醌酮醛可以发生重排反应,产生新的结构异构体。
五、醌酮醛的应用1. 醌酮醛在有机合成中的应用:由于醌酮醛具有较广泛的官能团和化学性质,它在有机合成中有着重要的应用价值。
醌酮醛在有机合成中可以作为重要的反应物和中间体,参与多种有机化学反应,生成各种含氧和含碳的有机化合物。

醇※结晶醇—>利用氯化钙等除去混合物中的醇利用Mg、Al制取无水乙醇醇的酸性:水>醇>丙酮>炔>胺>烷烃液相:※苯酚的酸性:邻位效应使邻位取代基的酸性最大(邻o>对p>间m)给电子基团越强,酸性越弱在间位略是吸电子醇被卤素取代:SN1(只有1°伯醇SN2:活性最弱)(也是脱水活性)—>鉴别:根据不同的醇被卤素取代的活性区别:氢卤酸反应容易发生重排,SOCl2、PBr3不会碳正离子重排SOCl2构型保持※邻基参与:SN2构型保持和翻转的均有位阻影响小TsO-、BsO-:分子内脱水反应:碳正离子中间体:重排;Al2O3不重排取代为卤代烃也可减少重排(1°):※对甲苯磺酸甲酯:双分子反应,不会发生重排:TsCl-TsOH-TsOR例:分子间脱水反应成醚:1°:SN22°、3°:SN1氧化:(Sarrett试剂)不影响双键:一边丙酮、一边异丙醇新制MnO2:烯丙位羟基氧化为醛基或羰基;甲苯变成苯甲醛脱氢;(催化氧化)Pd、Cu、Ag or CuCrO4。
加热高碘酸或四醋酸铅(几个碳碳键消耗几摩尔氧化剂)也会反应中间体:环状高碘酸酯或脱醋酸形成五元环—>邻二醇四醋酸铅反式也可反应(速度慢):邻二醇还与氢氧化铜反应:二醇的脱水:频哪醇重排(羟基邻位卤素也可):动力:由碳正离子转化成稳定的(氧正离子)八隅体掉羟基:先掉碳正离子稳定的那个羟基;基团迁移(给、提供较多电子的优先):Ar- > 烷基环类:酯的热消除:顺势消除(六元环过渡态)烯烃加水(H2O,H+):易重排,马氏规则羟汞化还原(Hg(OCOCH3)2,H2O;NaBH4):不重排,马氏规则,反式加成硼氢化氧化(B2H6;H2O2,OH-):反马氏规则,顺式加成反式顺式(OsO4/H2O2)酚类:酚分子间脱水条件苛刻:ThO2,450℃酚醚制备:酚钠(强碱)与卤代烃(最好用以及卤代烃,防止发生消除反应)SN2反应有吸电子基团的活化苯环从而活化O—H键※酚类可以和酸酐、酰卤(活性更高)成酯※酚的羟基和苯环均能与卤代烃、酰卤、酸酐反应:①louis酸(或HF、磷酸):苯环②H+或碱(主要):羟基:甲基化试剂:碘甲烷,硫酸二甲酯,重氮甲烷芳环亲电取代:极性溶剂三取代;邻对位产物一般可通过水蒸气蒸馏分离亚硝基化:与重氮盐形成偶氮化食物与羰基的缩合:碱性形成氧负离子,形成共振式再加成:酸性:形成碳正离子对苯环加成:缩聚:碱性形成氧负离子,形成共振式再加成酸性形成碳正离子对苯环加成:特殊重排:Fries重排(不能有强吸电子基团):类似克莱森重排Claisen重排:邻位反,对位直接接Kolbe反应酚钾在对位取代异丙苯氧化制苯酚:醚:自动氧化:形成氧正离子:溶于酸;与louis酸形成络合物醚键的断裂:断的C-O的碳:连卤原子有甲基的断甲基(SN2甲基位阻小)有叔丁基的断叔丁基(SN1碳正离子稳定)※酚醚得酚和卤代烃应用:脱氧得氢:小环醚:立体化学:SN2(酸性带有SN1性质,但不会形成完全的碳正离子,不是外消旋体):反式开环产物。




醇酚醛酮的性质的实验报告实验五酚、醇、醛、酮的化学性质实验报告时间:年月日地点:生科院B108实验室温度:实验名称:酚、醇、醛、酮的化学性质实验性质:基础性实验要求:必修实验五酚、醇、醛、酮的化学性质一.实验目的1.学习经典的化学分析方法,了解经典化学分析方法操作简单、成本低廉、易于观察、适用性强的特点;2.通过实验进一步理解掌握醇、酚、醛、酮的相关化学性质。
二.实验原理1.卢卡氏实验:因含C3—-C6的各种醇类均溶于卢卡氏试剂,反应能生成不溶于试剂的氯代烷,使反应液呈浑浊状,静置后溶液有分层现象出现,反应前后有显著变化,便于观察;2.高碘酸实验:CH2(OH)(CHOH)nCH2OH +(n+1) HIO4 H2O + 2HCHO +(n+1) HIO3 3.酚和三氯化铁的反应:OH 2 +2Fecl+2Fecl3 +2HCl OH4.与2,4-二硝基苯肼的反应:共轭醛酮与2,4-二硝基苯胺反应生成的沉淀为红色或桔红色;5.碘仿反应:O O NaOHC—OH (R)CH3—CH3+ Nao ——H (R)三.实验器材正丁醇、仲丁醇、叔丁醇、卢卡氏试剂、乙二醇、甘油水溶液、高碘酸溶液、饱和亚硫酸溶液、希夫试剂、苯酚、三氯化铁溶液、甲醛、乙醛、丙酮、2,4-二硝基苯肼试剂、碘溶液、氢氧化钠溶液四.操作步骤1.卢卡氏实验:取三支试管分别加入1mL正丁醇、仲丁醇、叔丁醇,然后各加2mL卢卡氏试剂;用软木塞塞住管口,观察记录混合液变混浊及分层时间;2.高碘酸实验:取两支试管分别加入3滴10%乙二醇、10%甘油水溶液,然后各加3滴5%高碘酸溶液,混合静置5min,各加3~4滴饱和亚硫酸溶液,最后再加1滴希夫试剂,静置数分钟,分别观察溶液颜色变化;3.苯酚和三氯化铁的反应:取一支试管加入5滴苯酚,3滴1%三氯化铁溶液;4.醛,酮与2,4-二硝基苯肼的反应:取三支试管分别加入3滴甲醛、乙醛、丙酮,然后加入2,4-二硝基苯肼试剂。


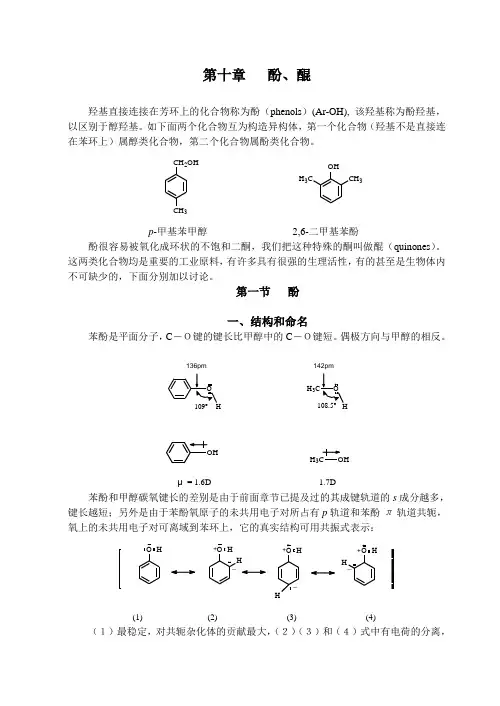
OHH 3CCH 3第十章 酚、醌羟基直接连接在芳环上的化合物称为酚(phenols )(Ar-OH), 该羟基称为酚羟基,以区别于醇羟基。
如下面两个化合物互为构造异构体,第一个化合物(羟基不是直接连在苯环上)属醇类化合物,第二个化合物属酚类化合物。
CH 2OHCH 3p -甲基苯甲醇 2,6-二甲基苯酚酚很容易被氧化成环状的不饱和二酮,我们把这种特殊的酮叫做醌(quinones )。
这两类化合物均是重要的工业原料,有许多具有很强的生理活性,有的甚至是生物体内不可缺少的,下面分别加以讨论。
第一节 酚一、结构和命名苯酚是平面分子,C -O键的键长比甲醇中的C -O键短。
偶极方向与甲醇的相反。
136pmH 3142pmH 3Cμ = 1.6D 1.7D苯酚和甲醇碳氧键长的差别是由于前面章节已提及过的其成键轨道的s 成分越多,键长越短;另外是由于苯酚氧原子的未共用电子对所占有p 轨道和苯酚π轨道共轭,氧上的未共用电子对可离域到苯环上,它的真实结构可用共振式表示:(1) (2) (3) (4)(1)最稳定,对共轭杂化体的贡献最大,(2)(3)和(4)式中有电荷的分离,虽不稳定,但对共振杂化体亦有较少的贡献。
因此碳氧间亦有部分双键的特征,使键长缩短,C-O键不易断裂,羟基不易被取代。
在甲醇中,羟基是吸电子基,偶极方向指向羟基。
但在苯酚中,由于羟基通过共轭对苯环所起的给电子作用超过了它对苯环的吸电子诱导作用,所以偶极方向指向苯环。
根据芳环上所连羟基的数目,可把酚类分为一元酚,二元酚,三元酚……,但常把含有一个以上羟基的酚称为多元酚。
命名时,都以苯酚(萘酚,蒽酚等)作为母体,它们的英文名都是以-ol结尾,如苯环上连接有其它取代基则可看作是苯酚的衍生物。
对于多元酚只须在“酚”字前面用二、三……等表示羟基的数目,并用阿拉伯数字1,2,3……等表明羟基和其它基团所在的位次。
例如:OH OHCH3苯酚4-甲(基)苯酚4-methyl phenolphenol 或对-甲基苯酚p-methyl phenolOHOH2-萘酚2-naphthalenol 9-蒽酚9-anthrol或β-萘酚β-naphthol 或γ-蒽酚γ- anthrol 多元酚类似于多元醇的系统命名。
人教版化学高中高中化学课程是中学化学教育的重要组成部分,它旨在培养学生的科学素养,提高学生的实验技能和创新能力。
人教版高中化学教材是根据新课程标准编写的,内容涵盖了无机化学、有机化学、物理化学等多个领域,为学生提供了一个全面、系统的化学知识体系。
一、无机化学无机化学是研究无机物质的性质、组成、结构、变化规律及其与能量的关系的科学。
人教版高中化学教材中的无机化学部分主要包括:元素周期律、离子反应、氧化还原反应、酸碱反应、配合物等内容。
1. 元素周期律元素周期律是化学的基本定律之一,它揭示了元素原子的内部结构和元素性质之间的规律性联系。
人教版高中化学教材通过介绍元素周期表的发展历史、元素周期律的发现过程以及元素周期表中的元素分布规律,使学生对元素周期律有一个初步的认识。
2. 离子反应离子反应是指由离子参与的化学反应。
人教版高中化学教材通过介绍离子的形成、离子反应的类型(如置换反应、双置换反应、加合反应等)以及离子反应的应用,使学生掌握离子反应的基本概念和规律。
3. 氧化还原反应氧化还原反应是指物质之间发生电子转移的反应。
人教版高中化学教材通过介绍氧化还原反应的概念、氧化数、氧化还原反应的类型(如置换反应、加合反应等)以及氧化还原反应的应用,使学生掌握氧化还原反应的基本概念和规律。
4. 酸碱反应酸碱反应是指酸和碱之间发生的质子转移反应。
人教版高中化学教材通过介绍酸碱的定义、酸碱的性质、酸碱反应的类型(如中和反应、沉淀反应等)以及酸碱反应的应用,使学生掌握酸碱反应的基本概念和规律。
5. 配合物配合物是由中心金属离子与配体通过配位键结合形成的化合物。
人教版高中化学教材通过介绍配合物的组成、性质、分类以及配合物的应用,使学生了解配合物的基本概念和特点。
二、有机化学有机化学是研究碳元素及其与其他元素组成的化合物的性质、组成、结构、变化规律及其与能量的关系的科学。
人教版高中化学教材中的有机化学部分主要包括:烃及其衍生物、卤代烃、醇酚醚、醛酮醌、羧酸及其衍生物、生命活动中的有机化合物等内容。
醇醚酚知识点总结一、醇的基本性质醇是一类具有羟基(-OH)官能团的化合物,它们的结构中含有碳-氧-氢键。
醇通常具有较强的极性和亲水性,能够与水发生氢键作用,因此常常用作溶剂和中间体。
醇还具有一定的酸碱性,称为醇基。
在酸性条件下,醇可以被质子化,形成醇盐,具有一定的亲核性。
在碱性条件下,醇可以脱质子化,形成醇醚酚负离子,参与亲核取代反应。
醇的醇基对其性质有一定影响,醇基的醇性随着醇基数量的增加而增强,醇基位置对醇的性质也有一定影响。
另外,醇分子中的碳-氢键还可以发生氧化反应,生成醛、酮等产物。
二、醚的基本性质醚是一类具有氧-碳-碳键的有机化合物,具有较高的惰性和较低的沸点,通常用作非极性溶剂。
醚的结构中,氧原子与两个碳原子通过共价键连接,环状醚分子中还存在着环张力,因而环状醚分子具有一定的活性。
醚的惰性使得它对氧化还原反应不敏感,因此可以作为还原剂或氧化剂。
醚分子中的氧原子还能与金属形成络合物,因此醚也被广泛应用于金属有机化学中。
醚还具有较高的内部旋转自由度,使得其分子结构可以存在多种构象。
这种特性使得醚能够形成副产物,并对化学反应产生影响。
三、酚的基本性质酚是一类具有氢氧酚基的有机化合物,通常含有环状结构。
酚的结构中,氢氧酚基对其性质具有重要影响,氢氧酚基能够增加分子的极性和亲水性。
酚分子中的氢原子可以被取代成为相应的酚衍生物。
酚具有较高的亲电性,能够与亲电试剂发生取代反应,并具有较高的活性。
酚还能发生芳香性亲电取代反应,形成取代酚化合物。
由于酚分子中含有羟基,因此具有一定的酸碱性。
在酸性条件下,酚会失去羟基质子化,形成酚盐;在碱性条件下,酚则失去氢离子形成酚负离子。
四、醇醚酚的制备方法通常情况下,制备醇醚酚化合物的方法主要包括以下几种。
1. 醇的制备方法醇可以通过卤代烃与金属卤化物反应制备。
另外,在烯烃水合反应和羧酸加氢反应中也可以得到醇。
2. 醚的制备方法醚可以通过醇的脱水反应制备,其中脱水剂可以是酸或碱。