理想气体的压强和温度
- 格式:ppt
- 大小:220.50 KB
- 文档页数:9



理想气体的压强与温度
根据理想气体状态方程,理想气体的压强与温度之间存在以下关系:P * V = n * R * T
其中,P为气体的压强,V为气体的体积,n为气体的物质的量,R
为气体常数,T为气体的绝对温度。
由上述方程可以推导出,理想气体的压强与温度成正比关系,即当
温度升高时,压强也会增加;当温度降低时,压强也会减小。
这是因
为温度的增加会使气体内分子的平均动能增加,分子运动更加剧烈,
从而增加碰撞力,导致气体的压强增加。
需要注意的是,上述关系在气体的体积和物质的量不发生变化的条
件下成立。
同时,上述关系只适用于符合理想气体状态的气体,即低压、高温下气体分子之间几乎没有相互作用,可以近似看作质点。
对
于高压或低温下的气体,分子之间的相互作用不能忽略,此时可能需
要考虑气体的比较复杂的状态方程。


理想气体的等温过程压强体积与温度的变化规律理想气体的等温过程是指在恒定温度下,气体的体积与压强之间的关系。
根据理想气体状态方程PV=nRT(其中P为气体的压强,V为气体的体积,n为气体的物质量,R为气体常数,T为气体的温度),我们可以推导出理想气体的等温过程中的压强体积与温度的变化规律。
首先,我们假设对于一个特定的理想气体,在等温过程中,其物质量和气体常数保持不变。
这样,我们可以将状态方程简化为PV=常数。
根据这个简化后的方程,我们可以得到等温过程中的压强体积关系。
当气体的体积变化时,根据PV=常数,压强和体积的乘积始终保持不变。
这意味着,当气体的体积增加时,其压强会相应地减小;而当气体的体积减小时,其压强会相应地增加。
这是因为在等温过程中,气体的温度不变,气体分子的平均动能也保持不变。
当气体膨胀时,分子撞击容器壁的频率降低,因此压强减小;而当气体被压缩时,分子撞击容器壁的频率增加,压强增加。
而根据理想气体状态方程,PV=nRT,当温度不变时,P、V、n均保持不变,而R是一个常数。
因此,P和V之间的关系可以表示为P=k/V(其中k为常数)。
这意味着在等温过程中,压强和体积呈反比关系。
当气体的体积变大时,其压强会相应地变小;当气体的体积变小时,其压强会相应地变大。
综上所述,在理想气体的等温过程中,压强体积与温度的变化规律可以归纳如下:1. 当气体的体积增加时,压强减小;2. 当气体的体积减小时,压强增加;3. 压强和体积成反比关系,即压强和体积的乘积保持不变;4. 温度不变。
这些规律也可以通过实验进行验证。
通过控制气体在恒定温度下的体积变化,并测量相应的压强变化,我们可以得到实验数据,从而得出以上规律。
理解理想气体的等温过程以及压强体积与温度的变化规律对于理解气体行为和热力学过程具有重要意义。
在实际应用中,例如工程热力学、气象学等领域,我们可以通过这些规律来研究和预测气体的行为,为实际问题的解决提供指导。


气体状态理想气体与压强体积温度的关系理想气体是指在一定温度范围内,无论其是何种气体,都服从理想气体状态方程,即PV = nRT。
在这个方程中,P代表气体的压强,V 代表气体的体积,n代表气体的物质量,R为气体常数,T代表气体的温度。
根据理想气体状态方程,我们可以推导出理想气体与压强、体积和温度之间的关系。
下面将分别讨论这三个关系。
压强与体积之间的关系:根据理想气体状态方程PV = nRT,我们可以得到压强与体积之间的关系:P1V1 = P2V2其中P1和V1分别代表气体初态的压强和体积,P2和V2分别代表气体末态的压强和体积。
从这个式子中,我们可以看出压强和体积是成反比关系的。
当气体的体积增大时,其压强会减小;相反,当气体的体积减小时,其压强会增大。
体积与温度之间的关系:根据理想气体状态方程PV = nRT,我们可以将其转化为:V1/T1 = V2/T2其中V1和T1分别代表气体初态的体积和温度,V2和T2分别代表气体末态的体积和温度。
从这个式子中,我们可以看出体积和温度是成正比关系的。
当气体的温度增大时,其体积也会增大;相反,当气体的温度减小时,其体积也会减小。
压强与温度之间的关系:根据理想气体状态方程PV = nRT,我们可以将其转化为:P1/T1 = P2/T2其中P1和T1分别代表气体初态的压强和温度,P2和T2分别代表气体末态的压强和温度。
从这个式子中,我们可以看出压强和温度也是成正比关系的。
当气体的温度增大时,其压强也会增大;相反,当气体的温度减小时,其压强也会减小。
综上所述,理想气体的压强、体积和温度之间存在着一定的关系。
通过理想气体状态方程,我们可以推导出压强与体积、体积与温度、压强与温度之间的关系。
这些关系很好地描述了气体状态的变化规律,对于理解气体行为和研究气体性质具有重要意义。

理想气体状态方程理想气体的压强体积和温度关系理想气体状态方程是描述理想气体性质的基本方程,它揭示了理想气体压强、体积和温度之间的关系。
该方程由三个参数组成,分别是压强P、体积V和温度T。
理想气体状态方程可以表示为P×V =n×R×T,其中n是气体的物质量,R是气体常数。
理想气体状态方程起源于理想气体模型,这个模型假设气体分子之间不存在相互作用力,气体分子体积可以忽略不计。
在这个模型下,理想气体的状态完全由其压强、体积和温度决定,而与气体的化学性质无关。
首先我们来推导理想气体状态方程。
根据达尔顿气体定律,气体的总压强等于各种气体分子的部分压强之和。
设有一理想气体在一个封闭的容器中,假设此气体由n个分子组成,每个分子的质量为m。
根据牛顿第二定律,气体分子会受到来自容器壁以及其他分子的撞击力,这些力使得气体分子发生变速度,从而改变其动量。
根据运动学知识可知,分子的动量变化与力的大小和分子作用时间的乘积成正比。
因此,气体的压强可以定义为单位面积上分子碰撞引起的动量变化率。
假设容器的底面积为A,那么单位时间内容器底面积上总的分子撞击次数为naV,其中na为单位体积中分子的数目,V为容积。
由于分子在单位时间内碰撞的次数与分子的速度和体积成正比,我们可以得到p = \frac{naV}{A} = n\frac{m}{V} \frac{v}{4}\,其中v为分子的平均速度。
等式右边第一个项表示单位体积中分子的数目,即分子的物质量n除以体积V。
第二个项表示分子速度v的平方对分子平均速度v的平方的比值。
根据动理学理论可知,分子的平均动能与温度成正比。
因此,我们可以用kT代替分子的平均动能,其中k为玻尔兹曼常数。
将平均速度v表示为平均动能kT与分子质量m之间的关系,我们可以得到v =\sqrt{\frac{{2kT}}{{m}}}\。
将此式代入压强的表达式中,我们可以得到p = \frac{1}{4}na\sqrt{\frac{{2kT}}{{m}}}\。

温度体积压强公式
温度、体积和压强之间的关系可以通过以下公式表示:
PV = nRT
该公式称为理想气体状态方程,其中 P 为压强,V 为体积,n 为气体的物质的量,R 为气体常数,T 为温度。
该公式表明了在一定温度下,气体的压强和体积成反比关系,即压强随着体积的减小而增加。
而当体积一定时,气体的压强和温度成正比关系,即压强随着温度的增加而增加。
这就是说,在一定量的气体中,温度和压强是相互依存的,两者必须保持常数。
该公式是理想气体状态方程,它适用于大多数气体,但并不适用于所有气体,比如二氧化碳和氧气等。

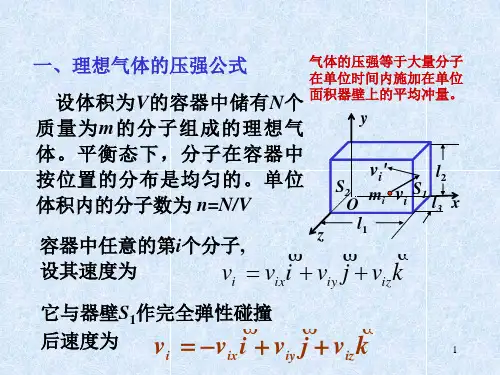
一、理想气体的压强公式1.压强的产生气体作用于器壁的压力是气体中大量分子对器壁不断碰撞的综合效果。
由于是大量分子对器壁的碰撞,就使得器壁受到一个持续的、均匀的压力的作用。
压强即为单位面积上作用器壁上的平均冲力。
2.气体压强公式的简单推导假设有一个边长为x ,y ,z 的长方形容器,其中含有N 个同类理想气体分子,每个分子质量均为m 。
在平衡状态下,长方形容器各个面的压强应当是相等的。
现在我们来推导作用在与x 轴垂直的面1A 的压强。
以第i 个分子为研究对象。
设在某一时刻其速度为k v j v i v v iz iy ix i ++=,它与器壁碰撞必受到器壁的作用力。
在此力的作用下,i 分子在x 轴上(以x 轴为研究对象,取标量式)的动量由ix mv 变为ix mv -。
根据动量定理,i 分子在x 轴上所受的冲量等于该分子在该坐标轴上的动量的增量,即:ixix ix i mv mv mv t f 2-==∆--i 分子对器壁的碰撞是间歇的,它从A 1面弹回,飞向A 2面与A 2面碰撞,又回到A 1面再作碰撞。
i 分子与A 1面碰撞两次,在x 轴上运动的距离为2x ,所需的时间为2x/v ix ,于是在单位时间内,i 分子作用在A 1面的次数是v ix /2x ,单位时间内i 分子作用在A 1面的冲力为x mv v x mv ix ix ix 2)/2(2-=-,这也就是容器壁对i 分子的平均冲力,由牛顿第三定律知道,i 分子施于器壁的冲力为xmv f ix i 2=N 个气体分子施于器壁的总冲力为上述单个分子给予器壁的冲力的总和(同类气体分子的质量相等),即)....(22221∑∑+++==xv v v m f F Nx x x i x 给上式右边上下同乘以N 得222221)....(x Nx x x i x v xNm N v v v x Nm f F ∑∑=+++==根据压强的定义,(1A 面的面积S=yZ ),则 22x x x x v nm v xyzNm yz F P === 其中n=N/V 为单位体积内的分子数,称为分子数密度。
气体压强体积和温度的关系公式
1. 理想气体状态方程。
- 理想气体状态方程为pV = nRT。
- 其中p是气体压强,单位是帕斯卡(Pa);V是气体体积,单位是立方米(m^3);n是气体的物质的量,单位是摩尔(mol);R是摩尔气体常数,R =
8.314J/(mol· K);T是气体的热力学温度,单位是开尔文(K)。
2. 压强与体积、温度的关系(当n和R为常数时)
- 由pV=nRT可得p=(nRT)/(V),这表明当温度T不变(等温过程)时,压强p和体积V成反比,即p_1V_1 = p_2V_2(玻意耳定律)。
- 当压强p不变(等压过程)时,体积V和温度T成正比,即
(V_1)/(T_1)=(V_2)/(T_2)(盖 - 吕萨克定律)。
- 当体积V不变(等容过程)时,压强p和温度T成正比,即
(p_1)/(T_1)=(p_2)/(T_2)(查理定律)。
一定质量的气体在体积不变的情况下压强与温度的关系式一定质量的气体在体积不变的情况下,压强与温度的关系式是理想气体状态方程的一部分。
理想气体状态方程是描述理想气体行为的方程,它包括了气体的压力、体积和温度之间的关系。
根据理想气体状态方程,一定质量的气体在体积不变的情况下,压强与温度的关系式可以用数学公式表示为P1/T1=P2/T2,其中P1和T1分别是气体的初始压强和温度,P2和T2分别是气体的最终压强和温度。
在深入探讨这一关系式之前,让我们先简单了解一下理想气体状态方程的基本原理。
理想气体状态方程可以表示为PV=nRT,其中P代表气体的压力,V代表气体的体积,n代表气体的物质量,R代表气体常数,T代表气体的温度。
这个方程描述了理想气体的状态,即在一定质量下的理想气体,在体积不变的情况下,压力与温度成正比。
了解了理想气体状态方程的基本原理,我们可以开始探讨一定质量的气体在体积不变的情况下,压强与温度的关系式P1/T1=P2/T2了。
这个关系式实际上是描述了玻义-马利约定律,也被称为查理定律。
根据该定律,如果一定质量的气体在体积不变的情况下,其压力与温度成正比。
这意味着,当温度升高时,气体的压力也会升高;当温度下降时,气体的压力也会下降。
具体来说,如果一定质量的气体在体积不变的情况下,将其温度从初始温度T1升高到最终温度T2,那么根据查理定律,其压力也会从初始压力P1升高到最终压力P2。
这种线性关系使得一定质量的气体在体积不变的情况下,压强与温度的关系式成为了一条直线。
这一关系式的数学表示P1/T1=P2/T2清晰地展现了气体压强与温度之间的简单而直接的关系。
除了数学表达之外,我们可以通过一些实际的例子来更直观地理解一定质量的气体在体积不变的情况下,压强与温度的关系式。
假设我们有一定质量的气体,它在一个封闭的容器中,容器的体积保持不变。
当我们向容器中加热时,气体的温度会上升,根据查理定律,气体的压力也会增加。