理想气体的压强公式
- 格式:pptx
- 大小:436.51 KB
- 文档页数:21

化学气体压力计算公式压力是指气体对容器壁施加的力的大小,是描述气体分子运动性质的一个重要参数。
在化学实验和工业生产中,我们经常需要计算气体的压力。
本文将介绍一些常用的化学气体压力计算公式,帮助读者更好地理解和应用。
1. 理想气体状态方程理想气体状态方程(也称为理想气体定律)是描述气体状态的一个重要公式,它与压力、体积、温度和气体的摩尔数之间建立了关系。
理想气体状态方程的公式如下:PV = nRT其中,P表示气体的压力(单位为帕斯卡,Pa),V表示气体的体积(单位为立方米,m³),n表示气体的摩尔数(单位为摩尔,mol),R为气体常数(单位为焦耳·摩尔⁻¹·开尔文⁻¹,J·mol⁻¹·K⁻¹),T表示气体的温度(单位为开尔文,K)。
根据理想气体状态方程,我们可以通过已知的气体参数计算其他未知参数的值,或者进行气体混合、反应等问题的计算分析。
2. 压强和摩尔分数的关系在混合气体的计算中,有时我们需要知道某种气体的分压,即该气体在混合气体中所占的压力比例。
根据道尔顿分压定律,我们可以使用以下公式计算某种气体的分压:其中,P₁表示某种气体的分压(单位为帕斯卡,Pa),P表示混合气体的总压力(单位为帕斯卡,Pa),X₁表示该气体的摩尔分数。
摩尔分数(也称为物质的摩尔分数或组分的摩尔分数)是指某种物质或组分在混合物中所占的摩尔数与总摩尔数之间的比例关系。
计算摩尔分数的公式如下:n₁X₁ = ------------n₁ + n₂ + ...其中,n₁表示某种物质或组分的摩尔数,n₂表示另一种物质或组分的摩尔数,以此类推。
3. 两种气体的压力比和摩尔比关系在某些实际应用中,我们需要计算两种气体的相对压力或摩尔比。
根据理想气体状态方程和摩尔分数的关系,我们可以推导出两种气体之间压力比和摩尔比之间的关系。
假设有两种气体A和B,在相同温度和体积下,它们的摩尔分数分别为X₁和X₂,压力分别为P₁和P₂。

大气压强计算公式大气压强是指单位面积上受到大气分子碰撞的力的大小。
根据分子动理论,大气压强可以用分子的平均动能来计算。
大气压强计算的公式可以根据不同的假设和模型而有所不同,下面将介绍两种常见的计算方法。
1.理想气体状态方程计算方法理想气体状态方程描述了理想气体的状态,即PV=nRT,其中P表示气体的压强,V表示气体的体积,n表示气体的物质量,R为气体常数,T 为气体的绝对温度。
根据理想气体状态方程,可以得到计算大气压强的公式:P=nRT/V其中,n为气体的物质量,R为气体常数,T为气体的绝对温度,V为气体的体积。
在计算大气压强时,我们通常将气体的物质量和体积固定在单位面积上,即n/V=m/A,其中m为单位面积上的气体质量,A为单位面积。
将上述公式代入理想气体状态方程中,可得P=(m/A)RT这就是用理想气体状态方程计算大气压强的公式。
需要注意的是,这个公式适用于理想气体的情况,对于非理想气体,需要考虑修正因子。
2.巴斯卡定律计算方法巴斯卡定律是描述液体或气体在静止状态下受到压力的规律。
根据巴斯卡定律,当外力作用在静止的液体或气体上时,液体或气体内部的压力均匀分布,且与液体或气体的形状无关。
根据巴斯卡定律,可以得到计算大气压强的公式:P=F/A其中,P表示压强,F表示外力的大小,A表示力作用面的面积。
对于大气压强的计算,我们将F选为单位面积上所受到的压力,即气体单位面积的质量乘以重力加速度,即F=m×g将这个公式代入巴斯卡定律中,可以得到P=(m×g)/A这就是用巴斯卡定律计算大气压强的公式。
需要注意的是,这个公式适用于单位面积上承受等压力的情况,对于不均匀分布的压力,需要考虑面积的变化。
总结:大气压强的计算可以采用理想气体状态方程或巴斯卡定律。
理想气体状态方程适用于理想气体的情况,其计算公式为P=(m/A)RT。
巴斯卡定律适用于液体或气体的压力均匀分布的情况,其计算公式为P=(m×g)/A。

1.理想气体物态方程:pV=NkT 变形1:Pv=νRT (R=N A k)变形2:P=nkT (n=N/V为分子数密度)2.理想气体压强公式:P=(1/3)nmv^2 变形:P=2/3nεk (εk分子平均平动动能)3理想气体平均平动动能与温度关系:1/2mv^2=εk=3/2kT4方均根速率: Vrms=(3kT/m)^(1/2)= (3Rt/M)^(1/2)5自由度:单i=3 双刚=5 双非=7 三以上刚=6 ε =i1/2kT6理想气体内能:E=N A i1/2kT =i/2RT7三种统计速率:1)最概然速率V p=(2kT/m)^(1/2)= (2RT/M)^(1/2) 2)平均速率v =(8kT/πm)^(1/2) 3)4 8分子平均碰撞次数:Z,分子连续两次碰撞间的路程均值叫做平均自由程λλ=v/ Z Z =1.41πd ^2 vn 9准静态过程中体积变化做功:ΔW=PΔV=(Sv1v2)pdV10.摩尔定体热容:C v,m=dQ/dT dE=:C v,m* dT11热机效率:η=W/Q1 =(Q1-Q2)/Q1 =1-Q1/Q2 (Q1为吸热量 Q2为热源吸收量)12等体过程中V为常量,即dW=0 dQ=dE 吸收热量全部转化为内能13转动定理:M=Jα常见转动惯量1)中心轴细棒:ml^2 /12 2)圆柱体:mR^2 / 2 3)薄圆环J=mR24)端点轴细棒:J=ml2/14平行轴定理:J=J C+md215电容器电能:W=1/2 QU=1/2 CU216 电场能量密度:w=1/2εΕ217.磁场能量:W=1/2 LI2 密度w=W/V=B2/2μ19.毕奥撒法尔定律:dB=(μ0/4π)*(Idlsinθ/r^2)= (μ0/4π)*(Idl e r/r^2)20.运动电荷磁场:B=(μ0/4π)*(qvr/r^3)21.无限长直导线B=μ0I/2πr022.库伦定律 F=(1/4πε0)(q1q2/r^2)e r23圆形载流导线轴线上一点 B=(μ0/2)(R2I/(R2+x2)3/2) x>>R B=μ0IR2/2x3A-B 等温膨胀内能不变对外做功W1=从T1高温处吸热Q1W1=Q1=vRTT1ln(V2/V1)B-C 绝热膨胀对外做功等于气体减少的内能W2=vCv,m(T1-T2)C-D 等温压缩:外界对气体做功等于气体给低温热源的热量W3=Q2= vRTT2ln(V4/V3)。

理想气体的压强与温度
根据理想气体状态方程,理想气体的压强与温度之间存在以下关系:P * V = n * R * T
其中,P为气体的压强,V为气体的体积,n为气体的物质的量,R
为气体常数,T为气体的绝对温度。
由上述方程可以推导出,理想气体的压强与温度成正比关系,即当
温度升高时,压强也会增加;当温度降低时,压强也会减小。
这是因
为温度的增加会使气体内分子的平均动能增加,分子运动更加剧烈,
从而增加碰撞力,导致气体的压强增加。
需要注意的是,上述关系在气体的体积和物质的量不发生变化的条
件下成立。
同时,上述关系只适用于符合理想气体状态的气体,即低压、高温下气体分子之间几乎没有相互作用,可以近似看作质点。
对
于高压或低温下的气体,分子之间的相互作用不能忽略,此时可能需
要考虑气体的比较复杂的状态方程。

理想气体状态方程的两个公式
理想气体状态方程可以用两个不同的公式来表示。
首先,根据理想气体的状态方程,我们可以使用PV = nRT这个公式。
在这里,P代表气体的压力,V代表气体的体积,n代表气体的物质量,R代表气体常数,T代表气体的温度。
这个公式描述了理想气体在一定温度和压力下的状态。
另外一个常用的理想气体状态方程的公式是pV = NkT。
在这个公式中,p代表气体的压强,V代表气体的体积,N代表气体分子的数量,k代表玻尔兹曼常数,T代表气体的温度。
这个公式描述了气体微观粒子(分子或原子)的状态与温度之间的关系。
这两个公式都是描述理想气体状态的重要方程,它们在热力学和物理化学中有着广泛的应用。
通过这些公式,我们可以了解气体在不同条件下的性质和行为,对于工程、科学实验以及工业生产都具有重要意义。
希望这样的回答能够满足你的需求。
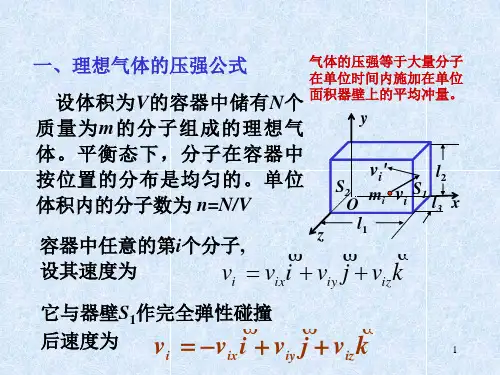

理想气体平均压强的计算公式知乎以理想气体平均压强的计算公式理想气体是研究气体行为的一种理想化模型,它假设气体分子之间没有相互作用力,体积可以忽略不计。
在研究理想气体时,我们经常需要计算气体的平均压强。
下面将介绍一种计算理想气体平均压强的方法。
我们需要了解理想气体的状态方程,即气体的状态可以由压强、体积和温度来描述。
根据理想气体状态方程,我们可以得到以下公式:PV = nRT其中,P表示气体的压强,V表示气体的体积,n表示气体的物质的量,R表示气体常数,T表示气体的温度。
这个公式描述了理想气体在一定条件下的状态。
为了计算理想气体的平均压强,我们需要考虑气体分子的碰撞。
根据动理学理论,气体分子的平均动能与温度有关。
当气体分子与容器壁碰撞时,会产生一个冲量,从而对容器壁施加压力。
这个压力就是我们所说的气体的压强。
根据动理学理论,我们可以得到以下公式来计算理想气体的平均压强:P = (2/3) * (N/V) * (1/2) * m * v^2其中,P表示气体的平均压强,N表示气体分子的数目,V表示气体的体积,m表示气体分子的质量,v表示气体分子的平均速率。
通过上述公式,我们可以看出,理想气体的平均压强与气体分子的数目、体积、质量以及平均速率有关。
当气体分子的数目增加、体积减小、质量增加或者平均速率增加时,气体的平均压强也会相应增加。
需要注意的是,上述公式是在理想气体的假设下得到的,实际气体可能存在分子间的相互作用力,体积也不能忽略不计。
因此,在实际应用中,我们需要根据具体情况选择适当的模型和方法来计算气体的压强。
总结起来,理想气体的平均压强可以通过考虑气体分子的碰撞来计算。
根据动理学理论,我们可以得到一个与气体分子数目、体积、质量以及平均速率相关的公式来计算平均压强。
然而,需要注意的是,这个公式是在理想气体的假设下得到的,实际气体可能存在其他因素需要考虑。
希望通过本文的介绍,读者对于理想气体平均压强的计算有了更清晰的认识。



气体压强三大公式气体压强是物理学中非常重要的一个概念,它是指气体对单位面积的作用力,通常用帕斯卡(Pa)作为单位。
在研究气体压强时,我们需要掌握三个重要的公式,分别是波义耳-马氏定律、理想气体状态方程和克劳修斯-克拉佩龙方程。
一、波义耳-马氏定律波义耳-马氏定律是描述气体温度和压强之间关系的重要公式。
该定律的表述为:“在恒定体积下,气体的压强与温度成正比例关系”。
即:P ∝ T其中,P表示气体的压强,T表示气体的温度。
该公式表明,当气体的温度升高时,其压强也会随之升高。
波义耳-马氏定律的应用非常广泛,例如在气象学中,可以用它来描述气压随着高度的变化规律。
二、理想气体状态方程理想气体状态方程是描述气体状态的重要公式,它可以用来计算气体的压强、体积和温度之间的关系。
该公式的表述为:PV = nRT其中,P表示气体的压强,V表示气体的体积,n表示气体的物质量,R为气体常数,T表示气体的温度。
该公式表明,当气体的温度升高时,其压强和体积也会随之升高。
理想气体状态方程的应用非常广泛,例如在化学、物理和工程学等领域中,可以用它来计算气体的性质和行为。
三、克劳修斯-克拉佩龙方程克劳修斯-克拉佩龙方程是描述气体流动的重要公式,它可以用来计算气体的流速、压强和密度之间的关系。
该公式的表述为:ρv/2 + P = constant其中,ρ表示气体的密度,v表示气体的流速,P表示气体的压强。
该公式表明,当气体的密度和流速发生变化时,其压强也会发生变化。
克劳修斯-克拉佩龙方程的应用非常广泛,例如在航空、汽车和化工等领域中,可以用它来计算气体的流动性质和行为。
总结气体压强三大公式分别是波义耳-马氏定律、理想气体状态方程和克劳修斯-克拉佩龙方程。
这些公式是研究气体压强和流动性质的重要工具,对于理解和应用气体相关知识具有重要的意义。
在实际应用中,我们可以根据具体情况选择合适的公式进行计算和分析,以更好地解决问题。

压强的计算公式
压强的计算公式:P=F/S,液体压强p=ρgh
压强是指物体所受压力的大小与受力面积之比。
其用来比较压力产生的效果。
压强越大,压力的作用效果越明显。
压强的计算公式是:p=F/S(液体为p=ρgh),压强的单位是帕斯卡(简称帕),符号是Pa。
理想气体压强公式的推导前提是:忽略气体分子的自身体积,将分子看成质点;假设分子间没有相互吸引和排斥,即不计分子势能,分子之间及分子与器壁之间发生的碰撞是完全弹性的,不造成动能损失。
一言以蔽之:目中无人,唯我独尊,横冲直撞,完全弹性。
其公式分为宏观和微观,宏观公式即为克拉珀龙方程:Pv=nRT (P:压强,v:比容,n:物质的量,R:普适气体常数,T:温度);。
气体热力学公式
1.理想气体状态方程:P V = n R T
其中,P表示气体的压强,V表示气体的体积,n表示气体的物质量,R表示气体常数,T表示气体的绝对温度。
该方程适用于理想气体,在大多数情况下能够较准确地描述气体的状态。
2.热力学第一定律:ΔU = Q - W
其中,ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统所做的功。
该定律表明,系统的内能变化等于吸收的热量减去所做的功。
该定律适用于所有热力学系统。
3.热力学第二定律:ΔS ≥ 0
其中,ΔS表示系统的熵变化。
该定律表明,系统的熵永远不可能减少,即系统总是向着更加无序的状态发展。
该定律适用于所有热力学系统。
拓展:
1.热容:C = Q / ΔT
其中,C表示热容,Q表示系统吸收的热量,ΔT表示系统的温度变化。
热容是描述系统对热量的响应能力。
对于恒定压力下的系统,称为等压热容;对于恒定体积下的系统,称为等体热容。
2.平衡状态:热力学平衡状态是指系统的各项物理性质不随时间变化的稳定状态,达到平衡状态前系统一定要经过一个有限的过程,这个过程本身并不一定是平衡的。
3.吉布斯自由能:G = H - T S
其中,G表示系统的吉布斯自由能,H表示系统的焓,T表示系统的绝对温度,S表示系统的熵。
吉布斯自由能是热力学系统的一个重要状态函数,它描述了系统的稳定状态和可逆性。
在恒定温度和压力的情况下,吉布斯自由能具有最小值,这意味着系统处于稳定平衡状态。
热力学温度与压强公式整理热力学是研究物质内部热平衡状态及其与外界的相互作用的一门学科。
温度和压强是热力学中常用的两个重要参数。
本文将对热力学温度和压强的公式进行整理和介绍。
一、热力学温度公式热力学温度是一个物质内部热平衡状态的刻画,是物质分子运动速度和热量分布的表征。
根据理想气体状态方程,可以得到以下热力学温度公式:1.理想气体的温度公式:理想气体的温度与分子平均动能直接相关,可以用以下公式表示:T = (2/3) * (E_avg / k)其中,T为温度,E_avg为气体分子平均动能,k为玻尔兹曼常数。
2.理想气体的温标转换公式:不同的温标测量温度的单位不同,可以通过以下公式进行转换:T(℃)= T(K)- 273.15其中,T(℃)为摄氏温度,T(K)为开尔文温度。
二、热力学压强公式压强是指单位面积上受到的力的大小,在热力学中压强常用来描述气体的状态。
根据理想气体状态方程和压强定义,可以得到以下热力学压强公式:1.理想气体的压强公式:理想气体状态方程为:PV = nRT其中,P为压强,V为气体体积,n为气体的物质量,R为气体常数,T为气体的温度。
2.理想气体的分压公式:混合气体的总压强可以用各组分的分压之和表示,即:P_total = P₁ + P₂ + P₃ + ...其中,P_total为混合气体的总压强,P₁、P₂、P₃为各组分的分压。
3.理想气体的压强单位换算:不同的压强单位之间存在一定的换算关系,常用的单位换算公式如下:1 atm = 760 mmHg = 101325 Pa其中,atm为大气压,mmHg为毫米汞柱压强,Pa为帕斯卡。
综上所述,热力学温度与压强的公式整理如上。
通过这些公式,我们可以更好地理解热力学的基本概念和性质,进一步应用于相关的热力学计算和实际问题的解决中。