初中化学元素相对原子质量
- 格式:doc
- 大小:35.00 KB
- 文档页数:1

初中化学相对原子质量用背
相对原子质量是指元素的原子质量相对于碳12同位素的质量的比值。
为了方便比较不同元素的原子质量,化学家将碳12的原子质量定义为12。
其他元素的原子质量则是相对于碳12的质量计算得出的。
相对原子质量的计算可以使用元素的相对原子质量(也称为相对原子质量)进行。
元素的相对原子质量可以从元素周期表中获得,通常以一个整数来表示。
例如,氢的相对原子质量是1,氧的相对原子质量是16。
这意味着氧原子的质量是氢的16倍。
通过相对原子质量,可以计算出化合物的相对分子质量。
化合物的相对分子质量是由其组成元素的相对原子质量加权求和而得到的。
例如,水分子的相对分子质量是由氢的相对原子质量乘以2,再加上氧的相对原子质量得到的。
相对原子质量在化学中具有重要的应用。
通过相对原子质量,可以计算化学反应中物质的质量比例和反应的化学计量比。
此外,相对原子质量还可以用于计算化学反应中物质的反应量和理论产量。
总之,在化学中,相对原子质量是一种重要的工具,用于比较元素和计算化合物的质量。
通过相对原子质量,化学家可以研究和理解化学反应,从而推动化学科学的发展。

中考化学相对原子质量相对原子质量是化学中一个非常重要的概念,用以表示各种化学元素相对于碳-12同位素的质量比值。
下面将详细介绍相对原子质量的概念、计算方法、应用和相关知识。
一、相对原子质量的概念相对原子质量是指一个元素的原子质量与碳-12同位素的质量之比。
碳-12同位素被选为计量标准,其原子质量被定义为12。
相对原子质量是一个纯数,没有单位。
元素的相对原子质量可以通过质谱仪等实验仪器测定,也可以通过元素的同位素的存在丰度来计算。
二、相对原子质量的计算相对原子质量的计算是通过各种不同的同位素所占比例加权平均得出的。
例如,氧元素有3种同位素,分别是氧-16、氧-17和氧-18,其相对丰度分别为99.76%、0.04%和0.20%。
则氧元素的相对原子质量计算如下:(16 × 0.9976) + (17 × 0.0004) + (18 × 0.0020) ≈15.999。
三、相对原子质量的应用相对原子质量在化学中有广泛的应用。
首先,相对原子质量可以用来计算元素的物质的摩尔质量。
摩尔质量是指一个物质的质量与其摩尔数之比,单位是克/摩尔。
通过相对原子质量的计算,可以得到元素的摩尔质量,进而用来计算物质摩尔质量。
其次,相对原子质量可以用来计算化学方程式中的质量比和摩尔比。
例如,在氯化钠(NaCl)的化学方程式中,Na的相对原子质量为23,Cl的相对原子质量为35.5。
由此可以得出钠和氯的质量比为23:35.5,摩尔比为1:1。
此外,相对原子质量还可以用来计算化学反应中的反应物和生成物的质量和摩尔数之间的关系。
根据质量守恒和摩尔守恒定律,可以得出一个元素在反应中的质量和摩尔数之间的关系。
四、相对原子质量的其它知识1.相对原子质量与元素周期表:元素周期表上标有每个元素的相对原子质量。
相对原子质量通常以数字的形式标在元素符号的下方,有时也以小数形式出现。
2.相对原子质量与元素的性质:相对原子质量对元素的性质有一定的影响。

常见元素相对原子质量在化学的世界里,元素是构成物质的基本单元,而相对原子质量则是描述元素原子质量的重要指标。
相对原子质量的概念对于理解化学反应、化合物的组成以及化学计算都具有至关重要的意义。
接下来,让我们一起深入了解一些常见元素的相对原子质量。
氢(H),相对原子质量约为 1。
氢是宇宙中最常见的元素之一,也是构成水分子(H₂O)的重要成分。
它在许多化学反应中都扮演着关键的角色,比如与氧气反应生成水。
氦(He),相对原子质量约为 4。
氦是一种惰性气体,在一般条件下不易与其他物质发生反应。
它常用于填充气球和飞艇,因为它的密度比空气小。
碳(C),相对原子质量约为 12。
碳是生命的基础元素,构成了有机化合物的骨架。
从我们身体中的有机物到煤炭、石油等化石燃料,都离不开碳。
氮(N),相对原子质量约为 14。
氮气在空气中占了很大的比例,约 78%。
氮对于植物的生长至关重要,是许多肥料的重要成分。
氧(O),相对原子质量约为 16。
氧气是维持生命所必需的气体,我们呼吸的空气中约 21%是氧气。
同时,氧也是许多氧化物和含氧酸盐的组成部分。
钠(Na),相对原子质量约为 23。
钠在日常生活中常见于食盐(氯化钠,NaCl)中,它的化学性质活泼,在水中能迅速反应。
镁(Mg),相对原子质量约为 24。
镁是一种银白色的金属,在许多生物过程中发挥作用,也是制造轻合金的重要材料。
铝(Al),相对原子质量约为 27。
铝具有良好的导电性和延展性,广泛应用于航空、建筑和包装等领域。
硅(Si),相对原子质量约为28。
硅是半导体材料的重要组成部分,现代电子技术的发展离不开硅。
磷(P),相对原子质量约为 31。
磷在生物体内参与能量传递和遗传物质的组成,也是磷肥的主要成分。
硫(S),相对原子质量约为 32。
硫存在于许多矿物质中,如黄铁矿(FeS₂),也是一些蛋白质的组成部分。
氯(Cl),相对原子质量约为 355。
氯气具有强烈的刺激性气味,常用于消毒和制造化工产品。

元素的相对原子质量公式咱们在化学的世界里呀,元素的相对原子质量公式可是个重要的家伙!先来说说啥是元素的相对原子质量。
简单来讲,它就是把一个元素原子的质量跟一个标准值去比,得出的那个数。
这个标准值通常用碳-12 原子质量的 1/12 作标准。
那元素的相对原子质量公式到底是啥呢?其实就是:元素的相对原子质量 = 该元素一个原子的实际质量÷(一个碳-12 原子质量×1/12)。
这公式看起来有点复杂,别急,我给您举个例子。
比如说氧元素吧,咱们得先知道氧原子的实际质量,假设它是 2.657×10⁻²⁶千克。
一个碳-12 原子质量约是 1.993×10⁻²⁶千克。
那按照公式算,氧元素的相对原子质量就是 2.657×10⁻²⁶÷(1.993×10⁻²⁶×1/12)≈16 。
我还记得有一次,在给学生们讲这个知识点的时候,有个小家伙特别可爱。
他瞪着大眼睛,一脸迷茫地问我:“老师,为啥非得跟碳-12比呀,跟别的不行吗?”我笑着回答他:“这就好比咱们跑步比赛要有个统一的起跑线一样,碳-12 就是咱们化学世界里这个公平的起跑线。
”那孩子似懂非懂地点点头,后来在做题的时候,他居然把这个公式用得特别溜。
要想真正掌握元素的相对原子质量公式,光记住公式可不行,还得多多练习。
比如说给您一堆元素的原子质量,让您算相对原子质量,或者反过来,告诉您相对原子质量,让您去推测原子的实际质量。
这就像是搭积木,得一块一块地来,急不得。
而且啊,在化学的各种计算里,元素的相对原子质量可是经常露脸的。
比如算化合物中各元素的质量比,或者求一定质量的化合物中某元素的质量,都离不开它。
总之,元素的相对原子质量公式虽然看起来有点头疼,但只要您用心去理解,多做几道题练练手,它就会乖乖听您的话,成为您在化学学习中的好帮手!希望通过我的讲解,能让您对元素的相对原子质量公式有更清楚的认识,加油在化学的海洋里畅游吧!。

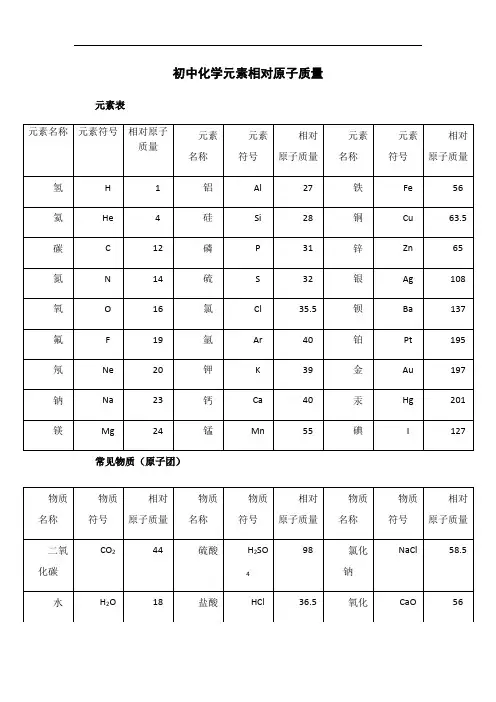
常用化学元素相对原子质量
化学元素是构成物质的基本单位,而相对原子质量则是描述元素中原子质量的重要参数。
相对原子质量是指元素中一个原子质量与碳-12同位素的质量之比。
碳-12的相对原子质量被定义为12,因此其他元素的相对原子质量是相对于碳-12的。
常用化学元素的相对原子质量是化学研究和实验中非常重要的数据,它们可以用于计算化学方程式中的摩尔质量和反应物质的数量。
以下是一些常用化学元素的相对原子质量:
氢(H)1.008。
氦(He)4.0026。
锂(Li)6.94。
铍(Be)9.0122。
硼(B)10.81。
碳(C)12.011。
氮(N)14.007。
氧(O)15.999。
氟(F)18.998。
氖(Ne)20.180。
这些相对原子质量的数据对于化学实验和计算非常重要。
它们可以用于计算化学反应中物质的摩尔质量,从而确定反应中物质的数量和反应产物的产量。
此外,相对原子质量还可以用于确定化学物质的化学式和分子式,以及计算化学反应中的摩尔比。
在化学研究和工程中,了解常用化学元素的相对原子质量是非常基础的知识。
它们为化学家和工程师提供了重要的数据,帮助他们进行化学实验和工程设计。
因此,相对原子质量是化学领域中不可或缺的重要参数。

初中化学相对原子质量用背
摘要:
一、相对原子质量的概念
二、初中化学中常用的相对原子质量
三、相对原子质量的计算方法
四、如何记忆相对原子质量
正文:
相对原子质量是初中化学中的一个重要概念,它是指一个原子的实际质量与碳-12原子质量的1/12的比值。
在初中化学中,我们经常需要用到一些常用的相对原子质量,如氢、碳、氮、氧、钠、镁、铝、硅、磷、硫、氯、钾、钙、锰、铁、铜、锌、银、钡、碘等。
计算相对原子质量的方法是以一种碳原子质量的1/12作为标准,其他原子与它相比较,所得的比值就是这种原子的相对原子质量。
例如,氢原子的实际质量为1.67410千克,那么它的相对原子质量就是1.67410/1.6710-27 = 1。
在记忆相对原子质量时,可以采用以下方法:
1.制作相对原子质量表,按照原子序数排列,方便查阅。
2.记住常用的相对原子质量,如氢、碳、氮、氧、钠、镁、铝、硅、磷、硫、氯、钾、钙、锰、铁、铜、锌、银、钡、碘等。
3.通过对比法记忆,例如,氢的相对原子质量是1,那么氧的相对原子质量就是16,因为氧是氢的16倍。
4.利用口诀或歌谣记忆,例如:“氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,硫氯氩钾钙,钪钛钒铬锰,铁钴镍铜锌,镓锗砷硒溴,氪氡钔镧铈,铕钆铽镝钬,铒铥镱镥钅”。

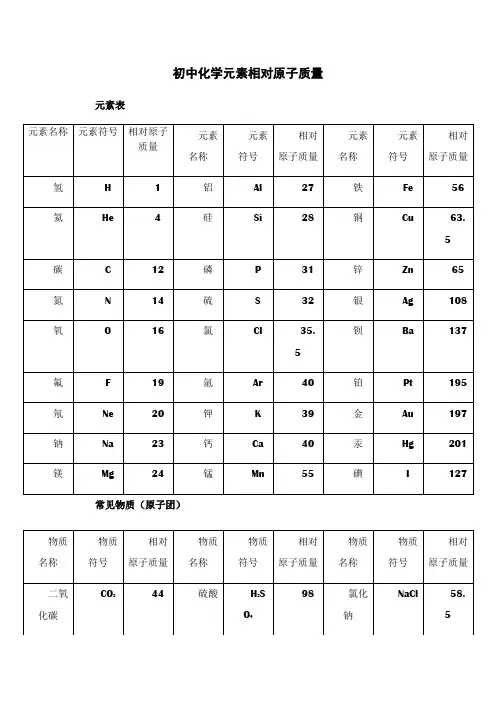
物质组成元素的质量比•定义:化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。
即各元素原子的相对原子质量总和之比。
计算的关键在于正确判断出各元素的原子总数。
公式:各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。
如化学式为AmBn的物质中,A、B两元素的质量比=(A的相对原子质量×m):(B的相对原子质量×n)。
•对概念公式的理解:(1)元素是宏观概念,只讲种类,不讲个数。
用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。
如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。
通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。
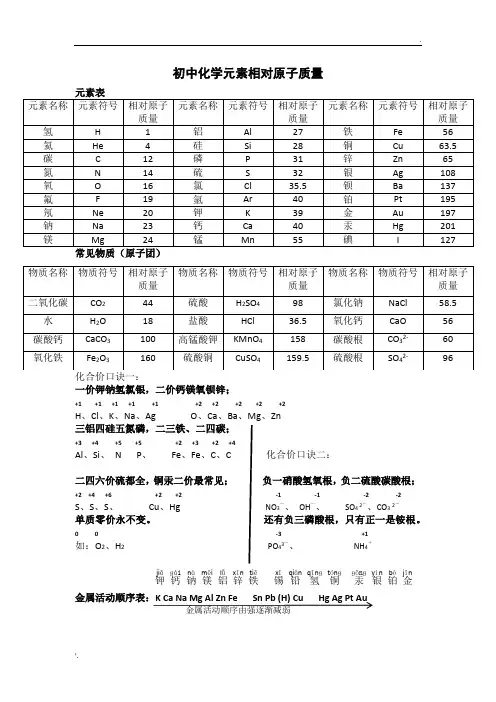

化学各元素的相对原子质量表在化学的世界里,相对原子质量是一个非常重要的概念。
它就像是元素的“身份证号码”,帮助我们在进行各种化学计算和理解化学反应时能够准确无误。
相对原子质量,简单来说,是指以一个碳-12 原子质量的 1/12 作为标准,其他原子的质量跟它相比较所得到的比。
让我们先来看看一些常见元素的相对原子质量。
氢(H)的相对原子质量约为 1008,它是宇宙中最常见的元素之一,也是构成许多有机化合物的重要成分。
氦(He)的相对原子质量约为 4003,它是一种惰性气体,常用于气球和飞艇中。
锂(Li)的相对原子质量约为6941,在电池技术中有着重要的应用。
铍(Be)相对原子质量约为9012。
硼(B)的相对原子质量约为1081。
碳(C)的相对原子质量约为 1201,它是生命的基础元素,有机化合物的“骨架”。
氮(N)约为1401,是构成蛋白质和核酸的重要元素。
氧(O)约为 1600,我们呼吸的氧气中就有它,也是许多氧化物的组成部分。
氟(F)约为 1900,是一种极其活泼的元素。
钠(Na)的相对原子质量约为 2299,在日常生活中的食盐(氯化钠)中就有它的身影。
镁(Mg)约为2431,是叶绿素的组成成分之一。
铝(Al)约为 2698,在建筑和制造业中广泛使用。
硅(Si)的相对原子质量约为2809,是半导体材料的重要组成部分。
磷(P)约为 3097,在化肥和生物化学中起着关键作用。
硫(S)约为3206,比如在硫酸这种常见的化学物质中就包含它。
氯(Cl)的相对原子质量约为 3545,是消毒剂和许多化合物的组成元素。
钾(K)约为 3910,对维持人体的正常生理功能至关重要。
钙(Ca)约为 4008,是骨骼和牙齿的主要成分。
铁(Fe)的相对原子质量约为 5585,在工业和生物体中都有着广泛的应用。
铜(Cu)约为 6355,常用于电线和电器制造。
锌(Zn)约为6538,对于人体的生长和免疫系统很重要。
银(Ag)的相对原子质量约为 10787,是一种常见的贵金属。