初中常见相对原子质量及相对分子质量
- 格式:docx
- 大小:18.11 KB
- 文档页数:1
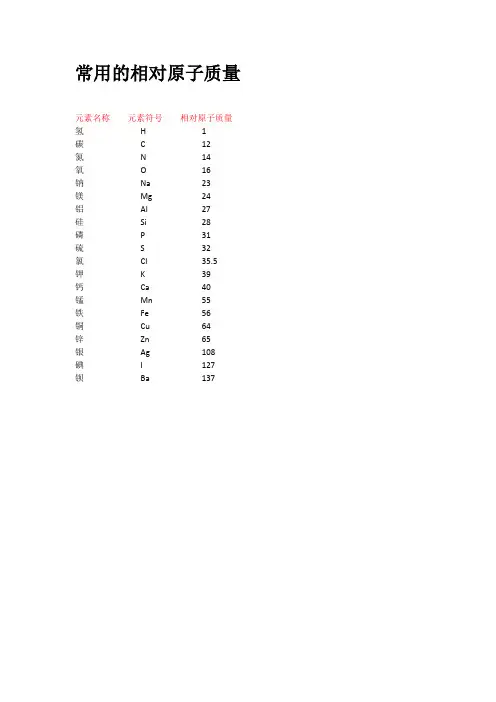
常用的相对原子质量元素名称元素符号相对原子质量氢H 1碳 C 12氮N 14氧O 16钠Na 23镁Mg 24铝Al 27硅Si 28磷P 31硫S 32氯Cl 35.5钾K 39钙Ca 40锰Mn 55铁Fe 56铜Cu 64锌Zn 65银Ag 108碘I 127钡Ba 137常用的相对分子质量物质名称化学式相对分子质量氢气H2 2氨气NH3 17氮气N228氧气O232水H2O 18过氧化氢H2O234一氧化碳CO 28二氧化碳CO244一氧化硫SO 48二氧化硫SO264三氧化硫SO380二氧化锰MnO287二氧化硅SiO260一氧化氮NO 30二氧化氮NO246五氧化二磷P2O5142氧化铁Fe2O3160氧化亚铁FeO 72四氧化三铁Fe3O4232氧化铜CuO 80氧化亚铜Cu2O 144氧化钠Na2O 62氧化镁MgO 40氧化钙CaO 56氧化铝Al2O3 102氧化锌ZnO 81氧化汞HgO 217氧化银Ag2O 232氧化铅PbO 223氯气Cl271氯化氢HCl 36.5氯化钾KCl 74.5氯化钠NaCl 58.5氯化镁MgCl295氯化钙CaCl2111氯化铜CuCl2135氯化锌ZnCl2136氯化钡BaCl2208氯化铝AlCl3133.5 氯化铁FeCl3162.5 氯化银AgCl 143.5 氯酸钾KClO3122.5 氯化铵NH4Cl 53.5氯化亚铁FeCl2 127物质名称化学式相对分子质量硫酸H2SO498硫酸锌ZnSO4161硫酸铵(NH4)2SO4132硫酸铜CuSO4160硫酸钡BaSO4233硫酸钙CaSO4136硫酸钾K2SO4174硫酸钠Na2SO4142硫酸镁MgSO4120硫酸铁Fe2(SO4)3400硫酸亚铁FeSO4152硫酸铝Al2(SO4)3342硫酸氢钠NaHSO4120硫酸氢钾KHSO4136亚硫酸H2SO382亚硫酸钠Na2SO3126硝酸HNO363亚硝酸HNO247硝酸钠NaNO385硝酸钾KNO3101硝酸银AgNO3170硝酸镁Mg(NO3)2148硝酸铜Cu(NO3)2188硝酸铵NH4NO380硝酸钙Ca(NO3)2164物质名称化学式相对分子质量碳酸H2CO362碳酸钠Na2CO3106碳酸钙CaCO3100碳酸镁MgCO384碳酸钾K2CO3 138碳酸氢铵NH4HCO379碱式碳酸铜Cu2(OH)2CO3222物质名称化学式相对分子质量氢氧化钠NaOH 40氢氧化钙Ca(OH)274氢氧化钡Ba(OH)2171氢氧化镁Mg(OH)2 58氢氧化铜Cu(OH)2 98氢氧化钾KOH 56氢氧化铝Al(OH)378氢氧化铁Fe(OH)3107氢氧化亚铁Fe(OH)290物质名称化学式相对分子质量氨水NH3·H2O 35高锰酸钾KMnO4158锰酸钾K2MnO4 197磷酸H3PO498磷酸钠Na3PO4164甲烷CH416乙炔C2H226乙烯C2H428甲醇CH3OH 32乙醇(酒精)C2H5OH 46乙酸(醋酸)CH3COOH 60明矾KAl(SO4)2·12H2O 474绿矾FeSO4·7H2O 278蓝矾(硫酸铜晶体)CuSO4·5H2O 250石膏CaSO4·2H2O 172熟石膏CaSO4·H2O 154碳酸钠晶体Na2CO3·10H2O 286尿素CO(NH2)260蔗糖C12H22O11342葡萄糖C6H12O6180。

相对原子质量相对分子质量12、熟练掌握有关化学式的计算(相对分子质量的计算、计算纯净物中各元素的质量比、1、相对原子质量:以一个碳-12(质子数和中子数均为6的碳原子)原子质量的作为标准,某原子的质量跟它相所得的数值,即是该种原子的相对原子质量,计算某原子的相对原子质量的公式,相对原子质量是一个比值,它的国际单位制单位为符号为(书写时一般省略不写)。
2、相对分子质量:表示物质的化学式里所有原子的总和。
相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得到的相对质量,它也是一个比值,国际单位制单位为“-”符号为“1”1、怎样理解相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得2、硫酸(H2SO4)的相对分子质量是98克,对吗?3、为什么质子数和中子数的和近似等于相对原子质量?4、如何计算胆矾(CuSO4·5H2O) 相对分子质量?5、能否根据物质中某元素的质量分数来判断该物质是否为纯净物?如碳元素质量分数为12%的石灰石是纯净物吗?判断某物质是否纯净物的标准是什么?例题1、已知一个碳-12原子的质量为1.993×10-26千克,镁的相对原子质量为24,求例题2、铁的某种氧化物中铁元素与氧元素的质量比为21:8,则该氧化物的相对分子质量为( )A、 72B、 160C、 232D、 256思考:先由铁元素与氧元素的质量比推断铁的某种氧化物的化学式,然后计算相对分子质量。
本题求化学式的方法有两种,请同学们自己推出。
例题3 一种含氧化铁的铁矿石,经测定含铁49%。
求矿石中氧化铁的质量分数。
思考:求矿石中氧化铁的质量分数,就是求不纯的含Fe2O3的矿石中纯的Fe2O3质量分数。
矿石中含铁元素的质量等于矿石中Fe2O3含有的铁元素质量。
矿石的质量×矿石中含铁的质量分数 = Fe2O3的质量× Fe2O3中含铁的质量分数巩固知识1、已知一个碳-12原子的质量为 1.993×10-26Kg,一个铁原子的质量为9.288×10-26Kg,则铁的相对原子质量为;氧原子的相对原子质量是16,则1个氧原子的质量是 Kg;银的相对原子质量是碳的相对原子质量的9倍,则银的相对原子质量是。

元素名称元素符号相对原子质量氢 H 1碳 C 12氮 N 14氧 O 16钠 Na 23镁 Mg 24铝 Al 27硅 Si 28磷 P 31硫 S 32 氯 Cl 35.5钾 K 39钙 Ca 40锰 Mn 55铁 Fe 56铜 Cu 64锌 Zn 65银 Ag 108碘 I 127 钡 Ba 137物质名称化学式相对分子质量氢气 H2 2氨气 NH3 17氮气 N2 28氧气 O2 32水 H2O 18过氧化氢 H2O2 34一氧化碳 CO 28二氧化碳 CO2 44一氧化硫 SO 48二氧化硫 SO2 64三氧化硫 SO3 80二氧化锰 MnO2 87二氧化硅 SiO2 60一氧化氮 NO 30二氧化氮 NO2 46五氧化二磷P2O5 142氧化铁 Fe2O3 160 氧化亚铁 FeO 72四氧化三铁Fe3O4 232 氧化铜CuO 80氧化亚铜 Cu2O 144氧化钠 Na2O 62氧化镁 MgO 40氧化钙 CaO 56氧化铝 Al2O3 102 氧化锌 ZnO 81 氧化汞 HgO 217 氧化银 Ag2O 232 氧化铅 PbO 223氯气 Cl2 71氯化氢 HCl 36.5氯化钾 KCl 74.5氯化钠 NaCl 58.5 氯化镁 MgCl2 95氯化钙 CaCl2 111氯化铜 CuCl2 135氯化锌 ZnCl2 136氯化钡BaCl2 208氯化铝AlCl3 133.5 氯化铁 FeCl3 162.5氯化银 AgCl 143.5 氯酸钾KClO3 122.5氯化铵NH4Cl 53.5氯化亚铁 FeCl2 127物质名称化学式相对分子质量硫酸 H2SO4 98硫酸锌 ZnSO4 161硫酸铵 (NH4)2SO4 132硫酸铜 CuSO4160硫酸钡 BaSO4 233硫酸钙 CaSO4 136硫酸钾K2SO4 174硫酸钠Na2SO4142硫酸镁 MgSO4 120硫酸铁Fe2(SO4)3 400硫酸亚铁 FeSO4 152硫酸铝 Al2(SO4)3 342硫酸氢钠 NaHSO4 120硫酸氢钾 KHSO4 136亚硫酸 H2SO3 82亚硫酸钠 Na2SO3 126硝酸 HNO3 63亚硝酸 HNO2 47硝酸钠NaNO3 85硝酸钾 KNO3 101硝酸银 AgNO3 170硝酸镁 Mg(NO3)2 148硝酸铜 Cu(NO3)2 188硝酸铵 NH4NO380硝酸钙 Ca(NO3)2 164物质名称化学式相对分子质量碳酸 H2CO3 62碳酸钠 Na2CO3 106碳酸钙 CaCO3 100碳酸镁 MgCO3 84碳酸钾 K2CO3 138碳酸氢铵 NH4HCO3 79碱式碳酸铜 Cu2(OH)2CO3 222物质名称化学式相对分子质量氢氧化钠 NaOH 40氢氧化钙 Ca(OH)2 74氢氧化钡 Ba(OH)2 171氢氧化镁Mg(OH)2 58氢氧化铜 Cu(OH)2 98氢氧化钾 KOH 56氢氧化铝 Al(OH)3 78氢氧化铁 Fe(OH)3 107 氢氧化亚铁 Fe(OH)2 90物质名称化学式相对分子质量氨水 NH3·H2O 35高锰酸钾 KMnO4 158锰酸钾 K2MnO4 197磷酸 H3PO4 98磷酸钠 Na3PO4 164甲烷 CH4 16乙炔 C2H2 26乙烯 C2H4 28甲醇 CH3OH 32乙醇(酒精) C2H5OH 46乙酸(醋酸) CH3COOH 60明矾 KAl(SO4)2·12H2O 474绿矾 FeSO4·7H2O 278蓝矾(硫酸铜晶体)CuSO4·5H2O 250石膏 CaSO4·2H2O 172熟石膏 CaSO4·H2O 154碳酸钠晶体 Na2CO3·10H2O 286尿素 CO(NH2)2 60蔗糖 C12H22O11 342 葡萄糖 C6H12O6 180Welcome !!! 欢迎您的下载,资料仅供参考!。
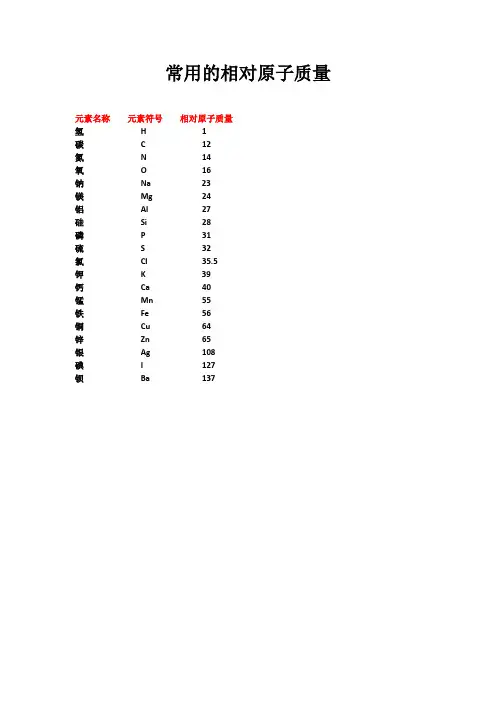
元素名称元素符号相对原子质量氢H 1碳 C 12氮N 14氧O 16钠Na 23镁Mg 24铝Al 27硅Si 28磷P 31硫S 32氯Cl 35.5钾K 39钙Ca 40锰Mn 55铁Fe 56铜Cu 64锌Zn 65银Ag 108碘I 127钡Ba 137物质名称化学式相对分子质量氢气H2 2氨气NH3 17氮气N228氧气O232水H2O 18过氧化氢H2O234一氧化碳CO 28二氧化碳CO244一氧化硫SO 48二氧化硫SO264三氧化硫SO380二氧化锰MnO287二氧化硅SiO260一氧化氮NO 30二氧化氮NO246五氧化二磷P2O5142氧化铁Fe2O3160氧化亚铁FeO 72四氧化三铁Fe3O4232氧化铜CuO 80氧化亚铜Cu2O 144氧化钠Na2O 62氧化镁MgO 40 氧化钙CaO 56氧化铝Al2O3 102氧化锌ZnO 81氧化汞HgO 217氧化银Ag2O 232 氧化铅PbO 223氯气Cl271氯化氢HCl 36.5氯化钾KCl 74.5氯化钠NaCl 58.5氯化镁MgCl295氯化钙CaCl2111氯化铜CuCl2135氯化锌ZnCl2136氯化钡BaCl2208氯化铝AlCl3133.5 氯化铁FeCl3162.5氯化银AgCl 143.5 氯酸钾KClO3122.5 氯化铵NH4Cl 53.5氯化亚铁FeCl2 127物质名称化学式相对分子质量硫酸H2SO498硫酸锌ZnSO4161 硫酸铵(NH4)2SO4132硫酸铜CuSO4160硫酸钡BaSO4233硫酸钙CaSO4136硫酸钾K2SO4174硫酸钠Na2SO4142硫酸镁MgSO4120硫酸铁Fe2(SO4)3400硫酸亚铁FeSO4152硫酸铝Al2(SO4)3342硫酸氢钠NaHSO4120硫酸氢钾KHSO4136亚硫酸H2SO382亚硫酸钠Na2SO3126硝酸HNO363亚硝酸HNO247硝酸钠NaNO385硝酸钾KNO3101硝酸银AgNO3170硝酸镁Mg(NO3)2148硝酸铜Cu(NO3)2188硝酸铵NH4NO380硝酸钙Ca(NO3)2164物质名称化学式相对分子质量碳酸H2CO362碳酸钠Na2CO3106碳酸钙CaCO3100碳酸镁MgCO384碳酸钾K2CO3 138碳酸氢铵NH4HCO379碱式碳酸铜Cu2(OH)2CO3222物质名称化学式相对分子质量氢氧化钠NaOH 40氢氧化钙Ca(OH)274氢氧化钡Ba(OH)2171氢氧化镁Mg(OH)2 58氢氧化铜Cu(OH)2 98氢氧化钾KOH 56氢氧化铝Al(OH)378氢氧化铁Fe(OH)3107氢氧化亚铁Fe(OH)290物质名称化学式相对分子质量氨水NH3·H2O 35高锰酸钾KMnO4158锰酸钾K2MnO4 197磷酸H3PO498磷酸钠Na3PO4164 甲烷CH416乙炔C2H226乙烯C2H428甲醇CH3OH 32乙醇(酒精)C2H5OH 46乙酸(醋酸)CH3COOH 60明矾KAl(SO4)2·12H2O 474绿矾FeSO4·7H2O 278蓝矾(硫酸铜晶体)CuSO4·5H2O 250石膏CaSO4·2H2O 172熟石膏CaSO4·H2O 154碳酸钠晶体Na2CO3·10H2O 286尿素CO(NH2)260蔗糖C12H22O11342葡萄糖C6H12O6180。

相对原子质量相对分子质量一、中考复习要求1、记住相对原子质量和相对分子质量的定义。
2、熟练掌握有关化学式的计算(相对分子质量的计算、计算纯净物中各元素的质量比、纯净物中某元素或原子团的质量分数)。
二、基础知识回顾1、相对原子质量:以一个碳-12(质子数和中子数均为6的碳原子)原子质量的作为标准,某原子的质量跟它相所得的数值,即是该种原子的相对原子质量,计算某原子的相对原子质量的公式,相对原子质量是一个比值,它的国际单位制单位为符号为(书写时一般省略不写)。
2、相对分子质量:表示物质的化学式里所有原子的总和。
相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得到的相对质量,它也是一个比值,国际单位制单位为“-”符号为“1”(书写时一般省略不写)。
三、重点疑点讨论1、怎样理解相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得到的相对质量?你能通过相对原子质量与相对分子质量的关系得出上述结论吗?2、硫酸(H2SO4)的相对分子质量是98克,对吗?3、为什么质子数和中子数的和近似等于相对原子质量?4、如何计算胆矾(CuSO4·5H2O) 相对分子质量?5、能否根据物质中某元素的质量分数来判断该物质是否为纯净物?如碳元素质量分数为12%的石灰石是纯净物吗?判断某物质是否纯净物的标准是什么?四、解题方法指导例题1、已知一个碳-12原子的质量为1.993×10-26千克,镁的相对原子质量为24,求一个镁原子的质量。
例题2、铁的某种氧化物中铁元素与氧元素的质量比为21:8,则该氧化物的相对分子质量为( )A、 72B、 160C、 232D、 256思考:先由铁元素与氧元素的质量比推断铁的某种氧化物的化学式,然后计算相对分子质量。
本题求化学式的方法有两种,请同学们自己推出。
例题3 一种含氧化铁的铁矿石,经测定含铁49%。
求矿石中氧化铁的质量分数。
思考:求矿石中氧化铁的质量分数,就是求不纯的含Fe2O3的矿石中纯的Fe2O3质量分数。

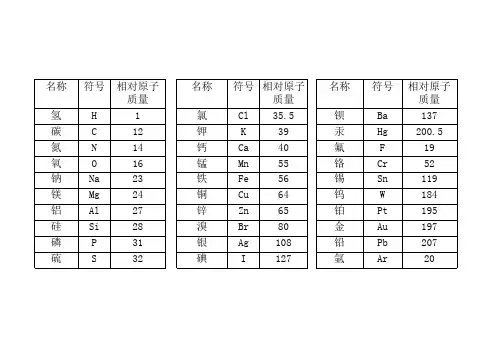
化学中常用相对原子质量和相对分子质量常用的相对原子质量元素名称元素符号相对原子质量氢 H 1碳 C 12氮 N 14氧 O 16钠 Na 23 镁 Mg 24铝 Al 27硅 Si 28磷 P 31硫 S 32 氯 Cl 35.5 钾 K 39钙 Ca 40锰 Mn 55铁 Fe 56铜 Cu 64锌 Zn 65银 Ag 108碘 I 127钡 Ba 137常用的相对分子质量物质名称 化学式 相对分子质量 氢 气 H 2 2 氨 气 NH 3 17 氮 气 N 2 28 氧 气 O 2 32 水 H 2O 18 过氧化氢 H 2O 2 34 一氧化碳 CO 28 二氧化碳 CO 2 44 一氧化硫 SO 48 二氧化硫 SO 2 64 三氧化硫 SO 3 80 二氧化锰 MnO 2 87 二氧化硅 SiO 2 60 一氧化氮 NO 30 二氧化氮 NO 2 46五氧化二磷 P 2O 5 142 氧化铁 Fe 2O 3 160 氧化亚铁 FeO 72 四氧化三铁 Fe 3O 4 232 氧化铜 CuO 80 氧化亚铜 Cu 2O 144 氧化钠 Na 2O 62 氧化镁 MgO 40 氧化钙 CaO 56 氧化铝 Al 2O 3 102氧化锌 ZnO 81 氧化汞 HgO 217 氧化银 Ag 2O 232 氧化铅 PbO 223物质名称 化学式 相对分子质量 氯 气 Cl 2 71 氯化氢 HCl 36.5 氯化钾 KCl 74.5 氯化钠 NaCl 58.5 氯化镁 MgCl 2 95 氯化钙 CaCl 2 111 氯化铜 CuCl 2 135 氯化锌 ZnCl 2 136 氯化钡 BaCl 2 208氯化铝 AlCl 3 133.5 氯化铁 FeCl 3 162.5 氯化银 AgCl 143.5 氯酸钾 KClO 3 122.5 氯化铵 NH 4Cl 53.5 氯化亚铁 FeCl 2 127物质名称 化学式 相对分子质量 硫 酸 H 2SO 4 98硫酸锌 ZnSO 4 161 硫酸铵 (NH 4)2SO 4 132 硫酸铜 CuSO 4 160 硫酸钡 BaSO 4 233 硫酸钙 CaSO 4 136 硫酸钾 K 2SO 4 174 硫酸钠 Na 2SO 4 142 硫酸镁 MgSO 4 120 硫酸铁 Fe 2(SO 4)3 400 硫酸亚铁 FeSO 4 152硫酸铝 Al 2(SO 4)3 342 硫酸氢钠 NaHSO 4 120 硫酸氢钾 KHSO 4 136 亚硫酸 H 2SO 3 82 亚硫酸钠 Na 2SO 3 126 物质名称 化学式 相对分子质量 硝 酸 HNO 3 63 亚硝酸 HNO 2 47 硝酸钠 NaNO 3 85 硝酸钾 KNO 3 101 硝酸银 AgNO 3 170 硝酸镁 Mg(NO 3)2 148 硝酸铜 Cu(NO 3)2 188 硝酸铵 NH 4NO 3 80 硝酸钙 Ca(NO 3)2 164物质名称 化学式 相对分子质量 碳 酸 H 2CO 3 62 碳酸钠 Na 2CO 3 106 碳酸钙 CaCO 3 100 碳酸镁 MgCO 3 84 碳酸钾 K 2CO 3 138 碳酸氢铵 NH 4HCO 3 79 碱式碳酸铜 Cu 2(OH)2CO 3 222物质名称 化学式 相对分子质量 氢氧化钠 NaOH 40 氢氧化钙 Ca(OH)2 74 氢氧化钡 Ba(OH)2 171 氢氧化镁 Mg(OH)2 58 氢氧化铜 Cu(OH)2 98氢氧化钾 KOH 56 氢氧化铝 Al(OH)3 78 氢氧化铁 Fe(OH)3 107 氢氧化亚铁 Fe(OH)2 90物质名称 化学式 相对分子质量 氨 水 NH 3·H 2O 35 高锰酸钾 KMnO 4 158 锰酸钾 K 2MnO 4 197 磷 酸 H 3PO 4 98 磷酸钠 Na 3PO 4 164 甲 烷 CH 4 16 乙 炔 C 2H 2 26 乙 烯 C 2H 4 28 甲 醇 CH 3OH 32 乙醇(酒精) C 2H 5OH 46 乙酸(醋酸) CH 3COOH 60 明 矾 KAl(SO 4)2·12H 2O 474 绿 矾 FeSO 4·7H 2O 278 蓝矾(硫酸铜晶体)CuSO 4·5H 2O 250 石 膏 CaSO 4·2H 2O 172 熟石膏 CaSO 4·H 2O 154碳酸钠晶体 Na 2CO 3·10H 2O 286 尿 素 CO(NH 2)2 60 蔗 糖 C 12H 22O 11 342 葡萄糖 C 6H 12O 6 180。

相对原子质量和相对分子质量及摩尔质量的比较一、相对原子质量1、相对原子质量的概念一种核素的相对原子质量是以质量的作为标准,其他元素的原子质量跟它相比较所得的数值。
相对原子质量的单位为“1”。
2、几个有关相对原子质量的概念的区别(1)质量数在数值上等于原子中质子数和中子数之和。
但质量数不只是微粒个数,它是一个属于质量范畴的数值。
质量数是对某种同位素而言的,如的质量数是35。
对于一种元素来说,没有一种质量数跟它相对应,因此讲氯元素的质量数是35是错误的。
(2)同位素的相对原子质量是把该同位素原子质量与作为相对原子质量标准的原子质量的的比值,通常它不是整数。
一种元素通常有几种同位素,这几种同位素原子因其核内中子数目不同而有着不同的质量,与的的比值也不相同。
如氯元素的两种同位素和,它们的相对原子质量分别是34.969和36.966。
(3)元素的相对原子质量是按该元素的各种天然同位素的相对原子质量和所占的物质的量分数(或称丰度)算出来的平均值(注意此处用的是原子的物质的量分数而不是质量分数),即元素的相对原子质量[是各同位素的相对原子质量,a%,b%,c%…是各同位素原子的物质的量分数]。
《国际原子量表》中列出的相对原子质量,就是各元素的平均相对原子质量。
如天然氢是由两种同位素和组成,它们的同位素相对质量分别是1.00782和2.0140,同位素丰度分别是99.985%和0.015%,所以氢元素的相对原子质量。
(4)元素的近似相对原子质量是按该元素的各种天然同位素的质量数和所占的原子的物质的量分数(或称丰度)计算出来的平均值。
计算公式与元素的相对原子质量相同,只是式中M(A),M(B),M(C)…是表示各同位素的质量数。
例1:自然界中硼有两种同位素:和,又测得硼的相对原子质量为10.8,试求和的原子个数比。
解析:设自然界中硼的原子总数为100,其中含为x,含为。
则,解得:。
故含为80,则。
二、相对分子质量1、相对分子质量的概念分子是由原子构成的,把构成分子的每一种原子的相对原子质量(还要乘上分子中原子的个数)相加,得出的数值即为相对分子质量。

常用的相对原子质量元素名称元素符号相对原子质量氢H 1碳 C 12氮N 14氧O 16钠Na 23镁Mg 24铝Al 27硅Si 28磷P 31硫S 32氯Cl 35.5钾K 39钙Ca 40锰Mn 55铁Fe 56铜Cu 64锌Zn 65银Ag 108碘I 127钡Ba 137常用的相对分子质量物质名称化学式相对分子质量氢气H22氨气NH3 17氮气N228氧气O232水H2O 18过氧化氢H2O234一氧化碳CO 28二氧化碳CO244一氧化硫SO 48二氧化硫SO264三氧化硫SO380二氧化锰MnO287二氧化硅SiO260一氧化氮NO 30二氧化氮NO246五氧化二磷P2O5142氧化铁Fe2O3160氧化亚铁FeO 72四氧化三铁Fe3O4232氧化铜CuO 80氧化亚铜Cu2O 144氧化钠Na2O 62氧化镁MgO 40氧化钙CaO 56氧化铝Al2O3 102氧化锌ZnO 81氧化汞HgO 217氧化银Ag2O 232氧化铅PbO 223物质名称化学式相对分子质量氯气Cl271氯化氢HCl 36.5氯化钾KCl 74.5氯化钠NaCl 58.5氯化镁MgCl295氯化钙CaCl2111氯化铜CuCl2135氯化锌ZnCl2136氯化钡BaCl2208氯化铝AlCl3133.5氯化铁FeCl3162.5氯化银AgCl 143.5氯酸钾KClO3122.5氯化铵NH4Cl 53.5氯化亚铁FeCl2 127物质名称化学式相对分子质量硫酸H2SO498硫酸锌ZnSO4161硫酸铵(NH4)2SO4132硫酸铜CuSO4160硫酸钡BaSO4233硫酸钙CaSO4136硫酸钾K2SO4174硫酸钠Na2SO4142硫酸镁MgSO4120硫酸铁Fe2(SO4)3400硫酸亚铁FeSO4152硫酸铝Al2(SO4)3342硫酸氢钠NaHSO4120硫酸氢钾KHSO4136亚硫酸H2SO382亚硫酸钠Na2SO3126物质名称化学式相对分子质量硝酸HNO363亚硝酸HNO247硝酸钠NaNO385硝酸钾KNO3101硝酸银AgNO3170硝酸镁Mg(NO3)2148硝酸铜Cu(NO3)2188硝酸铵NH4NO380硝酸钙Ca(NO3)2164物质名称化学式相对分子质量碳酸H2CO362碳酸钠Na2CO3106碳酸钙CaCO3100碳酸镁MgCO384碳酸钾K2CO3 138碳酸氢铵NH4HCO379碱式碳酸铜Cu2(OH)2CO3222物质名称化学式相对分子质量氢氧化钠NaOH 40氢氧化钙Ca(OH)274氢氧化钡Ba(OH)2171氢氧化镁Mg(OH)2 58氢氧化铜Cu(OH)2 98氢氧化钾KOH 56氢氧化铝Al(OH)378氢氧化铁Fe(OH)3107氢氧化亚铁Fe(OH)290物质名称化学式相对分子质量氨水NH3·H2O 35高锰酸钾KMnO4158锰酸钾K2MnO4 197磷酸H3PO498磷酸钠Na3PO4164甲烷CH416乙炔C2H226乙烯C2H428甲醇CH3OH 32乙醇(酒精)C2H5OH 46乙酸(醋酸)CH3COOH 60明矾KAl(SO4)2·12H2O 474绿矾FeSO4·7H2O 278蓝矾(硫酸铜晶体)CuSO4·5H2O 250石膏CaSO4·2H2O 172熟石膏CaSO4·H2O 154碳酸钠晶体Na2CO3·10H2O 286尿素CO(NH2)260蔗糖C12H22O11342葡萄糖C6H12O6180。

化学中常用相对原子质量和相对分子质量work Information Technology Company.2020YEAR元素名称元素符号相对原子质量氢 H 1碳 C 12氮 N 14氧 O 16钠 Na 23镁 Mg 24铝 Al 27硅 Si 28磷 P 31硫 S 32氯 Cl 35.5钾 K 39钙 Ca 40锰 Mn 55铁 Fe 56铜 Cu 64锌 Zn 65银 Ag 108碘 I 127钡 Ba 137物质名称化学式相对分子质量氢气 H2 2氨气 NH3 17氮气 N2 28氧气 O2 32水 H2O 18过氧化氢 H2O2 34一氧化碳 CO 28二氧化碳 CO2 44一氧化硫 SO 48二氧化硫 SO2 64三氧化硫 SO3 80二氧化锰 MnO2 87二氧化硅 SiO2 60一氧化氮 NO 30二氧化氮 NO2 46五氧化二磷P2O5 142氧化铁 Fe2O3 160氧化亚铁 FeO 72四氧化三铁Fe3O4 232氧化铜CuO 80氧化亚铜 Cu2O 144氧化钠 Na2O 62氧化镁 MgO 40氧化钙 CaO 56氧化铝 Al2O3 102氧化锌 ZnO 81氧化汞 HgO 217氧化银 Ag2O 232氧化铅 PbO 223氯气 Cl2 71氯化氢 HCl 36.5氯化钾 KCl 74.5氯化钠 NaCl 58.5氯化镁 MgCl2 95氯化钙 CaCl2 111氯化铜 CuCl2 135氯化锌 ZnCl2 136氯化钡BaCl2 208氯化铝AlCl3 133.5氯化铁 FeCl3 162.5氯化银 AgCl 143.5氯酸钾KClO3 122.5氯化铵NH4Cl 53.5氯化亚铁 FeCl2 127物质名称化学式相对分子质量硫酸 H2SO4 98硫酸锌 ZnSO4 161硫酸铵 (NH4)2SO4 132硫酸铜 CuSO4160硫酸钡 BaSO4 233硫酸钙 CaSO4 136硫酸钾K2SO4 174硫酸钠Na2SO4142硫酸镁 MgSO4 120硫酸铁Fe2(SO4)3 400硫酸亚铁 FeSO4 152硫酸铝 Al2(SO4)3 342硫酸氢钠 NaHSO4 120硫酸氢钾 KHSO4 136亚硫酸 H2SO3 82亚硫酸钠 Na2SO3 126硝酸 HNO3 63亚硝酸 HNO2 47硝酸钠NaNO3 85硝酸钾 KNO3 101硝酸银 AgNO3 170硝酸镁 Mg(NO3)2 148硝酸铜 Cu(NO3)2 188硝酸铵 NH4NO380硝酸钙 Ca(NO3)2 164物质名称化学式相对分子质量碳酸 H2CO3 62碳酸钠 Na2CO3 106碳酸钙 CaCO3 100碳酸镁 MgCO3 84碳酸钾 K2CO3 138碳酸氢铵 NH4HCO3 79碱式碳酸铜 Cu2(OH)2CO3 222物质名称化学式相对分子质量氢氧化钠 NaOH 40氢氧化钙 Ca(OH)2 74氢氧化钡 Ba(OH)2 171氢氧化镁 Mg(OH)2 58氢氧化铜 Cu(OH)2 98氢氧化钾 KOH 56氢氧化铝 Al(OH)3 78氢氧化铁 Fe(OH)3 107氢氧化亚铁 Fe(OH)2 90氨水 NH3·H2O 35高锰酸钾 KMnO4 158锰酸钾 K2MnO4 197磷酸 H3PO4 98磷酸钠 Na3PO4 164甲烷 CH4 16乙炔 C2H2 26乙烯 C2H4 28甲醇 CH3OH 32乙醇(酒精) C2H5OH 46乙酸(醋酸) CH3COOH 60明矾 KAl(SO4)2·12H2O 474绿矾 FeSO4·7H2O 278蓝矾(硫酸铜晶体)CuSO4·5H2O 250石膏 CaSO4·2H2O 172熟石膏 CaSO4·H2O 154碳酸钠晶体 Na2CO3·10H2O 286尿素 CO(NH2)2 60蔗糖 C12H22O11 342葡萄糖 C6H12O6 180。
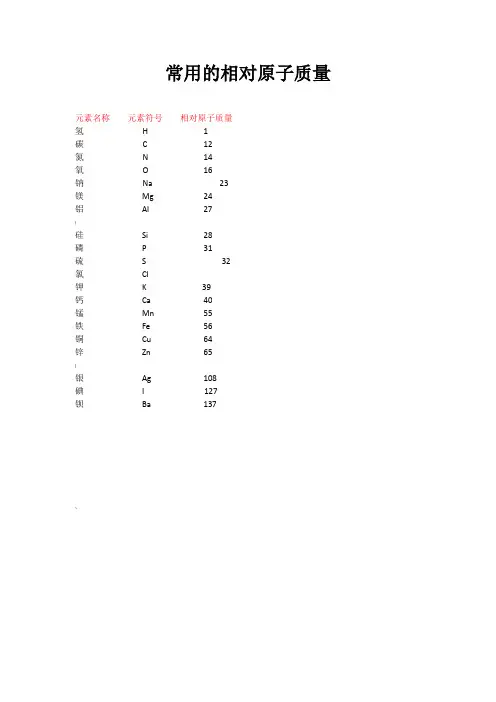
常用的相对原子质量元素名称元素符号相对原子质量氢H 1碳 C 12氮N 14氧O 16钠Na 23镁Mg 24铝Al 27{硅Si 28磷P 31硫S 32氯Cl钾K 39钙Ca 40锰Mn 55铁Fe 56铜Cu 64锌Zn 65}银Ag 108碘I 127钡Ba 137~.常用的相对分子质量物质名称化学式相对分子质量氢气H2 2氨气NH3 17氮气N228氧气O232水H2O 18"过氧化氢H2O234一氧化碳CO 28二氧化碳CO244一氧化硫SO 48二氧化硫SO264三氧化硫SO380二氧化锰MnO287二氧化硅SiO260一氧化氮NO 30二氧化氮NO246,五氧化二磷P2O5142氧化铁Fe2O3160氧化亚铁FeO 72四氧化三铁Fe3O4232氧化铜CuO 80氧化亚铜Cu2O 144氧化钠Na2O 62氧化镁MgO 40氧化钙CaO 56氧化铝Al2O3 102;氧化锌ZnO 81氧化汞HgO 217 氧化银Ag2O 232氧化铅PbO 223物质名称化学式相对分子质量氯气Cl271氯化氢HCl*氯化钾KCl氯化钠NaCl氯化镁MgCl295氯化钙CaCl2111氯化铜CuCl2135氯化锌ZnCl2136氯化钡BaCl2208氯化铝AlCl3氯化铁FeCl3氯化银AgCl%氯酸钾KClO3氯化铵NH4Cl氯化亚铁FeCl2 127物质名称化学式相对分子质量硫酸H2SO498硫酸锌ZnSO4161硫酸铵(NH4)2SO4132硫酸铜CuSO4160】硫酸钡BaSO4233硫酸钙CaSO4136硫酸钾K2SO4174硫酸钠Na2SO4142硫酸镁MgSO4120硫酸铁Fe2(SO4)3400硫酸亚铁FeSO4152硫酸铝Al2(SO4)3342硫酸氢钠NaHSO4120硫酸氢钾KHSO4136`亚硫酸H2SO382亚硫酸钠Na2SO3126物质名称化学式相对分子质量硝酸HNO363亚硝酸HNO247硝酸钠NaNO385硝酸钾KNO3101硝酸银AgNO3170硝酸镁Mg(NO3)2148硝酸铜Cu(NO3)2188.硝酸铵NH4NO380硝酸钙Ca(NO3)2164物质名称化学式相对分子质量碳酸H2CO362碳酸钠Na2CO3106碳酸钙CaCO3100碳酸镁MgCO384碳酸钾K2CO3 138—碳酸氢铵NH4HCO379碱式碳酸铜Cu2(OH)2CO3222物质名称化学式相对分子质量氢氧化钠NaOH 40氢氧化钙Ca(OH)274氢氧化钡Ba(OH)2171氢氧化镁Mg(OH)2 58氢氧化铜Cu(OH)2 98>氢氧化钾KOH 56氢氧化铝Al(OH)378氢氧化铁Fe(OH)3107 氢氧化亚铁Fe(OH)290物质名称化学式相对分子质量氨水NH3·H2O 35高锰酸钾KMnO4158锰酸钾K2MnO4 197磷酸H3PO498磷酸钠Na3PO4164 甲烷CH416乙炔C2H226乙烯C2H428甲醇CH3OH 32乙醇(酒精)C2H5OH 46乙酸(醋酸)CH3COOH 60明矾KAl(SO4)2·12H2O 474绿矾FeSO4·7H2O 278蓝矾(硫酸铜晶体)CuSO4·5H2O 250石膏CaSO4·2H2O 172熟石膏CaSO4·H2O 154 碳酸钠晶体Na2CO3·10H2O 286尿素CO(NH2)260蔗糖C12H22O11342 葡萄糖C6H12O6180。
专题4 相对原子质量相对分子质量一、中考复习要求12、熟练掌握有关化学式的计算(相对分子质量的计算、计算纯净物中各元素的质量二、基础知识回顾1、相对原子质量:以一个碳-12(质子数和中子数均为6的碳原子)原子质量的作为标准,某原子的质量跟它相所得的数值,即是该种原子的相对原子质量,计算某原子的相对原子质量的公式,相对原子质量是一个比值,它的国际单位制单位为符号为(书写时一般省略不写)。
2、相对分子质量:表示物质的化学式里所有原子的总和。
相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得到的相对质量,它也是一个比值,国际单位制单位为“-”符号为“1”三、重点疑点讨论1、怎样理解相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而2、硫酸(H2SO4)的相对分子质量是98克,对吗?3、为什么质子数和中子数的和近似等于相对原子质量?4、如何计算胆矾(CuSO4·5H2O) 相对分子质量?5、能否根据物质中某元素的质量分数来判断该物质是否为纯净物?如碳元素质量分数为12%的石灰石是纯净物吗?判断某物质是否纯净物的标准是什么?四、解题方法指导例题1、已知一个碳-12原子的质量为1.993×10-26千克,镁的相对原子质量为24,例题2、铁的某种氧化物中铁元素与氧元素的质量比为21:8,则该氧化物的相对分子质量为( )A、 72B、 160C、 232D、 256思考:先由铁元素与氧元素的质量比推断铁的某种氧化物的化学式,然后计算相对分子质量。
本题求化学式的方法有两种,请同学们自己推出。
例题3 一种含氧化铁的铁矿石,经测定含铁49%。
求矿石中氧化铁的质量分数。
思考:求矿石中氧化铁的质量分数,就是求不纯的含Fe2O3的矿石中纯的Fe2O3质量分数。
矿石中含铁元素的质量等于矿石中Fe2O3含有的铁元素质量。
矿石的质量×矿石中含铁的质量分数 = Fe2O3的质量× Fe2O3中含铁的质量分数五、知识能力训练巩固知识1、已知一个碳-12原子的质量为 1.993×10-26Kg,一个铁原子的质量为9.288×10-26Kg,则铁的相对原子质量为;氧原子的相对原子质量是16,则1个氧原子的质量是 Kg;银的相对原子质量是碳的相对原子质量的9倍,则银的相对原子质量是。
相对原子质量和相对分子质量的区别
相对原子质量和相对分子质量是化学中两个重要的概念,它们之间存在一些关键的区别。
相对原子质量是指一个元素在同位素的质量基础上进行相对比较得出的质量值。
每个元素都由不同的同位素组成,而同位素的质量不同。
因此,相对原子质量是以12C同位素的质量为标准,与其它同位素进行比较得出的。
相对原子质量的单位是原子量单位(amu)。
相对分子质量是指一个物质的质量与1/12C同位素的质量的比值。
相对分子质量可以用来表示一个分子中所有原子的总和质量。
它是根据分子式中包含的各种原子的相对原子质量进行计算的。
相对分子质量的单位也是原子量单位(amu)。
尽管相对原子质量和相对分子质量都使用相同的单位进行表示,但它们之间存在一些关键的区别。
首先,相对原子质量只针对一个单独的原子,而相对分子质量涉及到多个原子的总和。
其次,相对原子质量是以同位素的质量为基准进行比较,而相对分子质量是以1/12C同位素为基准进行比较。
此外,相对分子质量还可以用于计算化学反应中物质的量。
在化学计算中,相对原子质量和相对分子质量都是非常重要的概念。
它们可以帮助我们确定物质的分子量或摩尔质量,从而进行化学计量学的计算和分析。