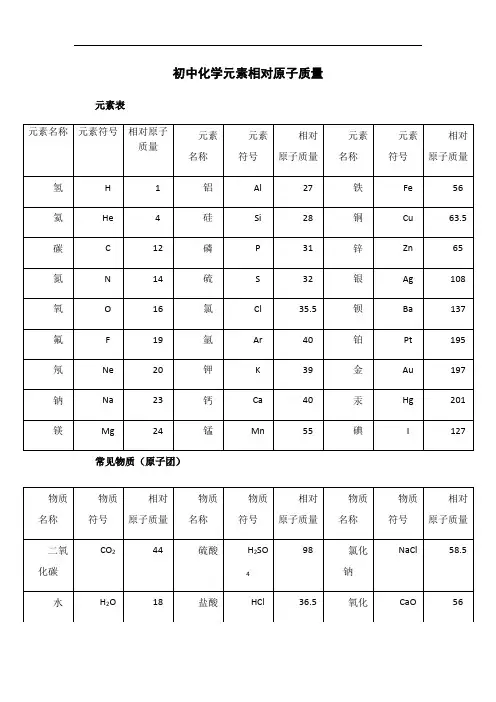
初中常用相对原子质量表
- 格式:doc
- 大小:46.00 KB
- 文档页数:2


初中相对原子质量表“原子质量”是一个重要的概念,它提供了一种更准确的方式来表示原子的质量。
原子的质量是指原子的原子核中的质子(正电子)和中子(中子)之和,它表示为“千克/摩尔”(kg/mol)或“克/质量数”(g/mol)。
原子质量可以用来衡量元素的含量。
为了更好地了解世界上的物质,就需要一个表来具体表示每种元素的原子质量。
②中相对原子质量表:初中相对原子质量表(Atomic Mass Relative to Carbon-12 Table)是一种表格,其中包含了每个元素的相对原子质量。
该表通常以碳-12(C-12)为基准,将每个原子的质量都进行了比较,并以该元素的原子质量来表示质量。
这样一来,就可以更容易地从表中找到元素的原子质量。
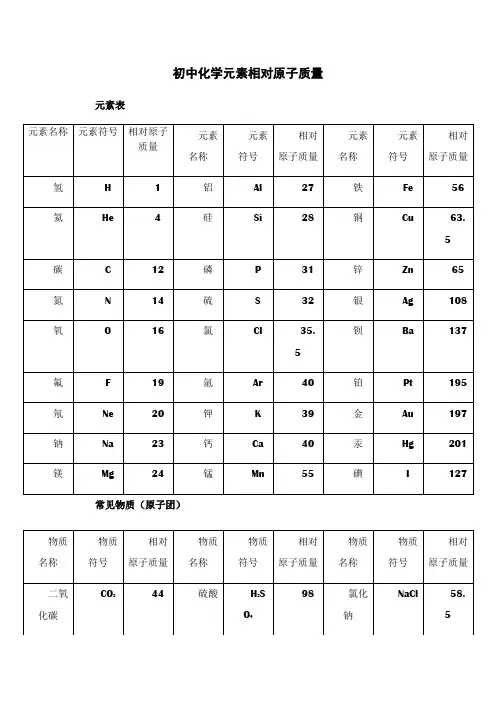
以下是常见元素的初中相对原子质量表:H: 1.008He: 4.003Li: 6.94Be: 9.01B: 10.81C: 12.01N: 14.01O: 16.00F: 19.00Ne: 20.18Mg: 24.31 Al: 26.98 Si: 28.09 P: 30.97 S: 32.07 Cl: 35.45 Ar: 39.95 K: 39.10 Ca: 40.08 Sc: 44.96 Ti: 47.87 V: 50.94 Cr: 52.00 Mn: 54.94 Fe: 55.85 Co: 58.93 Ni: 58.69 Cu: 63.55 Zn: 65.38 Ga: 69.72 Ge: 72.61Se: 78.96 Br: 79.90 Kr: 83.80 Rb: 85.47 Sr: 87.62 Y: 88.91 Zr: 91.22 Nb: 92.91 Mo: 95.94 Tc: 98.00 Ru: 101.07 Rh: 102.91 Pd: 106.42 Ag: 107.87 Cd: 112.41 In: 114.82 Sn: 118.71 Sb: 121.76 Te: 127.60 I: 126.90 Xe: 131.29Ba: 137.33 La: 138.91 Ce: 140.12 Pr: 140.91 Nd: 144.24 Pm: 145.00 Sm: 150.36 Eu: 152.00 Gd: 157.25 Tb: 158.93 Dy: 162.50 Ho: 164.93 Er: 167.26 Tm: 168.93 Yb: 173.04 Lu: 174.97 Hf: 178.49 Ta:180.95 W: 183.84 Re: 186.21 Os: 190.23Pt: 195.08 Au: 196.97 Hg: 200.59 Tl: 204.38 Pb: 207.2 Bi: 208.98 Po: 209.00 At: 210.00 Rn: 220.00 Fr: 223.00 Ra: 226.00 Ac: 227.00 Th: 232.04 Pa: 231.04 U: 238.03 Np: 237.00 Pu: 244.00 Am: 243.00 Cm: 247.00 Bk: 247.00 Cf: 251.00Fm: 257.00Md: 258.00No: 259.00③途:初中相对原子质量表的主要用途是可以精确地计算元素的质量。

初中元素相对原子质量表在初中化学的学习中,元素相对原子质量是一个非常重要的概念。
它不仅是进行化学计算的基础,还对于理解化学反应、物质组成等方面有着关键的作用。
下面,我们就来详细了解一下初中常见元素的相对原子质量。
相对原子质量是指以一个碳 12 原子质量的 1/12 作为标准,其他原子的质量跟它相比较所得到的比。
这个比值就是该原子的相对原子质量。
需要注意的是,相对原子质量是一个比值,没有单位。
氢(H)的相对原子质量约为 1。
氢是宇宙中最常见的元素之一,在许多化合物中都起着重要的作用,比如水(H₂O)。
氦(He)的相对原子质量约为 4。
氦是一种惰性气体,常用于气球填充和低温研究。
锂(Li)相对原子质量约为 7。
锂在电池技术中有着广泛的应用。
铍(Be)相对原子质量约为 9。
硼(B)相对原子质量约为 11。
碳(C)的相对原子质量约为 12。
碳是构成有机物的基本元素,生命的基础物质如蛋白质、核酸等都含有碳。
氮(N)相对原子质量约为 14。
氮气在空气中含量很高,是生命必需的元素之一。
氧(O)的相对原子质量约为 16。
氧气是维持生命活动所必需的气体。
氟(F)相对原子质量约为 19。
氟气是一种极具活性的气体,含氟的化合物在牙膏等产品中常见。
氖(Ne)相对原子质量约为 20。
氖气常用于霓虹灯,发出鲜艳的光芒。
钠(Na)相对原子质量约为23。
我们日常生活中的食盐(氯化钠,NaCl)就含有钠元素。
镁(Mg)相对原子质量约为24。
镁在航空航天领域有一定的应用。
铝(Al)相对原子质量约为 27。
铝制品在生活中随处可见,如易拉罐、门窗等。
硅(Si)相对原子质量约为 28。
硅是半导体材料的重要组成部分。
磷(P)相对原子质量约为 31。
磷在火柴头、化肥等中都有存在。
硫(S)相对原子质量约为 32。
硫磺常用于药物和橡胶制品。
氯(Cl)相对原子质量约为 355。
氯气是一种具有刺激性气味的气体,在自来水消毒等方面有应用。
氩(Ar)相对原子质量约为 40。
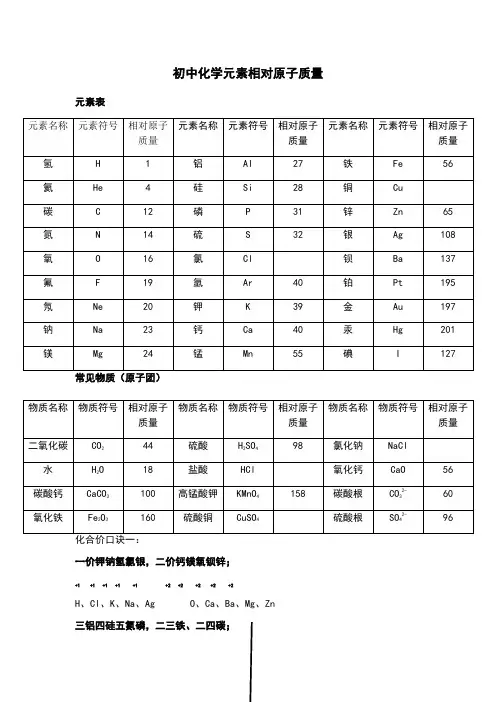
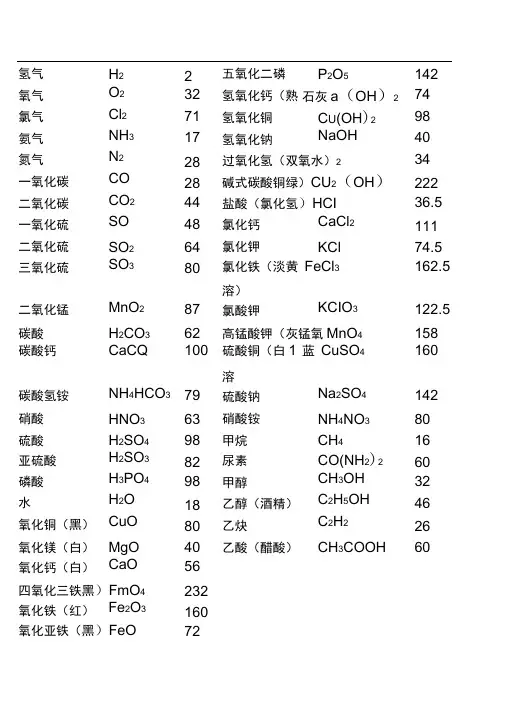
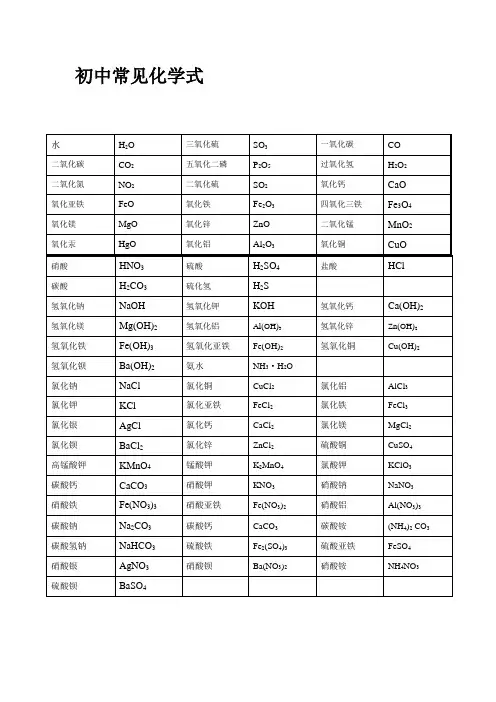
氢气H2 2 五氧化二磷P2O5 142 氧气O2 32 氢氧化钙(熟石灰a(OH)2 74 氯气Cl2 71 氢氧化铜C U(OH)2 98 氨气NH3 17 氢氧化钠NaOH 40 氮气N2 28 过氧化氢(双氧水)2 34一氧化碳CO 28 碱式碳酸铜绿)CU2(OH)CO 222二氧化碳CO2 44 盐酸(氯化氢)HCI 36.5 一氧化硫SO 48 氯化钙CaCl2 111 二氧化硫SO2 64 氯化钾KCl 74.5 三氧化硫SO3 80 氯化铁(淡黄FeCl3 162.5溶)二氧化锰MnO2 87 氯酸钾KCIO3 122.5 碳酸H2CO3 62 高锰酸钾(灰锰氧MnO4 158 碳酸钙CaCQ 100 硫酸铜(白1 蓝CuSO4 160溶碳酸氢铵NH4HCO3 79 硫酸钠Na2SO4 142 硝酸HNO3 63 硝酸铵NH4NO3 80硫酸H2SO4 98 甲烷CH4 16亚硫酸H2SO3 82 尿素CO(NH2)2 60磷酸H3PO4 98 甲醇CH3OH 32水H2O 18 乙醇(酒精)C2H5OH 46氧化铜(黑)CuO 80 乙炔C2H2 26氧化镁(白)MgO 40 乙酸(醋酸)CH3COOH 60氧化钙(白)CaO 56四氧化三铁黑)FmO4 232氧化铁(红)Fe2O3 160氧化亚铁(黑)FeO 72硫酸亚(淡绿)eSO 152硫酸锌(白无)ZnSO4 161初中化学常用计算公式一.常用计算公式:(1)相对原子质量=某元素一个原子的质量/ 一个碳原子质量的1/12(2)设某化合物化学式为AmBn①它的相对分子质量=A的相对原子质量Xm+ B的相对原子质量X②A元素与B元素的质量比=A的相对原子质量X m:B的相对原子质量X n③A元素的质量分数3 =A的相对原子质量X m /AmBn 的相对分子质量(3)混合物中含某物质的质量分数(纯度) =纯物质的质量/混合物的总质量x 100%(4)标准状况下气体密度(g/L)=气体质量(g)/气体体积(L)(5)纯度=纯物质的质量/混合物的总质量X100%纯物质的质量/(纯物质的质量+杂质的质量)X100%=1-杂质的质量分数(6)溶质的质量分数=溶质质量/溶液质量X100% = 溶质质量/(溶质质量+溶剂质量)X00%(7)溶液的稀释与浓缩M浓x a%浓=M稀X b%稀=(M浓+增加的溶剂质量)x b%稀(8)相对溶质不同质量分数的两种溶液混合M浓X a%浓+M稀x b%稀=(M浓+M稀)>C%(9)溶液中溶质的质量=溶液的质量X容液中溶质的质量分数 =溶液的体积X容液的密度素名称兀素符号相对原子质量核电荷数兀〕1 氢H 12 氦He 46 碳 C 127 氮N 148 氧O 169 氟 F 1910 氖Ne 2011 钠Na 2312 镁Mg 2413 铝Al 2714 硅Si 2815 磷P 3116 硫S 3217 氯Cl 35.518 氩Ar 4019 钾K 3920 钙Ca 4025 锰Mn 5526 铁Fe 5629 铜Cu 64.5 (可写64或65)30 锌Zn 6547 银Ag 10853 碘I 127 56 钡Ba 13778 铂Pt 19579 金Au 19780 汞Hg 201。

常见物质的相对原子质量分别是多少-CAL-FENGHAI.-(YICAI)-Company One1常见物质的相对原子质量分别是多少由于原子的实际质量很小,如果人们用它们的实际质量来计算的话那就非常的麻烦,例如一个氢原子的实际质量为1.674×10⁻²⁷千克,一个氧原子的质量为2.657×10⁻²⁶千克。
一个碳-12原子的质量为1.993×10⁻²⁶千克。
元素的相对原子质量是其各种同位素相对原子质量的加权平均值。
元素周期表中最下面的数字为相对原子质量。
今天小编就来介绍一下我们初中阶段常见物质的相对原子质量分别是多少。
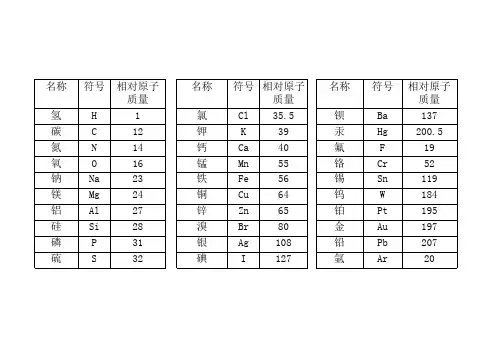
常见物质的相对原子质量:相对原子质量的易错点:1. 如果在元素符号前面添上系数,就只表示该元素原子个数,不能表示该元素。
如:H既表示氢元素,又表示一个氢原子;2H只能表示两个氢原子。
2. 相对原子质量只是一个比,不是原子的实际质量。
3. 在相对原子质量计算中,所选用的一种碳原子是碳12,是含6个质子和6个中子的碳原子,它的质量的1/12约等于1.66×10-27 kg。
常见物质的相对原子质量记忆方法:1.相对原子质量等于质子数与中子数的和。
H没有中子,那么原子质量就是1.。
随着原子序数的增加,质量也增加。
2.第二周期记住C、N、O即可。
C为12,N为14,O为16。
3.接下来是第三周期,相对更重要一些Na为23,Mg为24, Al为27,Si为28,P为31, S为32,Cl为35.5。
这几个是常用的,所以在用的时候多看看书,或者拿一张纸专门记这几个原子质量,需要用的时候看看,看的多了自然就记住了。
还有K为39,Ca为40,Fe为56, Cu为64.这几个也是同样的道理。
4.至于其他的一些,通常都是在某一种专有的化合物中出现,如KMnO4等,这些就只要记住化合物的质量就行,不必专门记Mn了。
5.最后,最关键的一点是,在中考或者高考时都会有原子质量,不必为最后的大考担心,应付好平时的小考即可。
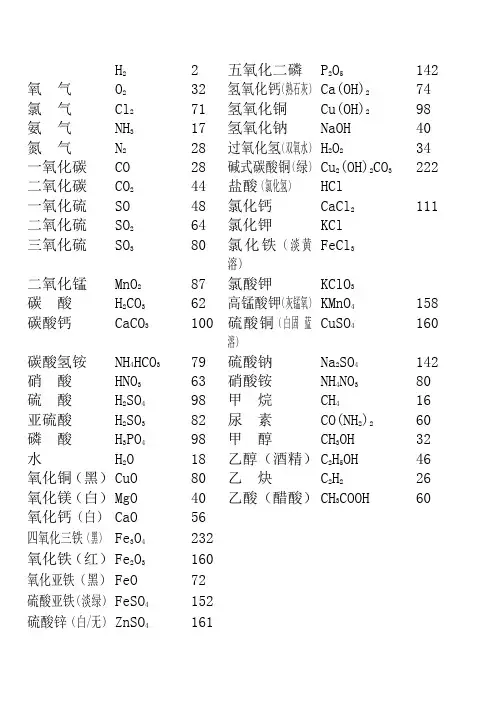
H22五氧化二磷P2O5142氧气O232氢氧化钙(熟石灰)Ca(OH)274氯气Cl271氢氧化铜Cu(OH)298氨气NH317氢氧化钠NaOH40氮气N228过氧化氢(双氧水)H2O234一氧化碳CO28碱式碳酸铜(绿)Cu2(OH)2CO3222二氧化碳CO244盐酸(氯化氢)HCl一氧化硫SO48氯化钙CaCl2111二氧化硫SO264氯化钾KClFeCl3三氧化硫SO380氯化铁(淡黄溶)二氧化锰MnO287氯酸钾KClO3碳酸H2CO362高锰酸钾(灰锰氧)KMnO4158CuSO4160碳酸钙CaCO3100硫酸铜(白固蓝溶)碳酸氢铵NH4HCO379硫酸钠Na2SO4142硝酸HNO363硝酸铵NH4NO380硫酸H2SO498甲烷CH416亚硫酸H2SO382尿素CO(NH2)260磷酸H3PO498甲醇CH3OH32水H2O18乙醇(酒精)C2H5OH46氧化铜(黑)CuO80乙炔C2H226氧化镁(白)MgO40乙酸(醋酸)CH3COOH60氧化钙(白)CaO56四氧化三铁(黑)Fe3O4232氧化铁(红)Fe2O3160氧化亚铁(黑)FeO72硫酸亚铁(淡绿)FeSO4152硫酸锌(白/无)ZnSO4161初中化学常用计算公式一. 常用计算公式:(1)相对原子质量= 某元素一个原子的质量 / 一个碳原子质量的1/12(2)设某化合物化学式为AmBn①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n②A元素与B元素的质量比=A的相对原子质量×m:B 的相对原子质量×n③A元素的质量分数ω=A的相对原子质量×m /AmBn 的相对分子质量(3)混合物中含某物质的质量分数(纯度)=纯物质的质量/混合物的总质量× 100%(4)标准状况下气体密度(g/L)=气体质量(g)/气体体积(L)(5)纯度=纯物质的质量/混合物的总质量× 100% =纯物质的质量/(纯物质的质量+杂质的质量) × 100%=1- 杂质的质量分数(6)溶质的质量分数=溶质质量/溶液质量× 100% =溶质质量/(溶质质量+溶剂质量) × 100%(7)溶液的稀释与浓缩M浓× a%浓=M稀× b%稀=(M浓+增加的溶剂质量) × b%稀(8)相对溶质不同质量分数的两种溶液混合M浓× a%浓+M稀× b%稀=(M浓+M稀) × c%(9)溶液中溶质的质量=溶液的质量×溶液中溶质的质量分数=溶液的体积×溶液的密度核电荷数元素名称元素符号相对原子质量1 氢 H 12 氦 He 46 碳 C 127 氮 N 148 氧 O 169 氟 F 1910 氖 Ne 2011 钠 Na 2312 镁 Mg 2413 铝 Al 2714 硅 Si 2815 磷 P 3116 硫 S 3217 氯 Cl18 氩 Ar 4019 钾 K 3920 钙 Ca 4025 锰 Mn 5526 铁 Fe 5629 铜 Cu (可写64或65)30 锌 Zn 6547 银 Ag 10853 碘 I 12756 钡 Ba 13778 铂 Pt 19579 金 Au 19780 汞 Hg 201。