配位化合物
- 格式:doc
- 大小:129.00 KB
- 文档页数:7
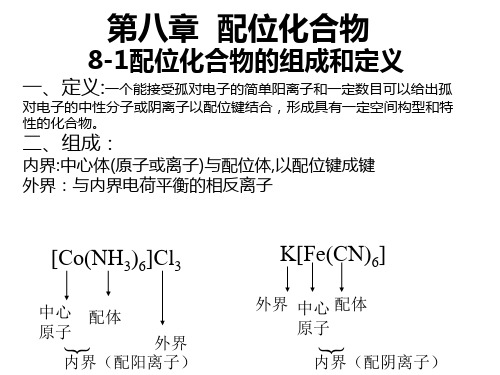




什么是配位化合物?配位化合物是指由一个或多个配位体(ligand)与一个中心金属离子(或原子)通过配位键(coordination bond)结合形成的化合物。
在配位化合物中,配位体通过共用电子对与中心金属离子形成配位键,将其固定在配位体的周围形成配位球形结构。
1. 配位体:配位体是能够提供一个或多个电子对给中心金属离子的分子或离子。
配位体通常是具有孤对电子的原子或分子,包括有机分子如胺、醇和酸以及无机分子如氨、水和卤素离子等。
配位体通过配位键与中心金属离子结合,形成稳定的配位化合物。
2. 配位键:配位键是指配位体与中心金属离子之间的共用电子对。
配位键通常是通过配位体中的孤对电子与中心金属离子中的空轨道形成。
这种共用电子对的形成使得配位体与中心金属离子之间形成了较强的化学键。
配位键可以是单个配位体提供一个电子对形成的单配位键,也可以是多个配位体提供多个电子对形成的多配位键。
根据配位键的数量,配位体可以分为单齿配位体、多齿配位体和桥配位体等。
3. 配位球形结构:配位化合物中的配位体通过配位键与中心金属离子结合,形成了一个稳定的配位球形结构。
在这个结构中,中心金属离子被配位体包围,形成一个多面体的结构。
配位球形结构的形状和几何构型取决于配位体的种类和数量,以及中心金属离子的电子构型。
常见的配位球形结构包括八面体、四方体、正方形平面、三角双锥等。
这些不同的结构对于化合物的性质和反应有重要影响。
配位化合物具有许多特点和性质。
首先,配位化合物通常具有良好的溶解性和热稳定性,因为配位键是较强的化学键。
其次,配位化合物的颜色通常取决于中心金属离子的电子结构和配位体的取代情况。
这使得配位化合物在催化、荧光和生物活性等领域具有重要应用。
此外,配位化合物还可以通过改变配位体的种类和数量来调节其性质和功能,如选择性吸附、储能和分子识别等。
配位化合物是化学中的重要概念,对于理解过渡金属化学、配位化学和配位聚合物等领域具有重要意义。

第十一章配位化合物一、选择题1. 配位数为6的配离子的空间构型是:A、三角锥形B、四面体形C、平面四边形D、八面体形2. Fe(Ⅲ)形成的配位数为6 的内轨配合物中,Fe3+离子接受孤对电子的空轨道是:A、d2sp3B、sp3d2C、p2d4D、sd53. 在[CoCl(NH3)3(en)]2+中,中心离子Co3+的配位数为:A、3B、4C、5D、64. [Cr(en)3]2+离子中铬的配位数及配合物中配体的个数是:A、3,3B、3,6C、6,6D、6,35. 根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋或低自旋的电子构型是:A、d2B、d3C、d6D、d96. 形成高自旋配合物的原因是:A、分裂能△< 电子成对能PB、分裂能△= 电子成对能PC、分裂能△> 电子成对能PD、不能只根据分裂能△和电子成对能P确定7. 在[CoCl(NH3)3(en)]2+中,中心离子Co3+的配位数为:A、3B、4C、5D、68. 对于配离子[Co(NH3)5H2O]3+,下列命名正确的是:A、一水⋅五氨合钴(Ⅲ)离子B、五氨⋅一水合钴(Ⅲ)离子C、氨⋅一水合钴(Ⅲ)离子D、五氨⋅一水合钴离子9. Ni(Ⅱ)形成的配位数为4具有四面体形的配合物中,Ni2+离子接受孤对电子的空轨道是:A、sp3B、sp3d2C、spd2D、dsp210. 对于配离子[CoCl(NH3)3(en)]2+,下列命名正确的是:A、三氨⋅一氯⋅乙二胺合钴(Ⅲ)离子B、一氯⋅三氨⋅乙二胺合钴(Ⅲ)离子C、一氯⋅乙二胺⋅三氨合钴(Ⅲ)离子D、乙二胺⋅一氯⋅三氨合钴(Ⅲ)离子11. Co(Ⅱ)形成的配位数为6 的外轨配合物中,Co2+离子接受孤对电子的空轨道是:A、d2sp3B、p2d4C、s p2d3D、sp3d212.下列配合物的命名不正确的是A 、[]()3233K Co(NO )Cl III 三氯三硝基合钴酸钾B 、[]()3233K Co(NO )Cl III 三硝基三氯合钴酸钾C 、()()()2323Co OH NH Cl Cl III ⎡⎤⎣⎦氯化二氯一水三氨合铬D 、[]()26H PtCl IV 六氯合铂酸13.下列离子都可以作为配合物的中心原子,但生成的配合物稳定性最差的是A 、3+ScB 、3+CrC 、3+FeD 、3+La14. ()()232Cr py H O Cl ⎡⎤⎣⎦的名称是: A 、三氯化一水二吡合铬(III ) B 、一水合三氯化二吡合铬(III )三氯一水二吡合铬(III ) D 、一水二吡三氯合铬(III ) 15. 下列哪种物质是顺磁性的:A 、()234Zn NH +⎡⎤⎣⎦B 、()336Co NH +⎡⎤⎣⎦C 、[]4TiFD 、()336Cr NH +⎡⎤⎣⎦ 16.配离子的稳定性与其配位键类型有关,根据价键理论,可以判断下列配合物稳定性的大小,指出正确的是A 、()()33266Fe CN Fe H O -+⎡⎤⎡⎤<⎣⎦⎣⎦ B 、()()32266Fe CN Fe H O -+⎡⎤⎡⎤>⎣⎦⎣⎦C 、()()322Ag CN Ag NH -+⎡⎤⎡⎤=⎣⎦⎣⎦ D 、()()322Ag CN Ag NH -+⎡⎤⎡⎤<⎣⎦⎣⎦ 17.化合物[]36K FeF 的磁矩为5.9B.M.,而()36K Fe CN ⎡⎤⎣⎦的磁矩为2.4B.M.,对于这种差别可以用下列哪一项所叙述的理由来解释A 、铁在这两种化合物中有不同的氧化数B 、氰离子比氟离子引起更多的d 轨道分裂C 、氟比碳、氮具有更大的电负性D 、氰离子是弱的电子授体18.某金属中心离子形成配离子时,由于配体的不同,其d 电子分布可以有1个未成对电子,也可以有5个未成对电子,此中心离子是A 、3+CrB 、3+NiC 、3+FeD 、2+Co19. 某金属离子在八面体弱场中的磁矩为4.9B.M.,而它在八面体强场中的磁矩为零,该中心金属离子可能是: A 、3+CrB 、2+MnC 、3+Mn2+Fe20. 中心离子形成配位键的必要条件是( )A 、中心原子具有孤电子对B 、中心原子具有适当的空轨道C 、配体具有未键合孤对电子D 、B ﹑C 两个条件均须具备 21. 合物空间构型的主要因素是( )A 、中心原子的氧化数B 、中心原子的配位数C 、中心原子的空轨道D 、中心原子空轨道的杂化类型 22. 子的配位数在数值上等于( )A 、配体与中心原子之间的配位键数目B 、配体数C 、中心原子的氧化数D 、配离子价数 23. 子或离子中,不能做配体的是( )A 、I –B 、NH 3C 、H 2OD 、NH 4+二、计算题和问答1.用晶体场理论判断配离子2+26[Fe(H O)],4-6[Fe(CN)],3-6[CoF ],3+3[Co(en)](1023000cm -∆=,Co(III)的电子成对能121000P cm -=)是高自旋还是低自旋,并计算配合物的磁矩μ以及晶体场稳定化能(CFSE )。
2.市售的用作于干燥剂的蓝色硅胶,常掺有带有蓝色的2+Co 离子同-Cl 键合的配合物,用久后变为粉红色则无效。
(1)写出蓝色配离子的化学式; (2)写出粉红色配离子的化学式;(3)Co(II)离子的d 电子数为多少?如何排布? 写出粉红色和蓝色配离子与水的有关反应式,并配平。
3.试解释以下事实: (1)氰化物对人体有强毒性;(2)()453NH ZnCl 中并不存在3-5ZnCl 配离子;(3)()432NH CuCl 晶体中含有四面体构型3-4CuCl 配离子无限长结构; (4)3-8Mo(CN)离子不稳定,易被氧化成Mo (VI);(5)42CuSO 5H O⋅晶体中2+Cu 离子配位了四个水分子。
4.已知配离子[]336Co(NH )+是反磁性的。
(1)请根据价键理论讨论[]336Co(NH )+的形成过程。
(2)请根据晶体场理论解释[]336Co(NH )+的中心离子电子排布方式。
(3)当[]336Co(NH )+被还原成[]236Co(NH )+时,试用晶体场理论讨论[]236Co(NH )+的中心离子电子排布式及配离子的磁性。
参考[]336Co(NH )+及[]236Co(NH )+的K 稳数值,你认为哪种形式较为合理? 5.试验测定24[NiCl ]-是顺磁性物质,24[Ni(CN)]-为抗磁性物质,试用晶体场理论判别它们的分裂能与成对能的相对大小,并指出它们的几何构型。
6.已知3+Fe 的d 电子成对能为-1358kJ mol ⋅,由-F 或-CN 的八面体场形成配合物的分裂能分别经实验测出是:--1--1(F )13961cm ,(CN )34850cm o o ∆=∆=,由此判断:(1)36[Fe(CN)]-及36[FeF ]-的相对稳定性大小。
(2)36[Fe(CN)]-及36[FeF ]-的自旋状态及磁矩。
(3)计算它们的晶体场稳定化能(不考虑电子之间的相互作用)。
7.电镀废液中含有2[Ag(CN)]-,对环境造成污染,如何处理废液并回收其中的Ag8.已知2+Ni 水溶液为绿色,你预测23[Ni(en)]+是什么颜色?为什么?9.已知3+2+Co /Co ϑϕ=1.82V ,所以2+Co 很难被氧化成3+Co 。
但是,若在氨液中,却很容易被空气氧化。
试说明其原因。
10.化合物26K SiF ,26K SnF 和26K SnCl 都为已知的,但26K SiCl 却不存在,试加以解释。
11. 已知[NiCl4]2-是顺磁性,而[Ni(CN)4]2-是反磁性的;用价键理论场理论解释并推测这两个配合物的空间构型。
12. 已知:EθAg+/Ag=0.80v, Eθ[Ag(CN)2] -/Ag=-0.44v 将以上两电对组成原电池。
(1)写出电池符号。
(2)写电极反应和电池反应。
(3)求电动势。
(4)计算[Ag(CN)2]-的稳定常数。
13. 已知[Fe (H2O)6]3+是顺磁性,[Fe(CN)6]4 - 是反磁性的;用价键理论及晶体场理论解释。
14. 原电池装置中,一端为铜片和0.5mol⋅L-1CuSO4溶液,另一端为银片和0.5mol⋅L-1 Ag NO3溶液。
已知Eθ(Cu2+/Cu)=0.337V,EθAg+/Ag=0.799v(1)写出原电池符号。
(2)写电极反应和电池反应。
(3)求电动势。
(4)加氨水于CuSO4溶液中,若控制NH3和[Cu(NH3)4]2+的浓度为1.0mol⋅ L-1测得Eθ[Cu(NH3)4]2+/Cu]= -0.0537 V,求[Cu(NH3)4]2+的稳定常数。
18. 已知:EθAg+/Ag=0.799v, EθAg(NH3)2+/Ag=0.383v, EθAgCl/Ag=0.222v,求(1)AgCl的Ksp。
(2)[Ag(NH3)2]+的稳定常数。
(3)若要使0.1mol的AgCl完全溶解在1.0L的NH3 水溶液中,问此NH3 水的最初浓度是多少19. 请解释为什么反磁性配合物[Co(NO2)6]3-呈橙黄色,而顺磁性配合物[CoF6]3-呈蓝色?(配合物晶体场理论)20. 定性地解释以下现象:(1)向Hg(NO3)2滴加KI,反过来,向KI滴加Hg(NO3)2,滴入一滴时,都能见很快消失的红色沉淀,分别写出沉淀消失的反应。
(2)少量AgCl沉淀可溶于浓盐酸,但加水稀释溶液又变混浊。
(3) Cu(NH3)42+呈深蓝色而Cu(NH3)2+却几乎无色。
21.已知向0.010mol·dm-3ZnCl2溶液通H2S至饱和,当溶液的pH=1.0时刚开始有ZnS沉淀产生。
若在此浓度ZnCl2溶液中加入1.0mol·dm-3KCN后通入H2S至饱和,求在多大pH时会有ZnS沉淀产生?{〔〕=5.0×1016}22.在1dm3 6mol·dm-3的氨水中加入0.01mol固体CuSO4,溶解后,在此溶液中再加入0.01mol固体NaOH,是否会有Cu(OH)2沉淀生成?{〔〕=2.09×1013,〔〕=2.2×10-20}。