第12章 配位化合物
- 格式:ppt
- 大小:1.40 MB
- 文档页数:88

第7章金属配位化合物一、要点1.配位化合物是含有配位个体的由简单化合物形成的一类复杂的化合物。
配位个体由配位共价键结合起来的相对稳定的结构单元叫做配位个体。
内界和外界就配合物整体而言,配位个体的结构单元叫做配合物的内界,而配位个体以外的部分叫做外界。
2.中心原子(离子)处于配合物内界结构单元中心部位的原子或离子叫中心原子或中心离子。
3.配位体配位个体中与中心原子结合的分子或离子叫做配位体,简称配体。
4.配位原子配体中直接键合于中心原子的原子叫配位原子,它是电子对的给予体。
5.配位数与中心原子成键的配位原子数叫做配位数。
6.单齿和多齿配位体只含有一个配位原子的配位体叫做单齿配位体,含有两个或两个以上的配位原子的配位体叫做多齿配位体。
7.螯合物多齿配位体以两个或两个以上配位原子配位于中心原子形成的配合物称做螯合物。
8.配位场的价键理论以中心原子内价电子轨道的杂化和配位体中配位原子间轨道的重叠为基石讨论配合物的成键情形是配位场价键理论的核心。
9.外轨和内轨配位体形成前后,中心原子的d电子排布没有变化,配位原子的孤对电子填在外层轨道而得的杂化轨道上,这样的一类化合物叫外轨型化合物。
配位体形成前后中心原子的d电子排布发生了变化,原来由单电子占据、后腾空了的(n-1)d轨道参与杂化,这样的一类化合物叫内轨型配合物。
10.晶体场理论晶体场理论是一种改进了的静电理论,该理论将配位体看作点电荷或偶极子,除考虑配位体阴离子负电荷或极性分子偶极子负端与中心原子正电荷间的静电引力外,着重考虑配位体上述电性对中心原子d电子的静电排斥力,即着重考虑中心原子5条价层d轨道在配位体电性作用下产生的能级分裂。
11.高自旋和低自旋代表了晶体场理论中电子自旋的两种状态,当成对能大于分裂能,配合物中的单电子数较多,称之为高自旋配合物;而当分裂能大于成对能时,配合物中的电子尽可能成对,单电子数较少,称之为低自旋配合物。
晶体场理论中的高自旋配合物和低自旋配合物分别对应于价键理论中的外轨型配合物和内轨型配合物。


高一化学配位化合物知识点在高一化学学习中,配位化合物是一个重要的知识点。
本文将介绍配位化合物的定义、组成部分、命名规则以及常见的应用。
一、配位化合物的定义配位化合物是指由中心金属离子或原子与周围的配体(通常是阴离子或分子)通过坐标键结合而形成的化合物。
配体通过提供一对电子对与金属离子形成坐标键,从而将金属离子包围在周围,形成具有特定结构和性质的化合物。
二、组成部分配位化合物的主要组成部分包括中心金属离子或原子和配体。
中心金属离子或原子是配位化合物的核心,它的性质和配位能力对化合物的性质有重要影响。
配体是由一个或多个原子或分子通过配位键与金属离子或原子结合而形成的,它决定着化合物的结构和性质。
三、命名规则为了方便命名和描述,国际纯粹与应用化学联合会(IUPAC)制定了一套统一的命名规则。
一般而言,配位化合物的命名按照以下顺序进行:配体的名称、中心金属的名称、配位数、配体数目以及配体的取代位置。
例如,对于一种由氯离子和四个水分子构成的配位化合物,其命名为四氯合四水合铁(II)。
四、常见的应用配位化合物在生活中具有广泛的应用。
以下是一些常见的应用领域:1. 医学应用:配位化合物在医学领域中被广泛用于药物研发和治疗。
例如,铂络合物是一类有效的抗癌药物,可用于治疗多种肿瘤。
2. 工业催化剂:一些配位化合物具有良好的催化性能,用于工业催化反应中。
例如,以过渡金属离子为中心的配位化合物可以作为氢化催化剂或催化剂用于有机合成反应。
3. 环境保护:配位化合物可应用于环境污染治理和废水处理等领域。
例如,一些过渡金属离子配合物可用于吸附和去除有害金属离子。
4. 材料科学:配位化合物在材料科学中扮演着重要角色。
许多金属配合物具有特殊的化学、物理和光电性能,被广泛用于制备光电材料、电池材料和传感器等。
通过了解配位化合物的定义、组成部分、命名规则以及常见的应用领域,我们可以更好地理解和应用这一化学概念。
配位化合物的研究和应用对于推动化学学科的发展和解决实际问题非常重要。



配位化合物的命名配位化合物的命名一般分为俗名和系统命名两大类。
本章主要参照IUPAC 无机物命名委员会所采用的命名法,讨论系统命名的基本原则。
1. 内外界顺序与一般无机物的命名原则相同。
若配离子为阳离子,外界离子在前,配离子在后,命名为“某化某”或“某酸某”;若配离子为阴离子,配离子在前,外界离子在后,命名为“某酸某”。
2. 内界中各物质的命名顺序为:配体数(汉字数字)—配体名称(不同配体间用中圆点分开)—合—中心原子名称—中心原子氧化值(罗马数字)。
3. 不同配体的先后顺序按下列原则进行命名:(1)若配离子中既有无机配体又有有机配体。
则无机配体排列在前,有机配体排列在后。
(2)若同时存在阴离子配体和中性分子配体,则先阴离子配体后中性分子配体。
(3)若都为同类配体,则按配位原子的元素符号在英文字母的顺序排列。
(4)若同类配体中配位原子相同,配体中含原子的数目也相同,则按在结构式中与配位原子相连的原子的元素符号的英文字母顺序排列。
(5)若同类配体中配位原子相同,配体中含原子的数目不同,则将较少原子数的配体排在前面,较多原子数的配体列后。
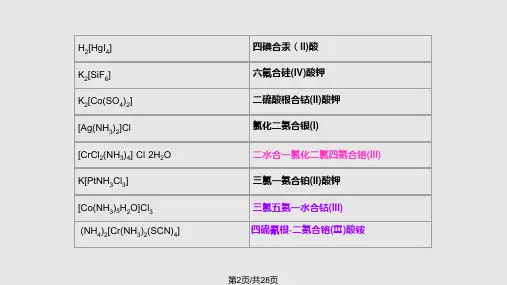
下面是一些配合物的命名实例:[Cu(NH3)4]2+ 四氨合铜(Ⅱ)离子[CoCl2(NH3)4]+二氯·四氨合钴(Ⅲ)离子[Fe(en)3]Cl3 三氯化三(乙二胺)合铁(Ⅲ)[Ag(NH3)2]OH 氢氧化二氨合银(I)H2[PtCl6] 六氯合铂(Ⅳ)酸[Co(ONO)(NH3)5]SO4 硫酸亚硝酸根·五氨合钴(Ⅲ)[Co(NH3)5(H2O)]2(SO4)3硫酸五氨·水合钴(Ⅲ)[Co(NH3)2(en)2]Cl3氯化二氨·二(乙二胺)合钴(Ⅲ)NH4[Co(NO2)4(NH3)2] 四硝基·二氨合钴(Ⅲ)酸铵NH4[Cr(NCS)4(NH3)2] 四(异硫氰酸根) ·二氨合铬(Ⅲ)酸铵没有外层的配合物,中心原子的氧化值可不必标明,如:[Ni(CO)4] 四羰基合镍[PtNH2(NO2)(NH3)2] 氨基·硝基·二氨合铂。

第十二章配位化合物12.1 配合物的基本概念12.1.1配合物的定义历史上有记载的最早发现的第一个配合物就是我们很熟悉的亚铁氰化铁Fe4[Fe(CN)6]3(普鲁士蓝)。
它是在1704年普鲁士人狄斯巴赫在染料作坊中为寻找蓝色染料,而将兽皮、兽血同碳酸纳在铁锅中强烈地煮沸而得到的。
后经研究确定其化学式为Fe4[Fe(CN)6]3。
近代的配合物化学所以能迅速地发展也正是生产实际需要的推动结果。
如原子能、半导体、火箭等尖端工业生产中金属的分离技术、新材料的制取和分析;50年代开展的配位催化,以及60年代蓬勃发展的生物无机化学等都对配位化学的发展起了促进作用。
目前配合物化学已成为无机化学中很活跃的一个领域。
今后配合物发展的特点是更加定向综合,它将广泛地渗透到有机化学、生物化学、分析化学以及物理化学、量子化学等领域中去。
如生物固氮的研究就是突出的一例。
配合物的形成:在CuSO4溶液中加入氨水,首先得到难溶物,继续加氨水,难溶物溶解,得到透明的深蓝色的溶液。
蓝色物质为复杂离子[Cu(NH3)4]2+ ,蒸发该溶液析出深蓝色晶体,其化学组成为[Cu(NH3)4]SO4·H2O。
在纯的[Cu(NH3)4]SO4溶液中,除了水合硫酸根离子和深蓝色的[Cu(NH3)4]2+离子外,几乎检查不出Cu2+离子和NH3分子的存在。
[Cu(NH3)4]2+这种复杂离子不仅存在于溶液中,也存在于晶体中。
从上面实例可以看出,这些复杂离子至少不符合经典原子价理论,在晶体和溶液中有能以稳定的难离解的复杂离子存在的特点。
由于这类化合物的组成比较复杂,要给它下一个严密的定义是很困难的。
从实质上看,配合物中存在着与简单化合物不同的键--配位键,这才是配合物的本质特点。
因此把配合物的定义可归纳为:中国化学会在1980年制订的《无机化学命名原则》中对配合物作了如下的定义:配位化合物(简称配合物)是由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(称为配体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称中心原子)按一定的组成和空间构型所形成的化合物。



LOGO第十二章 配位化合物 ( coordination compound )第一节 配位化合物的基本概念一、配位化合物的定义CuSO4(蓝色溶液)+NaOH→Cu(OH)2(蓝色↓) +BaCl2 →BaSO4(白色↓ )CuSO4(蓝色溶液)+NH3(浓)→ 深蓝色溶液 蓝色晶体:1.没有氨臭→无游离的氨2. +NaOH: (-) →无游离的Cu2+ 3. +BaCl2 :(+) →有游离的SO42Cu2+与NH3形成了一种复杂离子[ Cu ( NH3 ) 4] 2+第一节 配位化合物的基本概念定义:配离子:由简单阳离子(或原子)和一定数 目的中性分子或阴离子配体通过 配位键结合,并按一定的组成和 空间构型所形成的复杂离子配合物:含有配离子的化合物或配分子第一节 配位化合物的基本概念二、配合物的组成 [ Cu ( NH3 ) 4] SO4(inner sphere)内界(离子键)外界(outer sphere) [ Cu ( NH3 ) 4]2+中心原子Cu2+ 配体NH3 配位原子:N 配位键:中心原子Cu2+提供空轨道 配位原子N提供孤对电子第一节 配位化合物的基本概念配合物的结构离子键 配位键K4+┆ [Fe┆(CN)6] 4中心原子 配体外界内界配合物第一节 配位化合物的基本概念中心原子(central atom):一般为副族元素 配体(ligand):一般为负离子或中性分子 如:H2O、CO、NH3 、 X- 、 OH- 、 CN、 NO2-、ONO-、SCN-、NCS-、乙二胺 等。
配位原子(donor atom):提供孤对电子的 原子。
1第一节 配位化合物的基本概念第一节 配位化合物的基本概念配位数(coordination number) =配位原子个数 ≠配体个数:一般为2,4,6单齿配体(monodentate ligand) :一个配体内一 个配位原子配位数=配位原子个数= 配体个数多齿配体(multidentate ligand) :一个配体内多 个配位原子配位数=配位原子个数≠ 配体个数第一节 配位化合物的基本概念乙二胺:H2NCH2CH2NH2 [Cu(en)2]SO4 配位数=4乙二胺四乙酸(EDTA):一个分子有六个配位原子HOOCCH 2 HOOCCH 2NCH 2CH 2NCH 2COOH CH 2COOH第一节 配位化合物的基本概念影响配位数的因素1.中心原子的体积和电荷 2.配体的体积和电荷 3.中心原子和配体的半径 4.配体的浓度和反应时温度第一节 配位化合物的基本概念三、配合物的命名1.配离子:配体数—配体名称—“合”—中心原 子名称(氧化数)(用罗马字表示)Cu(NH3)42+ 四氨合铜(II)配离子 2.多配体:先无机后有机,先阴后中,先简单 后复杂,最后以配位原子元素的英文字母顺 序先后排列[Co(OH)2(NH3)4]+ 二羟•四氨合钴(III)配离子第二节 配合物的化学键理论一、价键理论 (一)要点:1.中心原子与配体之间的化学键是配位键。