转基因西红柿辨别
- 格式:doc
- 大小:12.50 KB
- 文档页数:3

如何鉴别转基因食品(图文版)最近看到《今日头条》法国科学家实验证明转基因玉米诱发肿瘤。
看到被做实验的小白鼠身上长出来大大的肿瘤和痛苦的样子,实在感到恐怖。
今天小编特意整理出一些,帮助大家怎样识别转基因食品的文章,为了我们自己及家人,请一定看看!非转基因大豆:为椭圆形状,有点扁。
肚脐为浅褐色。
豆大小不一。
打出来的豆浆为乳白色。
转基因大豆:为圆形,滚圆。
肚脐为黄色或黄褐色。
豆大小差不多。
打出来的豆浆有点黄,用此豆制作的豆腐什么的都有点黄色。
简单的检验方法:转基因大豆不发芽!可以用水检测!本土大豆用水浸泡三天会发芽!转基因大豆不会发芽,只不过是个体膨胀而已。
从这个发芽试验过程,人们可以发现,这些转基因大豆是一次性产生的果实,它们的胚芽是不具有生命本质活性的,因此,就没有延续后代的能力。
相当于——可以正常怀孕,但是每一次都是死胎,这就意味着生命的延续到此为止了。
那么人类如果大规模地长期食用各种转基因食品,其中危害人类的转基因片断,必然会潜移默化地影响直至改变人类本身的正常基因,抵抗力下降,怪病丛生,或者丧失生育能力都是情理之中的了。
2、胡萝卜3、土豆4、玉米[/back]转基因玉米:甜脆、饱满、体形优美、头颗粒尾差不多。
[/back][/back] [/back]5、大米[/back]在中国取得转基因大米合法种植权的地区是湖北,要警惕细长很亮的米,容易与东北“长粒香”混淆。
买的时候一定看清原产地。
[/back][/back]7、其他鉴别方法[/back][/back]进口水果的标签。
一般来说,在标签的最下方一般印有出口国的名称,中间的英文字母标明水果的名称,最上方的英文字母标识的是出口企业的名称。
在每个标签的中间一般有4位阿拉伯数字:3字开头的表示是喷过农药。
4字开头的表示是转基因水果;5字开头的表示是杂交水果。
(1)超市购买食品时一定要上心,先查是否有转基因标注。
根据《农业转基因生物标识管理办法》,转基因食品应有标注。

小番茄是不是转基因千禧小番茄是转基因吗
平时在菜市场买到的西红柿都是跟苹果差不多大小的,但最近在水果市场上看到一种小番茄卖的很火,而且吃起来味道甜爽,非常好吃,不知道这种小番茄是不是转基因食品呢?
一、小番茄是不是转基因
不是转基因食品。
转基因食物的定义是运用科学手段从某种生物中提取所需要的基因,将其转入另一种生物中,使与另一种生物的基因进行重组,从而产生特定的具有优良遗传性状的物种,而小番茄并不是通过人为改变基因获得的品种,它的出现在很早以前就有了,只是当时的产量不好,而且主要是以观赏种植,后来随着种植技术增强,产量提高,才逐渐发展为食品食用。
二、小番茄是由大番茄转变来的吗
不是。
小番茄又叫樱桃番茄、圣女果,起源于南美洲,是野生的樱桃番茄进化来的,并不是将大番茄变小而来的,而是它本来就是那样的大小,其小小的果子,可以一口一个,比大番茄更方便食用,常作为生食的水果来吃。
三、小番茄是不是染色的
不是。
日常可见的小番茄其果实颜色十分丰富,有红色、粉色、黄色及
橙色,其中以红色栽培居多,是不同品种的番茄杂交培育来的,并不是染色所得,假如你吃到的小番茄外面红彤彤,但里面还是绿色的,这也不属于染色现象,可能跟小番茄还未熟透或种植条件不好有关。
四、千禧小番茄是转基因吗
也不是。
千禧樱桃小番茄是近年来农艺师从圣女果品种中优选培育出来
的一个新品种,产自海南陵水,可以说是圣女果的“升级版”,其果色大红,含糖量高,硬度高,耐贮运,个头比圣女果要小一些,但是营养成分、口感均比圣女果要好,其中维生素PP的含量居果蔬之首。

转基因食品鉴别识————————————————————————————————作者:————————————————————————————————日期:转基因食品鉴别知识资料来源:新浪博客一、转基因蔬菜一般具备的特征1、没有传统蔬菜参差不齐的外形,普遍个头均匀,型大体长,色泽光艳,质地鲜嫩,如黄瓜、茄子、丝瓜、洋葱等;2、非传统原始地道的味道,无论是烹调前或烹调后的气味还是滋味具备与传统蔬菜明显的区别,如甜椒等;3、非当地时令菜蔬,各类蔬菜的一大特性就是均具备很强的季节性和地域性,有部分非当地时令菜蔬并非依靠外地长时间保鲜和运输而来,而是靠转置耐寒或耐高温基因所得。
二、转基因食品鉴别知识1、看产地:尽量避开那些转基因比较“泛滥”的地区。
如东北地区转基因大豆种植面积比较大。
2、看外包装标识:看是否有转基因提示或标识。
这一点,在一些食用油产品上有相关标识,但在非食用油产品中,还比较少见。
3、看产品品种:如一种俗称为“先玉335”的玉米,就是一种典型的转基因玉米。
4、看检测报告:现在像大豆、玉米等产品,是否为转基因是能够通过检测来鉴定的。
尤其需要注意的是,现在市面上的某些产品,如玉米,即便声明为非转基因,也未必不含转基因成分,更不用说未说明是否含转基因的产品了。
如我们曾对一份所谓非转基因的玉米进行了转基因检测。
检测结果表明,该产品中含有CAMV35S启动子,转基因抗虫玉米MON810成分。
其检测结果为阳性(即含有转基因成分)。
选择有机食品:因为有机食品除了要求不打农药,不施化肥,无激素、抗生素等外,还有一个重要的条件,就是非转基因。
5、其他鉴别方法可以留意一下进口水果的标签。
一般来说,在标签的最下方一般印有出口国的名称,中间的英文字母标明水果的名称,最上方的英文字母标识的是出口企业的名称。
在每个标签的中间一般有4位阿拉伯数字:3字开头的表示是喷过农药。
4字开头的表示是转基因水果;5字开头的表示是杂交水果。
有关西红柿转基因成分的检测方法都知道,西红柿是一种非常有营养的食物,具有减肥瘦身、消除疲劳、增进食欲、提高对蛋白质的消化、减少胃胀食积等功效。
深受大家喜爱。
但是随着农作物的不断发展,逐渐的技术上加以不断的改良,乃至进入转基因技术。
那么问题来了——转基因的西红柿能吃吗?对身体有没有害呢?转基因的食物一般都是经过严格测试的,对大多数人无毒.转基因的基因来源也一般是高等动物的激素基因,我们吃转基因西红柿时相当于是多吃了点动物蛋白.另外,西红柿被我们吃过后,经过我们的消化系统,DNA已经被消化成脱氧核苷酸,是不会对我们造成危害的.转基因食品分为不同安全级别,一般来说作为食品的西红柿是无毒的.因为虽然西红柿是转基因的,但是这只是向某个西红柿的受精卵细胞核内注入了少量外来基因.严格来说转基因西红柿还是西红柿,所以还是能吃.那么大家还会想知道怎样区分转基因的西红柿呢?实际上单纯从外观上是看不出来的,需要用仪器检测方可知道。
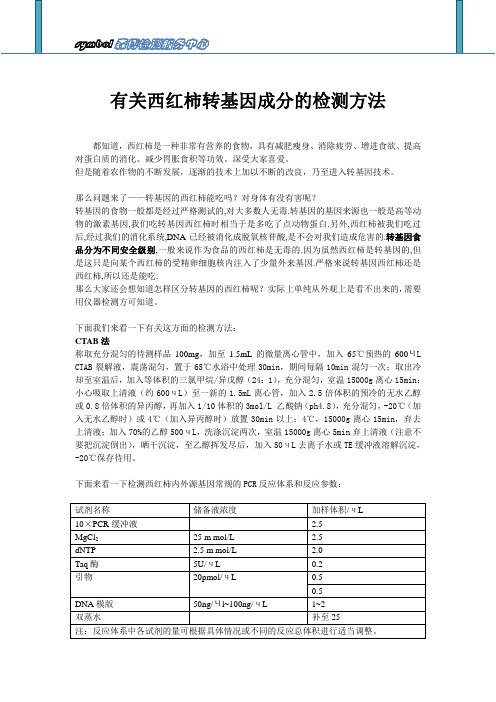
下面我们来看一下有关这方面的检测方法:CTAB法称取充分混匀的待测样品100mg,加至1.5mL的微量离心管中,加入65℃预热的600ЧL CTAB裂解液,震荡混匀,置于65℃水浴中处理30min,期间每隔10min混匀一次;取出冷却至室温后,加入等体积的三氯甲烷/异戊醇(24:1),充分混匀,室温15000g离心15min;小心吸取上清液(约600чL)至一新的1.5mL离心管,加入2.5倍体积的预冷的无水乙醇或0.8倍体积的异丙醇,再加入1/10体积的3mol/L 乙酸钠(ph4.8),充分混匀,-20℃(加入无水乙醇时)或4℃(加入异丙醇时)放置30min以上;4℃,15000g离心15min,弃去上清液;加入70%的乙醇500чL,洗涤沉淀两次,室温15000g离心5min弃上清液(注意不要把沉淀倒出),晒干沉淀,至乙醇挥发尽后,加入50чL去离子水或TE缓冲液溶解沉淀,-20℃保存待用。

转基因番茄的可见近红外光谱快速无损检测方法一、本文概述随着生物技术的快速发展,转基因技术在农业领域的应用日益广泛,转基因作物的商业化种植已经成为全球趋势。
然而,转基因作物的安全性和品质问题一直备受公众关注。
为了实现对转基因作物的有效监管和品质评估,无损检测技术的研究和应用显得尤为重要。
本文旨在探讨利用可见近红外光谱技术,对转基因番茄进行快速无损检测的方法,以期为转基因作物的品质控制和安全监管提供新的技术手段。
转基因番茄作为转基因作物的一种,其基因结构的改变可能导致光谱特性的变化。
可见近红外光谱技术作为一种非破坏性的检测方法,能够反映物质内部的结构信息,因此在转基因作物的检测中具有潜在的应用价值。
本文将详细介绍可见近红外光谱技术在转基因番茄检测中的应用原理、实验方法、数据处理以及结果分析等方面,为相关领域的研究提供参考和借鉴。
本文首先介绍转基因技术的背景、发展现状及其在农业领域的应用,然后阐述可见近红外光谱技术在作物检测中的应用原理和优势。
接着,本文将详细介绍实验材料、光谱采集设备、光谱预处理方法和数据分析方法,并通过实验验证可见近红外光谱技术在转基因番茄检测中的可行性和准确性。
本文将对实验结果进行讨论,分析可见近红外光谱技术在转基因番茄检测中的优势和局限性,并提出未来研究方向和建议。
通过本文的研究,希望能够为转基因作物的无损检测提供新的技术手段,为转基因作物的品质控制和安全监管提供科学依据,同时推动可见近红外光谱技术在农业领域的应用和发展。
二、文献综述转基因技术在现代农业中的应用越来越广泛,特别是在提高作物产量、增强抗病性、优化营养品质等方面发挥着重要作用。
然而,随着转基因作物的普及,其安全性和消费者接受度问题也日益受到关注。
因此,发展快速、无损的转基因作物检测方法对于确保食品安全、保护消费者权益具有重要意义。
近红外光谱技术作为一种快速、无损的检测方法,在农业和食品领域的应用逐渐受到重视。
该技术利用物质在近红外区域内的光谱特性,结合化学计量学方法,可以快速获取样品内部成分和结构信息。

Tears are salty and sweat is salty, but I prefer sweat.(页眉可删)教你六招辨别转基因食品所谓转基因食品,就是利用生物技术,将某些生物的基因转移到其他物种中去,改造生物的遗传物质,使其在性状、营养品质、消费品质等方面向人类所需要的目标转变,以转基因生物为直接食品或为原料加工生产的食品就是转基因食品。
人们看待转基因食品都持有不同的态度。
下面是收集整理的六招辨别转基因食品妙招,欢迎参考!常见的转基因食品辨别1、大豆非转基因大豆:为椭圆形状,有点扁。
肚脐为浅褐色。
豆大小不一。
打出来的`豆浆为乳白色转基因大豆:为圆形,滚圆。
肚脐为黄色或黄褐色。
豆大小差不多。
打出来的豆浆有点黄,用此豆制作的豆腐什么的都有点黄色。
简单的检验方法:转基因大豆不发芽!可以用水检测!本土大豆用水浸泡三天会发芽! 转基因大豆不会发芽,只不过是个体膨胀而已。
2、胡萝卜非转基因胡萝卜:表面凸凹不平,一般不太直,从头部到尾部是从粗到细的。
且头部是往外凸出来的。
转基因胡萝卜:表面相对较光滑,一般是直的,它的尾部有时比中间还粗。
且头部是往内凹的。
3、土豆非转基因土豆:样子比较难看,一般颜色比较深,表面坑坑洼洼的,同时表皮颜色不规则,削皮之后,其表面很快会颜色变深,皮内为白色。
转基因土豆:表面光滑,坑坑洼洼很浅,颜色比较淡。
削皮之后,其表面无明显变化。
检验方法:先削皮后看变化再决定吃不吃。
4、大米在中国取得转基因大米合法种植权的地区是湖北,要警惕细长的很亮的米。
容易与东北“长粒香”混淆。
买的时候一定看清原产地。
5、西红柿转基因西红柿:颜色鲜红很好看,果实较硬,不易裂果。
6、玉米转基因玉米:甜脆、饱满、体形优美、头颗粒尾差不多。
生活中的常识,希望对您有帮助!
转基因让人不育!教你如何识别转基因!
导读:本文是关于生活中常识的,仅供参考,如果觉得很不错,欢迎点评和分享。
据传转基因食品可致人不育,那么如何识别转基因食品?请看下文。
操作方法看生命力转基因食品是一次性产生物,正常的土豆放久了会发芽,但是转基因土豆不放多久都不会发芽。
看颜色转基因食品的颜色跟正常食品的颜色是有区别的,比如大米,正常的大米洗过后米水是白色的,而且米粒也有些许的白,但是转基因大米几乎是透明色的,用水洗,水色也几乎没变化。
看味道正常的食品香味比较浓郁,有果实本身的味道,但是转基因的食品香味淡,跟正常食品的味道也不一样。
看果实成熟状态最明显的是西红柿,正常的西红柿熟透后会变软,但是转基因的西红柿即使外皮已经发红,但是捏起来还是硬硬的。
感谢阅读,希望能帮助您!
生活经验知识分享。
㊀山东农业科学㊀2024ꎬ56(4):1~8ShandongAgriculturalSciences㊀DOI:10.14083/j.issn.1001-4942.2024.04.001收稿日期:2023-04-21基金项目:国家重点研发计划项目(2022YFD1200500)ꎻ国家大宗蔬菜产业技术体系项目(CARS-23-A06)ꎻ国家自然科学基金项目(31872949)作者简介:章力(1995 )ꎬ女ꎬ博士研究生ꎬ研究方向为番茄遗传育种ꎮE-mail:987725999@qq.com通信作者:黄泽军(1974 )ꎬ男ꎬ湖南郴州人ꎬ研究员ꎬ博士生导师ꎬ研究方向为番茄遗传育种ꎮE-mail:huangzejun@caas.cn利用种子红色荧光标记鉴定转基因番茄后代章力1ꎬ2ꎬ魏凯1ꎬ2ꎬ李珊珊1ꎬ宁宇1ꎬ路菲菲1ꎬ王孝宣1ꎬ国艳梅1ꎬ刘磊1ꎬ李鑫1ꎬ杜永臣1ꎬ李君明1ꎬ黄泽军1(1.中国农业科学院蔬菜花卉研究所/蔬菜生物育种全国重点实验室ꎬ北京㊀100081ꎻ2.中国农业大学园艺学院ꎬ北京㊀100081)㊀㊀摘要:转基因技术有助于番茄基因功能研究和遗传改良ꎬ其中转基因后代的筛选是一个非常重要但工作量大的环节ꎮ本研究基于番茄油体蛋白基因家族序列分析和番茄基因表达数据库SGN-TEA搜索结果ꎬ克隆了一个种子特异且高水平表达的油体蛋白基因SlOLE1(Solyc06g034040)ꎮ利用无缝克隆的方法将红色荧光蛋白基因TagRFP的编码区序列插入到SlOLE1基因的终止密码子前ꎬ形成一个嵌合基因SlOLE1-TagRFPꎮ将嵌合基因插入到pBI121双元载体ꎬ构建植物表达载体pSlOLE1-TagRFPꎬ利用农杆菌介导法转化番茄品种 MoneyMaker ꎬT0代植株的自交种子在荧光显微镜下呈现出明亮红色荧光或无荧光ꎮPCR分子标记进一步验证发现ꎬ红色荧光种子萌发的幼苗均存在TagRFP序列ꎬ表明在种子阶段检测红色荧光筛选转基因番茄后代的准确率为100%ꎮ由此ꎬ本研究建立了一种利用SlOLE1-TagRFP嵌合基因ꎬ可以通过种子红色荧光可视化分析ꎬ简单快速㊁低成本地鉴定转基因番茄后代的方法ꎮ关键词:番茄ꎻ种子ꎻ红色荧光蛋白ꎻ油体蛋白ꎻ转基因鉴定中图分类号:S641.2:Q781㊀㊀文献标识号:A㊀㊀文章编号:1001-4942(2024)04-0001-08IdentificationofTomatoTransgenicOffspringwithRedFluorescenceMarkerofSeedsZhangLi1ꎬ2ꎬWeiKai1ꎬ2ꎬLiShanshan1ꎬNingYu1ꎬLuFeifei1ꎬWangXiaoxuan1ꎬGuoYanmei1ꎬLiuLei1ꎬLiXin1ꎬDuYongchen1ꎬLiJunming1ꎬHuangZejun1(1.InstituteofVegetablesandFlowersꎬChineseAcademyofAgriculturalSciences/StateKeyLaboratoryofVegetableBiobreedingꎬBeijing100081ꎬChinaꎻ2.CollegeofHorticultureꎬChinaAgriculturalUniversityꎬBeijing100081ꎬChina)Abstract㊀Transgenictechnologyhascontributedtogenefunctionalstudiesandgeneticimprovementoftomato.Theidentificationoftransgenicoffspringisacost/labor ̄intensiveandtime ̄consumingprocess.Weclonedaseed ̄specificandhighlyexpressedoleosingeneSlOLE1(Solyc06g034040)accordingtotheresultsofsequenceanalysisoftomatooleosingenefamilyandasearchinthetomatogeneexpressiondatabaseSGN ̄TEA.ThecodingregionoftheredfluorescentproteingeneTagRFPwasinsertedintotheupstreamofthestopcodonofSlOLE1genetoproduceachimericgeneSlOLE1 ̄TagRFPꎬwhichwastheninsertedintobinaryvectorpBI121toconstructaplantexpressionvectorpSlOLE1 ̄TagRFP.Theexpressionvectorwasintroducedintoto ̄matovarietyMoneyMakerbyAgrobacterium ̄mediatedmethod.Theseedsfromself ̄crossedT0generationplantsdisplayedbrightredfluorescenceornotunderfluorescencemicroscope.FurtherverificationwithPCRmolecu ̄larmarkershowedthatTagRFPsequencewaspresentintheseedlingsarisingfromfluorescentseedsꎬindica ̄tingthattheaccuracyofidentifyingtransgenictomatoprogenybyredfluorescenceatseedstagewas100%.Thereforeꎬthisstudyestablishedasimpleꎬfastandlow ̄costmethodforidentifyingtransgenictomatooffspringthroughseedredfluorescencevisualizationanalysisusingSlOLE1 ̄TagRFPchimericgene.Keywords㊀TomatoꎻSeedꎻRedfluorescenceproteinꎻOleosinproteinꎻTransgenicidentification㊀㊀转基因技术以及借助转基因的基因编辑技术ꎬ促进了植物基因功能研究ꎬ而且有助于改良植物性状和培育优良新品种ꎮ植物遗传转化后ꎬ转化植株及其后代中外源DNA的检测是一个十分必要的环节ꎬ但工作量大㊁效率有待提高ꎮ在植物的遗传转化工作中ꎬ常借助选择基因和报告基因筛选转基因植株ꎮ以卡那霉素(nptII)和潮霉素(hpt)等抗生素或者EPSPS和Bar等除草剂抗性基因作为选择基因进行筛选[1-2]ꎬ不同植物材料对筛选剂所需的最适浓度差别较大ꎬ会出现假阳性结果ꎬ甚至有时会影响植株的正常生长ꎮ利用GUS作为报告基因筛选时ꎬ需要对转基因植株组织进行GUS染色检测[3]ꎬ会破坏植物组织ꎮFAST(fluorescenceaccumulatingseedtechnol ̄ogy)是一种通过种子特异性启动子驱动荧光融合蛋白表达ꎬ利用种子荧光快速筛选转基因植株的方法ꎬ最早应用于模式植物拟南芥(Arabidopsisthaliana)[4]ꎮ荧光蛋白是一类在特定波长下激发强烈荧光的蛋白质ꎬ可作为报告基因用于检测基因特异性表达和融合蛋白分子的定位㊁迁移㊁构象变化以及分子间的相互作用[5-9]ꎮ红色荧光蛋白(redfluorescentproteinꎬRFP)是从海葵(Discoso ̄maspsp.)中分离出的与绿色荧光蛋白(greenfluo ̄rescentproteinꎬGFP)同源的荧光蛋白[10]ꎬ激发波长和发射波长均较长ꎬ其中ꎬTagRFP的激发波长和发射波长分别为555nm和584nmꎬ其亮度大约是mCherry蛋白的3倍ꎬ具有高pH稳定性和荧光寿命长等特点ꎬ是目前所报道的相对较亮的单体红色荧光蛋白[11]ꎮFAST技术将荧光蛋白作为可视化筛选标记直接鉴定转基因种子ꎬ方法简便且不会对植株产生破坏ꎬ能够降低大面积种植的成本ꎬ有效提高筛选效率[4]ꎮ油体蛋白(oleosin)是一类特殊的贮藏蛋白ꎬ有些油体蛋白在植物种子中特异表达ꎮ当外源小分子量蛋白插入到油体蛋白的N端或C端后不会影响其表达和定位ꎬ且融合蛋白非常稳定[12-13]ꎮ番茄(Solanumlycopersicum)是一种具有重要经济价值的蔬菜作物ꎬ也是果实发育基础研究的模式植物ꎮ转基因技术和基因编辑技术已经大量应用于番茄基础研究和性状改良ꎬ然而传统的方法无法在种子阶段区分转基因和非转基因材料ꎬ转基因后代鉴定效率比较低ꎮ本研究参考FAST技术ꎬ利用番茄种子特异且高水平表达的油体蛋白基因SlOLE1启动子驱动TagRFP融合蛋白表达ꎬ利用种子红色荧光快速有效筛选番茄转基因后代ꎬ为后续的基因功能研究和性状改良带来便利ꎮ1㊀材料与方法1.1㊀植物材料与菌株番茄品种 RioGrande 来自美国俄亥俄州立大学EsthervanderKnaap实验室ꎬ于2020年种植于中国农业科学院蔬菜花卉研究所南区温室ꎮ番茄品种 MoneyMaker (MM)的种子由中国农业科学院蔬菜花卉研究所番茄遗传育种课题组扩繁保存ꎮ大肠杆菌DH5α和农杆菌GV3101购自上海唯地生物技术有限公司ꎮ1.2㊀番茄油体蛋白的鉴定与分析根据拟南芥油体蛋白研究结果[14-16]ꎬ从TAIR(thearabidopsisinformationresource)数据库下载17个拟南芥油体蛋白序列ꎮ以拟南芥油体蛋白序列为查询序列ꎬ采用BLASTP(e-value<1E-5)在茄科基因组数据库SGN(solanaceaege ̄nomicsnetwork)中检索番茄油体蛋白ꎮ从NCBI数据库获得水稻(Oryzasativa)油体蛋白序列ꎮ利用ClustalW软件进行番茄㊁拟南芥和水稻油体蛋白多序列比对ꎬ使用MEAG-X软件㊁采用最大似然法(maximumlikelihood)构建油体蛋白序列的进化树ꎮ利用番茄果实发育成熟高分辨率时空转录图谱数据库SGN-TEA(https://tea.sgn.cornell.2山东农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第56卷㊀edu/)分析油体蛋白基因在成熟期果实组织的表达模式ꎮ1.3㊀TagRFP和番茄油体蛋白基因的克隆以中国农业科学院蔬菜花卉研究所张金喆老师惠赠的含红色荧光蛋白基因TagRFP编码序列的番茄DNA为模板ꎬ使用引物ZP311ꎬ利用高保真聚合酶预混液ApexHFFLPCRMasterMix(艾科瑞生物)ꎬ对TagRFP进行PCR扩增ꎮ反应程序为:94ħ1minꎻ98ħ10sꎬ60ħ15sꎬ68ħ1minꎬ35个循环ꎮ以CTAB法[17]提取的番茄品种RioGrande幼嫩叶片的基因组DNA为模板ꎬ使用引物Ole002扩增番茄油体蛋白基因SlOLE1(Solyc06g034040)全长序列ꎮ引物序列见表1ꎮPCR产物经1%琼脂糖凝胶电泳检测后ꎬ采用EasyPure®QuickGelExtractionKit(全式金)进行胶回收纯化ꎮTagRFP和SlOLE1的回收产物均与BluntZero克隆载体(全式金)连接ꎬ转化至DH5α感受态细胞ꎬ挑选阳性克隆送至生工生物工程(上海)股份有限公司测序ꎮ表1㊀基因克隆引物引物名称正向引物序列(5'-3')反向引物序列(5'-3')ZP311CCAGCACACTACTATGAGCGAGGTAAGCTCACTTGTGCCCCAGOle002GACGAATGGATTAATGTGGTTCCGCAACTGACTTCATGTCTATA1.4㊀种子SlOLE1-TagRFP红色荧光表达载体的构建根据SlOLE1克隆载体序列和TagRFP编码序列ꎬ采用软件CEDesign设计无缝克隆引物(表2)ꎮ无缝克隆采用ClonExpressⅡOneStepCloningKit(诺唯赞)ꎬ反应条件为37ħ连接30minꎮ以Sl ̄OLE1基因克隆载体为模板ꎬ使用引物Line005进行反向PCRꎻ以TagRFP克隆载体为模板ꎬ使用引物Insert005扩增TagRFP编码序列ꎮ分别对PCR产物进行胶回收纯化ꎬ然后进行无缝克隆ꎬ将TagRFP编码序列插入到SlOLE1基因终止密码子前面ꎬ构建SlOLE1-TagRFP嵌合基因克隆载体Blunt-ORꎬ嵌合基因序列中仅保留1个终止密码子ꎮ使用EcoRⅠ和HindⅢ限制性内切酶对pBI121植物双元表达载体(华越洋)进行双酶切ꎬ以克隆载体Blunt-OR为模板ꎬ使用引物Insert010扩增SlOLE1-TagRFP嵌合基因片段ꎬ胶回收纯化后与pBI121双酶切产物进行无缝克隆ꎬ构建表达载体pSlOLE1-TagRFPꎮ表2㊀无缝克隆引物引物名称正向引物序列(5ᶄ-3ᶄ)反向引物序列(5ᶄ-3ᶄ)Line005GCTAGCGCTACTCTCTACT ̄TCTAGATTTAGTCTGATGGGTTCCAGT ̄GATGTGInsert005tcactggaacccatcagactATGAG-CGAGCTGATTAAGGAGAAaagtagagagtagcgctagcTCACTT ̄GTGCCCCAGTTTGCInsert010gaccatgattacgccaagcttGACGAATG ̄GATTAATGTGGTTCAAaaaacgacggccagtgaattcCG ̄CAACTGACTTCATGTC ̄TATATAAAAG1.5㊀种子SlOLE1-TagRFP红色荧光表达载体的遗传转化利用冻融法将表达载体pSlOLE1-TagRFP转入农杆菌GV3101ꎬ通过农杆菌介导法进行番茄MM子叶的遗传转化ꎮ遗传转化方案参照文献[18]ꎬ将MM的种子消毒后置于1/2MS培养基ꎬ待子叶展开且真叶尚未长出时剪下子叶ꎬ在A1培养基中暗培养2d后进行侵染ꎬ侵染的子叶继续在A1培养基中培养2dꎬ经A2培养基诱导得到愈伤组织和分化的芽ꎬA3培养基分化培养得到小苗ꎬ最后由A4培养基生根培养得到生根小苗后移栽至中国农业科学院蔬菜花卉研究所北圃场玻璃温室ꎮ1.6㊀转基因番茄的PCR检测和种子荧光鉴定提取转基因番茄植株的DNAꎬ根据表达载体中TagRFP两侧序列设计引物O+R-7(F:GGTA ̄AGCGTGTTATCGTGGAꎻR:ATGAAGACGAGCCTCG ̄TAGC)ꎬPCR检测T0代植株中是否插入TagRFP基因序列ꎮ将T0代阳性转基因植株自交授粉收获的干燥种子ꎬ置于徕卡体视荧光显微镜(LeicaMZ10F)下进行荧光成像和拍照ꎮ挑选呈现荧光和无荧光的种子分别催芽ꎬ真叶长出后提取DNAꎬ进一步通过PCR验证番茄转基因后代中是否含有TagRFP基因ꎮ2㊀结果与分析2.1㊀番茄油体蛋白基因分析在SGN数据库中检索到番茄中有9个油体蛋白编码基因ꎬ分别是Solyc02g086490㊁Solyc03g112440㊁Solyc03g119820㊁Solyc06g034040㊁Solyc06g060840㊁Solyc06g069260㊁Solyc08g066040㊁Solyc08g078160和Solyc12g010920ꎮ在NCBI数3㊀第4期㊀㊀㊀㊀㊀㊀㊀㊀㊀章力ꎬ等:利用种子红色荧光标记鉴定转基因番茄后代据库中检索到6个水稻油体蛋白编码基因:Os01g0643900㊁Os03g49190㊁Os04g0546500㊁Os05g0576700㊁Os06g0473800和Os09g0324000ꎮ为了明确番茄㊁拟南芥和水稻油体蛋白之间的亲缘关系ꎬ对番茄9个㊁拟南芥17个和水稻6个的油体蛋白构建分子进化树(图1A)ꎮ在进化树中ꎬ番茄油体蛋白基因Solyc06g034040与拟南芥中的AT4G25140(AtOLE1)和AT5G51210基因以及水稻的Os09g0324000(OsOLE4)和Os04g0546500(OsOLE3)基因亲缘关系最近ꎮAT4G25140(AtOLE1)是拟南芥种子中最丰富的油体蛋白[19]ꎮ利用自身启动子分别驱动AT4G25140(AtOLE1)㊁Os09g0324000(OsOLE4)基因与GFP基因的融合蛋白基因表达ꎬ可使转基因拟南芥和水稻的种子呈现出绿色荧光[20]ꎮ随后检索番茄基因表达数据库SGN-TEA(https://tea.sgn.cornell.edu/)ꎬ发现Solyc03g112440㊁Solyc12g010920和Solyc06g034040基因在红熟期种子中的表达量居前三ꎬRPM值分别为2114.94㊁1719.41和1185.15ꎮ由于Solyc06g034040在番茄红熟期果实的其他组织中几乎不表达(图1B)ꎬ且其编码蛋白与拟南芥AT4G25140(AtOLE1)和水稻Os09g0324000(OsOLE4)蛋白序列相似性最高ꎬ因此ꎬ推测Solyc06g034040基因(以下简称SlOLE1)启动子可以驱动融合蛋白在番茄种子中表达ꎮ图1㊀番茄㊁拟南芥和水稻的油体蛋白进化树(A)及番茄SlOLE1基因在红熟期果实和㊀㊀总果皮的表达模式(B)(基因表达数据来自https://tea.sgn.cornell.edu/)2.2㊀种子红色荧光表达载体pSlOLE1-TagRFP构建以番茄 RioGrande 的DNA为模板ꎬ经引物Ole002扩增得到长度为4004bp的SlOLE1基因全长片段(图2A)ꎬ其中含启动子和终止子序列长度各约1.7kbꎮ利用引物ZP311扩增TagRFP编码区序列(715bpꎬ图2B)ꎮPCR扩增片段分别连入BluntZero克隆载体ꎬ测序后获得序列正确的克隆载体Blunt-SlOLE1和Blunt-TagRFPꎮ将质粒Blunt-SlOLE1通过反向PCR线性化(引物Line005ꎬ表2)ꎬ与质粒Blunt-TagRFP为模板的PCR产物的胶回收纯化产物(引物In ̄sert005ꎬ表2)进行无缝克隆ꎬ成功在SlOLE1基因终止密码子前面插入TagRFP编码区序列ꎬ获得重组质粒Blunt-ORꎮ将pBI121双元载体的EcoRⅠ和HindⅢ双4山东农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第56卷㊀酶切产物ꎬ与质粒Blunt-OR为模板的PCR产物的胶回收纯化产物无缝克隆(引物Insert010ꎬ表2)ꎮ无缝克隆产物转化大肠杆菌DH5αꎬ利用引物ZP311进行菌液PCR鉴定ꎬ以Blunt-TagRFP质粒为阳性对照ꎬ有9份菌液扩增出条带ꎬ大小约为715bpꎬ其中菌液SlOLE1-TagRFP-14的测序结果完全正确ꎬ成功构建种子红色荧光表达载体pSlOLE1-TagRFP(图2C㊁图3)ꎮM:DNA分子量参考ꎻ阳:Blunt-TagRFP质粒阳性对照ꎮ图2㊀SlOLE1基因全长(A)㊁TagRFP编码区片段(B)以及pSlOLE1-TagRFP菌液(C)的PCR扩增图3㊀SlOLE1-TagRFP表达载体示意图2.3㊀SlOLE1-TagRFP转基因阳性番茄植株获得将pSlOLE1-TagRFP质粒转入农杆菌GV3101ꎬ以番茄MM的子叶为外植体进行侵染ꎬ经组织培养共获得45个再生植株ꎮ以转基因植株的DNA为模板ꎬ使用引物O+R-7对TagRFP基因进行PCR检测ꎮ以pSlOLE1-TagRFP质粒为阳性对照ꎬ野生型MM为阴性对照ꎬ水为空白对照ꎬ结果(图4)显示ꎬ有8株T0代番茄植株的扩增产物与野生型MM一致ꎬ为单一条带ꎬ表明没有插入TagRFP基因ꎻ其余37株均扩增出杂合条带ꎬ表明成功插入了TagRFP编码区序列ꎬ遗传转化效率达到82.22%ꎮ图4㊀SlOLE1-TagRFPT0代转基因植株的PCR鉴定2.4㊀转基因番茄后代种子红色荧光观察及PCR鉴定挑选9株生长健壮的SlOLE1-TagRFP阳性转基因番茄幼苗ꎬ移栽至玻璃温室ꎬ振荡自交授粉ꎮ将T0代植株自交种子干燥后置于徕卡体视荧光显微镜下ꎬ以野生型MM的种子为阴性对照ꎬ分别在明场和荧光光源下检测TagRFP信号ꎮ结果(图5)显示ꎬ在明场下ꎬ野生型MM和转基因干燥种子颜色无明显差异ꎻ在荧光下ꎬ野生型种子均无红色荧光ꎬ转基因种子部分呈现明亮红色荧光ꎮ表明TagRFP可以作为一种标记筛选出转基因番茄后代中的红色荧光种子ꎮ5㊀第4期㊀㊀㊀㊀㊀㊀㊀㊀㊀章力ꎬ等:利用种子红色荧光标记鉴定转基因番茄后代图5㊀野生型MM和T0代转基因植株自交种子的TagRFP荧光检测㊀㊀为了验证通过种子红色荧光检测番茄转基因后代的准确性ꎬ进一步播种转基因植株的红色荧光种子和无荧光种子各96粒ꎬ使用引物O+R-7进行PCRꎬ鉴定后代植株是否存在TagRFP序列ꎮ结果表明ꎬ96株红色荧光种子萌发的幼苗扩增产物均为杂合条带ꎬ表明含有TagRFP编码区序列ꎬ而96株无荧光种子萌发的幼苗扩增产物均为单一条带ꎬ表明不含TagRFP编码区序列ꎮ荧光种子和无荧光种子各12粒萌发的幼苗PCR检测结果如图6所示ꎬ表明通过种子红色荧光鉴定番茄转基因后代的准确率达100%ꎮ图6㊀红色荧光(A)和无荧光(B)种子的PCR检测3㊀讨论与结论荧光蛋白有多种类型ꎬ其中ꎬ绿色荧光蛋白(GFP)㊁蓝色荧光蛋白(BFP)㊁青色荧光蛋白(CFP)和黄色荧光蛋白(YFP)等[21-24]的发射波长局限在440~529nm[25]ꎬ在细胞内成像时会激发某些内源物质产生荧光ꎬ对结果造成不同程度的干扰ꎮ本研究所使用的TagRFP的发射波长为584nmꎬ细胞内成像背景低ꎬ更容易检测ꎮ通过PCR分子标记检测发现ꎬ利用TagRFP作为筛选标记ꎬ区分转基因与非转基因种子的准确率可达100%ꎮ此外ꎬ使用荧光蛋白标记筛选转基因种子时ꎬ可利用荧光种子分选设备进一步提高鉴定效率[26-27]ꎮ种子特异性表达启动子驱动荧光蛋白基因ꎬ可用于转基因种子的可视化鉴定ꎮ在拟南芥中使用种子储藏蛋白基因napin启动子驱动荧光蛋白进行表达ꎬ可以在荧光显微镜下识别转基因种子[28]ꎮ拟南芥和水稻油体蛋白基因AtOLE1㊁Os ̄OLE4与GFP的融合蛋白基因表达ꎬ可使转基因种子呈现绿色荧光ꎬ从而实现快速简便鉴定转基因后代[4ꎬ20]ꎮ本研究发现SlOLE1(Solyc06g034040)是拟南芥AtOLE1基因和水稻OsOLE4基因的同源基因ꎬ而且在番茄种子中特异㊁高水平表达ꎮ利用Sl ̄OLE1基因启动子驱动SlOLE1-TagRFP融合蛋白表达ꎬ成功实现了通过种子红色荧光快速简便鉴定转基因番茄后代的目的ꎮ由此推测ꎬ利用植物自身种子特异性启动子驱动油体蛋白与荧光蛋白融合基因的表达ꎬ可以应用于其他含油体蛋白种子植物的转基因后代鉴定ꎮ种子荧光标记系统已经逐步应用于基础研究6山东农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第56卷㊀和育种领域ꎮ基因编辑通常借助稳定的遗传转化ꎬ需要对阳性转基因植株和不含转基因成分的突变后代进行筛选ꎬ工作量大ꎬ费用高ꎮ玉米种子荧光报告系统辅助的CRISPR/Cas基因编辑技术通过胚中的红色荧光标记准确鉴别转基因或非转基因籽粒ꎬ显著提高了基因编辑工作效率[29]ꎮ水稻智能不育育种技术将育性恢复基因㊁花粉失活基因和种子特异启动子驱动的红色荧光蛋白基因串联ꎬ一起导入到水稻雄性不育突变体中ꎬ自交可产生无荧光的雄性不育种子和有荧光的可育种子[30]ꎮ玉米雄性不育制种新技术也可根据红色荧光实现不育系和保持系种子的分选[31]ꎮ利用单倍体诱导系的单倍体育种技术可以加快纯系选育进程ꎬ提高育种效率ꎮ然而单倍体诱导效率一般不高ꎬ鉴别也较为困难ꎮ利用基因编辑技术创制拟南芥㊁玉米和马铃薯等植物的单倍体诱导系ꎬ结合种子荧光标记ꎬ提高了单倍体鉴别效率[32-33]ꎮZhong等[34]报道的番茄单倍体荧光鉴别技术体系中使用的是拟南芥FAST ̄Red标记ꎮ本研究克隆了番茄自身的种子特异性表达基因SlOLE1ꎬ并构建了SlOLE1-TagRFP嵌合基因ꎮ稳定遗传转化SlOLE1-TagRFP嵌合基因的番茄种子在激发光照射下发出明亮的红色荧光ꎬ准确率可达100%ꎮ该种子红色荧光标记筛选体系将有望应用于番茄基因编辑㊁智能雄性不育系创制和单倍体鉴别等领域ꎬ具有一定基础研究和育种应用价值ꎮ参㊀考㊀文㊀献:[1]㊀OrtizJPꎬReggiardoMIꎬRavizziniRAꎬetal.Hygromycinre ̄sistanceasanefficientselectablemarkerforwheatstabletrans ̄formation[J].PlantCellReportsꎬ2015ꎬ15(12):877-881. [2]㊀NakamuraSꎬManoSꎬTanakaYꎬetal.Gatewaybinaryvectorswiththebialaphosresistancegeneꎬbarꎬasaselectionmarkerforplanttransformation[J].BioscienceBiotechnology&Biochem ̄istryꎬ2010ꎬ74(6):1315-1319.[3]㊀ShivaPrakashNꎬBhojarajaRꎬShivbachanSKꎬetal.Marker ̄freetransgeniccornplantproductionthroughco ̄bombardment[J].PlantCellReportsꎬ2009ꎬ28(11):1655-1668. [4]㊀ShimadaTLꎬShimadaTꎬHara ̄NishimuraI.Arapidandnon ̄destructivescreenablemarkerꎬFASTꎬforidentifyingtransformedseedsofArabidopsisthaliana[J].ThePlantJournalꎬ2010ꎬ61(3):519-528.[5]㊀JachGꎬBinotEꎬFringsSꎬetal.UseofredfluorescentproteinfromDiscosomasp.(dsRED)asareporterforplantgeneex ̄pression[J].ThePlantJournalꎬ2001ꎬ28(4):483-491. [6]㊀MizunoHꎬSawanoAꎬEliPꎬetal.RedfluorescentproteinfromDiscosomaasafusiontagandapartnerforfluorescencereso ̄nanceenergytransfer[J].Biochemistryꎬ2001ꎬ40(8):2502-2510.[7]㊀YarbroughDꎬWachterRMꎬKallioKꎬetal.RefinedcrystalstructureofDsRedꎬaredfluorescentproteinfromcoralꎬat2.0 ̄Åresolution[J].ProceedingsoftheNationalAcademyofSci ̄encesoftheUnitedStatesofAmericaꎬ2001ꎬ98(2):462-467. [8]㊀JachGꎬPeschMꎬRichterKꎬetal.AnimprovedmRFP1addsredtobimolecularfluorescencecomplementation[J].NatureMethodsꎬ2006ꎬ3(8):597-600.[9]㊀NishizawaKꎬKitaYꎬKitayamaMꎬetal.Aredfluorescentpro ̄teinꎬDsRed2ꎬasavisualreporterfortransientexpressionandstabletransformationinsoybean[J].PlantCellReportsꎬ2006ꎬ25(12):1355-1361.[10]MatzMVꎬFradkovAFꎬLabasYAꎬetal.FluorescentproteinsfromnonbioluminescentAnthozoaspecies[J].NatureBiotech ̄nologyꎬ1999ꎬ17(10):969-973.[11]MerzlyakEMꎬGoedhartJꎬShcherboDꎬetal.Brightmono ̄mericredfluorescentproteinwithanextendedfluorescencelife ̄time[J].NatureMethodsꎬ2007ꎬ4(7):555-557.[12]RooijenGJHꎬMoloneyMM.Plantseedoil ̄bodiesascarriersforforeignproteins[J].Biotechnologyꎬ1995ꎬ13(1):72-77. [13]HuangAH.Oleosinsandoilbodiesinseedsandotherorgans[J].Plantphysiologyꎬ1996ꎬ110(4):1055-1061.[14]ShimadaTLꎬHayashiMꎬHara ̄NishimuraI.Membranedynam ̄icsandmultiplefunctionsofoilbodiesinseedsandleaves[J].PlantPhysiologyꎬ2018ꎬ176(1):199-207.[15]ChenKꎬYinYTꎬLiuSꎬetal.Genome ̄wideidentificationandfunctionalanalysisofoleosingenesinBrassicanapusL.[J].BMCPlantBiologyꎬ2019ꎬ19:294.[16]YuanYCꎬCaoXZꎬZhangHJꎬetal.Genome ̄wideidentifica ̄tionandanalysisofOleosingenefamilyinfourcottonspeciesanditsinvolvementinoilaccumulationandgermination[J].BMCPlantBiologyꎬ2021ꎬ21(1):569.[17]DoyleJJꎬDoyleJL.ArapidDNAisolationprocedureforsmallquantitiesoffreshleaftissue[J].PhytochemicalBulletinꎬ1987ꎬ19:11-15.[18]杨孟霞.利用基因编辑技术创制番茄雄性不育材料的研究[D].北京:中国农业科学院ꎬ2020.[19]ShimadaTLꎬShimadaTꎬTakahashiHꎬetal.AnovelroleforoleosinsinfreezingtoleranceofoilseedsinArabidopsisthaliana[J].ThePlantJournalꎬ2008ꎬ55(5):798-809.[20]ShimadaTꎬOgawaYꎬShimadaTꎬetal.Anon ̄destructivescreenablemarkerꎬOsFASTꎬforidentifyingtransgenicriceseeds[J].PlantSignaling&Behaviorꎬ2011ꎬ6(10):1454-1456.[21]TsienRY.Thegreenfluorescentprotein[J].AnnualReviewof7㊀第4期㊀㊀㊀㊀㊀㊀㊀㊀㊀章力ꎬ等:利用种子红色荧光标记鉴定转基因番茄后代Biochemistryꎬ1998ꎬ67:509-544.[22]PattersonGHꎬDayRNꎬPistonDJ.Fluorescentproteinspectra[J].JournalofCellScienceꎬ2001ꎬ114(5):837-838. [23]RizzoMAꎬSpringerGHꎬGranadaBꎬetal.AnimprovedcyanfluorescentproteinvariantusefulforFRET[J].NatureBiotech ̄nologyꎬ2004ꎬ22(4):445-449.[24]GriesbeckOꎬBairdGSꎬCampbellREꎬetal.Reducingtheen ̄vironmentalsensitivityofyellowfluorescentproteinmechanismandapplications[J].JournalofBiologicalChemistryꎬ2001ꎬ276(31):29188-29194.[25]樊晋宇ꎬ崔宗强ꎬ张先恩.红色荧光蛋白的光谱多样性及体外分子进化[J].生物化学与生物物理进展ꎬ2008ꎬ35(10):1112-1120.[26]中国科学院长春光学精密机械与物理研究所.一种用于荧光种子分选的光学装置:CN115144330A[P].2021-03-30. [27]中国科学院长春光学精密机械与物理研究所.荧光种子分选装置:CN214718482U[P].2021-11-16.[28]StuitjeARꎬVerbreeECꎬvanderLindenKHꎬetal.Seed ̄ex ̄pressedfluorescentproteinsasversatiletoolsforeasy(co)transformationandhigh ̄throughputfunctionalgenomicsinAra ̄bidopsis[J].PlantBiotechnologyJournalꎬ2003ꎬ1(4):301-309.[29]YanYYꎬZhuJJꎬQiXTꎬetal.Establishmentofanefficientseedfluorescencereporter ̄assistedCRISPR/Cas9geneeditinginmaize[J].JournalofIntegrativePlantBiologyꎬ2021ꎬ63(9):1671-1680.[30]ChangZYꎬChenZFꎬWangNꎬetal.Constructionofamalesterilitysystemforhybridricebreedingandseedproductionu ̄singanuclearmalesterilitygene[J].ProceedingsoftheNa ̄tionalAcademyofSciencesoftheUnitedStatesofAmericaꎬ2016ꎬ113(49):14145-14150.[31]CaiDRꎬZhangZGꎬZhaoLꎬetal.Anovelhybridseedproduc ̄tiontechnologybasedonaunilateralcross ̄incompatibilitygeneinmaize[J].ScienceChinaLifeSciencesꎬ2023ꎬ66(3):595-601.[32]ZhongYꎬChenBJꎬLiMRꎬetal.ADMP ̄triggeredinvivomaternalhaploidinductionsysteminthedicotyledonousArabi ̄dopsis[J].NaturePlantsꎬ2020ꎬ6(5):466-472.[33]ZhangJZꎬYinJꎬLuoJYꎬetal.Constructionofhomozygousdip ̄loidpotatothroughmaternalhaploidinduction[J].aBIOTECHꎬ2022ꎬ3(3):163-168.[34]ZhongYꎬChenBJꎬWangDꎬetal.Invivomaternalhaploidin ̄ductionintomato[J].PlantBiotechnologyJournalꎬ2022ꎬ20(2):250-252.8山东农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第56卷㊀。
转基因西红柿辨别
导读:我根据大家的需要整理了一份关于《转基因西红柿辨别》的内容,具体内容:最近看到法国科学家实验证明转基因玉米诱发肿瘤。
被做实验的小白鼠身上长出来大大的肿瘤和痛苦的样子,实在感到恐怖。
所以我特意整理出一些,帮助大家怎样识别常见的转基因食品,以下是的方法介绍。
...
最近看到法国科学家实验证明转基因玉米诱发肿瘤。
被做实验的小白鼠身上长出来大大的肿瘤和痛苦的样子,实在感到恐怖。
所以我特意整理出一些,帮助大家怎样识别常见的转基因食品,以下是的方法介绍。
方法如下:
1.看形状。
一般的西红柿形状有椭圆的,和圆形的。
仅仅只是从外形上不一定准确,但是外形还是可以作为我们辨别的方法,正常情况下,椭圆形的西红柿是转基因西红柿的概率高,而圆形的西红柿就不一定了,可能是,可能不是。
2.轻轻地捏。
一般情况下,当你用手轻轻捏西红柿时,如果是转基因的西红柿,捏起来会有点硬,若不是会有点软。
这个需要一定的手感,一般人可能拿捏不准。
不过记住了,拿捏的西红柿都要是成熟的。
3.尝味道。
这个一般吃西红柿比较多的人会有这种体会。
对于成熟的西红柿,我们在吃的时候,如果不是转基因西红柿,或多或少都会有一点点酸味。
若是转基因的西红柿,吃起来的时候,酸味很难感受出来,反而有一点点甜味。
4.贮存。
依照转基因西红柿出现的条件,理论上是要比正常的西红柿要耐储存。
不过现代生活中,冰箱已经很普及了,这一点就显得不是很重要了。
以上方法靠谱吗?
由于转基因食物在我们生活中大量的存在,紧紧只是依靠形状,味道,贮存等,根本就不能正确判断是否是为转基因食品。
因此,只有专门的检验机构和实验才可以确定。
所以,这里提醒大家,在选购时,如果不确定的话,宁愿不吃,也不要去买。
毕竟转基因这种争议性很大的食品,还是选择多关注这方面的科普和专业网站。
转基因食品的危害
未知毒素
转基因的种子和食品可能含有未知毒素和在人体内从未发现过的过敏原。
1989年生产的左旋色氨酸添加剂就是一个很好的例子。
这种添加剂导致了37人的死亡,并对1500多人的健康产生危害。
添加剂中的细菌经过了基因重组,使得添加剂中产生了一种新型的有毒氨基酸。
负作用的风险
转基因食品的危险还在于其会带来一种从未出现过的负作用。
这种负作用可能存在于两种不同的转基因食品之间,或者存在于食品基因与某些药物之间。
由于转基因农作物出现的时间并不长以及新品种不断涌现,这种负作用尚未得到充分的证据证明。
对人类基因的未知影响
我们还不知道转基因食品是否会对人类基因产生影响,起初,科学家和
研究人员认为,消化过程会破坏重组基因,但最近他们在一些幼鼠的大脑中发现了这些重组基因。
这对婴幼儿来说,危害极大,并给所有食用者带来未知的风险。