动物组织石蜡切片制作
- 格式:ppt
- 大小:69.00 KB
- 文档页数:16

石蜡切片免疫组织化学操作流程一、组织获取(本实验室多做脑组织,所以以脑组织为例)1.动物麻醉:所用麻醉药物(水合氯醛水溶剂)剂量为350mg/kg动物体重,常用麻醉药物浓度为5%、6%、7%、10%(麻醉浓度越大,动物进入麻醉时间越短,但麻醉致死率相应较高,本人使用7%浓度,若注射位置正确,约3min进入麻醉状态);动物麻醉后,将其固定于灌流操作平台,仰卧位;2.动物灌流手术:以胸骨剑突为起点,沿左右两侧肋下缘剪开老鼠皮肤至腋下,再次以剑突为起点,剪开皮下肌肉层,沿同样方向剪开肌肉至腋下,避免伤到内部脏器,剪破膈膜,沿左右两侧剪断胸骨,用止血钳夹住剑突向上翻转,充分暴露心脏;用弯镊分离心脏表面黏膜;左手持止血钳轻夹起心脏,倾斜一定角度,使心尖方向与升主动脉尽量位于同一直线上,右手持灌流针,沿直线所在所在角度由左心室进针,将灌流针直接插入升主动脉(可挑动灌流针于升主动脉内观察是否正确插入,此方法操作不熟练易插错血管或是直接刺穿心脏——或者直接将灌流针插入左心室,但前方法灌流效率较高);固定器械(器械松动或是位置变化会严重影响灌流质量,有时会因为器械位置的变动直接将心脏牵扯下来导致灌流失败,应给与充分注意)3.动物灌流:C57小鼠25-30g左右,灌流开始,可见右心耳充盈,用剪刀剪开,便于血液流出:吊瓶灌流——以生理盐水50-100ml快速冲洗血液,持续最好不要超过5min(时间过长会导致脑组织降解),待无明显血迹流出后换用4%多聚甲醛进行灌流,约100-150ml,灌流速度不宜过快,约10min,固定液较充分的固定组织;注射器灌流——生理盐水50ml快速推注,后换用4%多聚甲醛50ml缓慢推注。
灌流成功的标志——灌流开始,可见肝脏颜色迅速变浅,随着灌流进行,肝脏颜色逐渐变为乳黄色或是白色;换用4%多甲固定液后小鼠全身痉挛抽搐,组织僵硬。
4.开颅取脑:根据实验取材位置的不同,分为不同的取脑方式:应注意需要的组织区域,避免取脑过程中损坏,多从小脑后方依次向前剥离颅骨,获取脑组织(在颅骨剥开后,应注意脑膜的存在,因为会发生脑膜将皮层割裂损伤的情况)5.脑组织修块:将多余脑组织去除,便于固定充分均匀,应留出试刀或找平的部分多余组织(本人实验中因需要海马组织,故修块时沿大脑皮层后边缘切除多余小脑,人字缝前约2.5-3mm切除前脑部分)6.固定过夜:将修块完成的脑组织,浸泡于4%多聚甲醛中,固定过夜,通常不要超过18小时(固定时间越长,组织抗原损失越严重,呈数量级损失),一般控制在12小时以内为宜二、组织石蜡包埋7.组织梯度脱水透明:将过夜固定的脑组织取出置于包埋窗内,并用铅笔做好相应标记,自来水流水冲洗约10min,去除残留的杂质成分,进行梯度酒精脱水(注意:不同的组织类型,同组织类型不同组织块大小所需的每阶段脱水时间不同,需根据自身需要进行简单摸索;若盲目脱水透明,脱水透明过头,会使组织脆性增加,切片时全为粉末状,无法成形;脱水透明不够,会使组织与蜡块分离,无法获取平整组织切片)本实验中,组织样本为脑组织,组织修块后所进行的脱水流程如下:自来水冲洗完成→50%乙醇 25min→70%乙醇 25min→80%乙醇 25min→90%乙醇 25min →95%乙醇I 10min→95%乙醇II 15min→无水乙醇I 10min→无水乙醇II 15min→二甲苯I 15min→二甲苯II 15min8.组织浸蜡:在进行二甲苯透明开始的时候,将石蜡用沸水融化,置于60度烘箱内备用(此过程中应注意将盛放石蜡的烧杯上口封闭,避免水分溅入;根据组织块的数目准备合适体积的石蜡液体,以组织块完全浸没其中为宜);将透明完成的组织块,尽量沥干多余二甲苯,迅速转入1号烧杯的石蜡液体内(避免包埋窗内产生气泡,气泡若围绕组织块会影响浸蜡过程),依次将所有组织块迅速转入其中,要求组织块要全部浸没在石蜡中,流程如下:1号石蜡2h→2号石蜡2h→3号石蜡2h在每个阶段的浸蜡过程中,可根据时间安排适量的延长浸蜡时间,但尽量不要减少时间9.组织块包埋:包埋前,准备沸水备用;清理干净包埋槽备用;包埋开始时,将装有组织块的烧杯浸入沸水中,防止在包埋过程中,烧杯中的石蜡凝固,具体操作如下:1)用镊子夹取包埋槽在酒精灯预温,控制包埋槽的温度不要过高;2)将烧杯内的石蜡倒入包埋槽内,液面高度刚好没过包埋槽两侧平台3)取出浸泡的组织块,用小镊子过火后夹取组织块放置在包埋槽的凹陷处中心部位,根据切片要求摆放位置,注意在放置过程中避免组织块下面接触包埋槽底部的位置产生气泡,通常在放置前,可将组织块浸没在凹槽内的石蜡中翻滚,使其各面均匀接触石蜡液体,然后放置在正确的位置(此时假如包埋槽预温过高,则会导致组织块在接触槽底面后异常干燥,在整个蜡块凝固后会在干燥处出现凹洞,不利于石蜡块的长期保存);4)将包埋窗轻轻放置在包埋槽的平台上面,尽量保证两侧高度相同,此时槽内之前的石蜡会浸没部分包埋窗的格栏,静置1-2min(避免倒入热的液体石蜡后,石蜡从包埋窗的边缘流出);5)静置后,石蜡表面会出现凝固表层,此时再用烧杯中的石蜡填充包埋窗的凹陷处以及靠近边缘的条状凹洞,液面稍高于包埋窗边缘(靠近边缘的条状凹洞一定注意填充石蜡,关乎整个蜡块凝固后与包埋窗结合的紧密程度;石蜡凝固后体积会缩小,避免因液面过低导致的后期包埋窗内部支撑不够)6)静置至少30min,可将包埋后的蜡块从包埋槽内分离(注意分离时,应先清理包埋槽四周的多余石蜡,露出包埋窗与包埋槽接触的边缘,然后从一个角将蜡块撬离包埋槽)三、石蜡切片10.准备工作:蜡块的修整——将组织周边的石蜡在保留操作位置的情况下尽量去除(1-减少石蜡块切面与刀片的接触面积,便于受力均匀,易切出完整切片;2-石蜡切面与刀片接触面积小,会减少刀片接触到蜡块中坚硬杂质的几率,增加刀片的使用寿命;3-接触长度减少,可增加刀片使用次数,通常情况下至少多使用1次)准备器材:40度恒温水浴(温度控制在40-42之间的恒温状态,此温度可使蜡片较长时间保持切片形态,温度较低切片不易展开,温度较高,切片会在短时间内融化,易造成组织变形)切片刀片、包被载玻片、弯镊、毛刷、铅笔、切片盒冰盒(通常情况不需要,在组织脱水透明严重,切片呈粉末状态时,可用冰块冰敷石蜡切面,在短时间内可改善切片表面状态,能够帮助切出3-5片完整切片,只有在前期处理出问题时才使用进行一定程度挽救)切片大致流程:1)安装刀片;将蜡块固定于切片机上,调整蜡块表面与刀片距离,矫正蜡块表面与刀片切线平行;2)调整切片模式为trim-10um进行表面找平,并观察切片状态,调整蜡块角度,使切片左右对称,同时注意观察目标区域出现位置;3)切片调平,并出现合适目标区域,调整切片模式为sect-5um进行切片,获取所需组织切片样本;4)将完整合适的切片,夹取至水浴锅内摊平,左手持载玻片,右手持弯镊辅助,将切片贴于载玻片中,放置在水浴锅边缘进行干燥并做好相应标记;5)将干燥完成切片,按照样本分类放置在一起收于切片盒中备用6)切片完成,清理清片机;剩余组织蜡块,需要在切面表面均匀涂抹融化的石蜡,避免组织块直接与空气接触(不进行封闭,会使组织块在长期的暴露过程中,含水量发生变化,易于与支撑蜡块分离,造成后续再次切片困难)7)切片盒中切片,干燥后可在室温下长期放置,推荐切片完成后及时进行后期组织染色或组织免疫化学孵育。

常规组织病理技术切片技术是病理检验技术的重要组成部分。
在实验室内的病理检查工作中,不仅要观察大体标本的病理变化,更重要的还要观察组织标本的病理变化,才能作出最后诊断。
大体标本的病理变化是用肉眼观察,而组织标本必须借助显微镜进行观察。
组织标本的质量将直接影响镜检观察,也就是影响到诊断和研究。
学习和从事切片技术工作,首先应当认识这一工作的重要性,提高责任感。
切片技术随着生物学和医学的发展而发展,随着光学仪器和切片机的日益精密而不断改进。
下面仅就目前兽医实验室最常用的石蜡切片的制作技术做一系统的介绍。
(一)石蜡切片制作方法和程序任何组织制成一张菲薄的切片标本需要经过一系列的处理过程,而每一过程的步骤和手续严密而复杂。
现将制作石蜡切片的主要程序介绍如下。
制作石蜡切片的主要程序:取材;固定;脱水;透明;浸蜡;包埋;切片;染色;封固。
1.取材病理组织大多数采自动物尸体剖检材料或活体检查组织,取材的种类、数量取决于诊断和研究的目的,病理组织要越新鲜越好,因此标本取材后要及时切成小块,进行固定。
取材时必须注意:⑴接受病理组织材料时,必须依据送检单详细检查送检物。
自己采的病料也要求及时填写送检单。
检查时注意标本名称、数量与送检单是否相符,并查明送检单位地址以及有无临床及化验等有关资料。
如果发现送检标本不符,标本固定不当以及标本发生腐败等而不能制作切片时,应立即退回;若检查无误,应将标本及时登记、编号。
⑵组织切块需用锐刀或剪,切忌对组织材料挤压,揉搓及扭折等损伤,以保持组织完整及生活时状态。
⑶切块要选择病变显著部位及可疑病灶。
切取组织块要包括病灶及其周围健康部分,重要病变可多取几块,以反映病变各阶段、各部分的形态变化。
采取组织应包括各该器官的各组成部分,如肾脏应包括被膜、肾皮质部、肾髓质部、肾乳头及肾盂。
⑷组织块不宜过大,通常长1厘米,宽为1.5厘米,厚度为0.3厘米,最宽可达1.5~3厘米,但厚度不超过0.5厘米为宜。

常用标本制备技术一、常用光镜标本制备技术1.切片标本的制备:常用的切片方法为石蜡切片,其制备程序如下:⑴取材从动物身体割取所需的新鲜组织一小块(厚度约0.5厘米)。
手术愈快愈好,以防组织的死后变化。
⑵固定把切取的小块组织,迅速投入预先配好的固定液[如10%福尔马林、0.5%锇酸、包氏液、岑克氏液、卡氏等固定液]中固定,使组织细胞的蛋白质变性,组织块硬化,以保存组织细胞原有的形态。
⑶冲洗(洗涤)组织块自固定液取出后,须经流水冲洗或乙醇洗涤,使组织中含有的固定液全部除去,直至洗净为止。
⑷脱水脱水的目的在于除去组织中的水分。
因为组织中的水分和石蜡是不相溶的,为不使组织块在脱水时产生收缩,所以一定要经过各级浓度的脱水剂(如乙醇等)将水分脱净。
⑸透明组织块脱水后,须经既可和乙醇相混,亦可作石蜡溶剂的透明剂(如二甲苯)透明,使组织中的乙醇被透明剂所替代,才能浸蜡包埋。
⑹浸蜡浸蜡是将包埋剂(石蜡)透入整个组织的过程。
石蜡透入组织需要一定的温度(石蜡熔点)。
所以浸蜡都在恒温箱中进行。
⑺包埋制备一定形状的容器(如纸盒等),倒入熔化的石蜡,迅速夹取浸透石蜡的组织块放入盒内,待表面石蜡凝固后立即将容器投入水中,使它凝固成蜡块。
⑻切片组织块经上述处理后,不仅变硬,且有石蜡支撑,可用切片机将包埋组织的蜡块切成薄片,一般厚度是5~8微米。
⑼贴片把由切片机切下的蜡条,分割成小段,分别排放于滴有蒸馏水的载玻片上,在展片台上微热,使皱褶的蜡片伸展平正。
⑽烘片把贴有蜡片的载玻片置于45℃恒温箱中,烘烤3~4小时,使切片干燥。
⑾脱蜡与复水组织切片的脱蜡等过程是在染色缸中进行的,因此须预先准备洁净的染色缸,并分别放入二甲苯、各级浓度的乙醇及染料溶液,按顺序贴好标签。
染色前须先进行脱蜡和复水,即用二甲苯溶去切片上的石蜡后再经各级浓度乙醇(自高浓度到低浓度)下行到水的过程。
因为没有经过复水处理的切片不能用水溶性染料染色,所以在染色前必须再度复水。

石蜡切片基本步骤(一)取材和固定根据实验目的选择材料。
将整个虫体或虫体的内部器官(如肠道、马氏管、唾液腺等)取出后,立即投入固定液。
取材大小:0.5cm×0.5 cm×0.2或者1.0 cm×1.0 cm×0.2,厚度不宜超过3mm。
固定液:2.5%的戊二醛固定液,Bouin氏液,10%甲醛等。
固定时间:4ºC固定24小时。
注意事项:取材:1.勿使组织块受挤压切取组织块所用刀、剪要锋利,切割时不可来回切割。
夹取组织时,镊子要轻,切勿挤压,以免损伤组织。
取材时,组织块可稍大一点,以便在固定后,将组织块的不平整部分修去。
2.选好组织块的切面应熟悉器官组织的组成,并根据观察目的来确定纵切或横切。
3.保持材料的清洁组织块上如有血液、污物、粘液、食物等,先用生理盐水冲洗干净,再入固定液。
4.切除(清除)不需要的部分特别是组织周围的脂肪等,应尽可能清除掉,以免影响以后的程序和观察。
固定:1.材料新鲜取出组织后须立即固定。
否则时间相隔过久,体积就要收缩变形或发生自溶现象。
2.抽气生物组织常有气体的存在,使材料不能沉入固定液中,抽气使得固定液有效渗入。
真空泵抽气或者用空针管抽气。
昆虫整体固定,固定前用解剖针刺数个小孔,以利用固定液渗透。
3.固定剂用量一般为组织体积的10~20倍。
勿使组织贴于瓶底或瓶壁,以免影响固定剂的渗入。
4.避免阳光尽可能避免接触阳光以免失去固定作用。
5.加速固定轻轻摇动盛器使组织移动有利于固定液渗入,对长期固定的标本可经常更换固定液。
(二)洗涤2.5%戊二醛固定液固定的组织:0.2M, pH7.2磷酸缓冲液漂洗三次,每次10minBouin氏固定液固定的组织:直接入70%酒精更换数次即可脱水,注意苦味酸。
甲醛固定的组织:直接投入50%或70%酒精脱水,不经水洗。
但如果在甲醛中时间过长,则仍应当用流水冲洗。
陈旧性标本和混合性固定液应及时洗涤,有利于脱水、切片和染色。
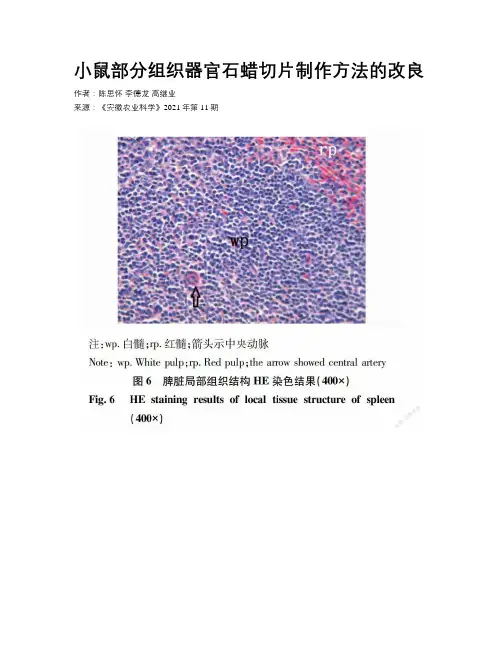
小鼠部分组织器官石蜡切片制作方法的改良作者:陈思怀李德龙高继业来源:《安徽农业科学》2021年第11期摘要為了克服小鼠组织器官传统石蜡切片制作方法存在组织易碎、结构不完整的缺点,对传统石蜡切片制作进行了改良。
将浸蜡前的透明步骤改为异硬脂醇与石蜡混合液处理,替代苯类透明剂制作空肠、脾脏2种器官的石蜡切片,并以切片机切片时蜡带质量和HE染色后镜下质量为切片制作效果的评定指标。
结果表明,2种器官在切片机上均能切出完整、较长的蜡带,组织块无硬化、不碎裂,展片平整;HE染色过程中不掉片,染色后光镜下细胞质与细胞核染色对比清晰,器官组织结构完整。
就脾脏和空肠而言,应用异硬脂醇与石蜡混合液替代苯类透明剂能制作出优良的石蜡切片。
关键词石蜡切片;异硬脂醇;透明剂;小鼠中图分类号 R-361.2 文献标识码 A文章编号 0517-6611(2021)11-0094-02doi:10.3969/j.issn.0517-6611.2021.11.025开放科学(资源服务)标识码(OSID):Improvement of Preparation Method of Paraffin Sections of Some Tissues and Organs in MiceCHEN Si-huai,LI De-long,GAO Ji-ye(College of Veterinary Medicine,Southwest University, Chongqing 402460)Abstract In order to overcome the defects of fragile tissue and incomplete structure in the traditional paraffin section preparation method of mice tissues and organs, the traditional preparation method of paraffin section was improved.Paraffin sections about jejunum and spleen were made with the mixed solution of isostearin and paraffin instead of benzene transparent agents.The quality of ribbon and microscopic observation after HE staining were selected as judgment indices .The results showed that two kinds of representative organs could be cut into long and complete wax bandes on the microtome, and flatten out with no hardening or non-fragmentation.After HE staining, the cytoplasm and nucleus were stained clearly, and the structures of organs and tissues were intact.As for jejunum and spleen,the mixture of isostearic alcohol and paraffin could be used to treat the tissues instead of benzene transparent agents to make good paraffin sections.Key words Paraffin section;Isostearic alcohol;Transparent agent;Mice小鼠作为实验动物,其组织器官在大小、质地等方面不同于成年畜禽,如小肠壁薄、肝细胞脂类丰富、脾脏小等。




介绍大鼠各组织器官石蜡切片制作法山西省中医院(030012)高宝红在科研工作中,实验标本多为动物模型,如大鼠、小鼠及兔等。
大小鼠及兔的组织脏器较人体组织脏器稚嫩柔软,水分含量多。
因此在制作组织切片的过程中,必须根据其组织结构特点,采用不同于人体组织的处理方法,注意各种动物组织在固定、脱水、透明浸蜡、包埋、切片的每个程序中选择最佳的时间方案,才能避免组织块变脆,切片易碎、有裂隙,染色时易脱片等常见不良后果的发生,保证高质量石蜡切片一次成功。
本研究就如何制作优质的大鼠各组织器官石蜡切片作了总结,现从固定、取材、脱水、透明、浸蜡、包埋到切片、烤片、脱蜡、染色的经验介绍如下。
1如何制作优质大鼠各器官石蜡切片1.1标本:大鼠各个脏器———心、肝、脾、肺、肾、大脑、脊髓、胃肠、垂体、胸腺、淋巴结、肾上腺、卵巢、睾丸、子宫、膀胱、附睾。
1.2固定液:中性甲醛溶液,固定时间为24h。
1.3取材:心脏:最大纵断面取1块,厚度为2mm;肝脏:右叶纵断面取1块,厚度为2mm;脾脏:纵断面取1块,厚度为2mm;肺脏:纵断面取1块,厚度为2mm;肾脏:最大面剖开取一半,包括皮质、髓质和肾盂;大脑:最大面剖开取一半;脊髓:横断面剖开取1块,厚度2~3mm;胃:沿大弯侧剪开,纵切一长条,长1cm,宽2mm;肠:横断面切取一段,约2mm;垂体:全包;胸腺:全包;淋巴结:全包;肾上腺:全包;卵巢:全包;子宫:横断面剖开取一段,厚度2mm;睾丸:最大面剖开,取半;附睾:纵断面剖开取半;膀胱:剖开取半。
1.4各个脏器的脱水透明浸蜡时间:见第1024页表1。
1.5包埋:胃肠、子宫、膀胱立埋,其余脏器平埋,蜡温为65~ 70℃。
1.6切片:厚度4μm,摊片水温56℃左右,选取无皱折的4片。
2动物组织石蜡切片苏木素-伊红(HE)染色切片置70℃的烤箱中30min入二甲苯脱蜡20min;入梯度乙醇100%→95%→85%→75%,自来水冲洗2min;入苏木精30min,取出自来水冲洗2min;入盐酸乙醇分化5s,自来水冲洗2min;入伊红5 s,自来水冲洗2min;入梯度乙醇75%→85%→95%Ⅰ→95%Ⅱ→100%→100%;入二甲苯Ⅰ→二甲苯Ⅱ;中性树胶封片。

小鼠部分组织的石蜡切片制作一、实验原理:利用脱水剂除去组织中的水分,再用透明剂二甲苯可以去除脱水剂酒精,而二甲苯可以溶解石蜡并将其导入到已脱水的组织细胞中,然后用熔化的石蜡对组织进行包埋,冷却后即可将柔软的组织包埋在石蜡中,使其具有一定硬度,且不改变其大小和形状。
用旋转切片机可将其切为极薄的薄片,经染色、脱水、装片后在显微镜下可以清晰地观察其组织结构。
二、材料与用具1.材料:小鼠肝脏、脾脏等。
2.用具:溶蜡箱、蜡杯、不同熔点的石蜡、酒精灯等。
三、实验内容与步骤1.取材及固定取小鼠,采用拉颈处死或麻醉处死法将其杀死,取其脾脏和肝脏,切为边长约为0.5cm的组织块。
用先用0.85%的生理盐水漂洗以洗去血液与污渍,如果是管状组织则必须把管腔中污物洗净,可用注射器自一端向管腔中注射生理盐水数次,使其管腔冲洗干净,切忌不可用刀或其他器具刮之。
由动物身上切取的组织必须是新鲜的,材料越新鲜越好,一般不应超过死后24 hr。
如果是管状器官或是其中有分泌之消化液,则死后应迅速采取,以免组织自溶或上皮剥落。
取下的材料马上进行固定,采用FAA固定液,固定液的用量与组织块体积之比一般在20:1,固定时间2 hr以上,超过24hr时可继续浸泡或转入70%酒精中保存。
不应使组织块贴于容器壁上,应记录固定液的名称,材料的种类,动物品种及开始固定的时间。
2.冲洗固定后的组织块在进行脱水前用70%酒精洗去固定液。
3.脱水和硬化经过固定后的组织在水洗后要进行脱水,脱水的目的将组织内的水分用酒精或其他溶剂置换出来,使组织逐渐变硬,便于油类或其他透明及浸入,为熔化的石蜡浸渗到组织中创造条件。
常用的脱水剂是不同浓度的酒精,因为酒精与水有很大的亲和力,酒精浓度可以逐渐升高,置换出组织中的水。
脱水必须充分,脱水不充分会影响透明和浸蜡。
脱水过程要逐级上升,不能操之过急,跳级脱水会引起组织块强烈的收缩变形。
脱水所用的酒精浓度及过程如下:30%—→50%—→70%—→80%—→90%—→95%—→100%(Ⅰ)—→100%(Ⅱ)组织块在各级较低浓酒精(小于70%)中脱水的时间应视组织块的大小而定,大小不超过0.5立方厘米的组织块脱水时间为6~12 hr,在高浓度酒精中(大于70%)脱水时间为3 hr 左右。

石蜡切片、HE、免疫组化实验一:取材及石蜡切片的制作(本次取材为小肠、膀胱、子宫、宫颈)①取材:小鼠脱颈处死后,应立即找到自己所需的组织器官,用一张滤纸将所需器官放在其上(可以加一些生理盐水在上面,防止干了),修去多余的脂肪、系膜等不要的组织,根据不同器官切成合适大小的形状(如小肠应切成1cm长度的长柱形)。
将切好的组织装于冻存管中,加入4%的PFA(PFA的作用是保护蛋白,防止蛋白降解)固定过夜(固定时间不能超过24h,如果24h后不能完成脱水工作,可以先50%、70%酒精脱水后,置于4℃冰箱保存。
)②脱水(目的是为了使组织从水相置换到有机相)(根据不同的组织,脱水时间不同):将PFA中的组织取出,放入组织盒(组织盒子应尽量选择小格子,防止组织脱水过程中掉出来),一个组织盒可以放4~8个组织小块,切一张与格子大小合适的纸条一并装入,做好标签,防止后期辨认不出具体组织(只能用铅笔写,中性笔会被酒精脱去)。
使用自动脱水机进行脱水,设定程序为:酒精50%、70%、80%、90%(各20min)、无水乙醇(30min/次,两次)、酒精二甲苯混合物(1:1)20min、二甲苯20min(两次)、二甲苯石蜡混合物(1:1)30min、石蜡Ⅰ1h;脱水结束后,取出组织盒,置于石蜡Ⅱ中1h(石蜡应提前融化,且不能凝固,放在70℃烘箱中)。
③包埋:用4X6cm的小纸条根据小木块形状,叠成盒子(盒子最好四边叠平,不要左右不平,便于放融化的蜡进去后能得到比较好的形状,最好不要漏),取一个盒子,将融化的石蜡Ⅱ倒入,在其快要凝固的时候,将组织按照所需的形状,摆正(如小肠切成的小柱子应立起来,便于后面切片的时候,可以切到所需的形状),再用做好标记的长纸条贴着盒子壁固定(为了包埋后识别组织,且不能将纸条放在蜡块中央,后期不好取出,会损坏刀片),倒蜡之前,可以将盒子放在铁皮或小铁块上(能够让石蜡更快凝固。
),每次用镊子拿组织或摆正组织之前,先烧一下(能够更好摆正组织块,可以随时调整组织位置)。
高校生物学教学研究(电子版)2019年2月,9(1):3-4ISSN 2095-1574 CN 11-9307/R DOI 10.3868/j.issn 2095-1574.2019.01.001专题[编者按]在信息技术与教育教学深度融合的背景下,“微课”作为一种重要的在线学习资源已被广泛应用于教学实践与教学改革中。
为进一步促进高校生命科学类课程教师的教学理念更新和教学能力提升,本刊将陆续刊登各高校微课教学优秀作品及其教学设计方案,以供各高校教师相互交流与借鉴。
“动物组织的石蜡切片制作及HE 染色”微课教案李玉明(),谢莉萍,王洪钟,王宏英,张贵友清华大学生命科学学院,北京,100084基金项目:清华大学校级教改项目支持(ZY01_03)通讯作者:李玉明,E -mail:ym -li@生物学是一门实验性很强的学科,各领域的实验技术自成体系、操作性强。
作为从事生物实验教学多年的工作者,深感近年兴起的微课对生物学实验教学颇有益处。
传统的生物学实验教学模式通常以教师的语言、文字描述为主,虽然直面学生,但对技术细节的展示不够直观。
因此作为补充,常会设置演示实验环节,由教师或助教示范,学生观摩,但因操作者的习惯不同,使得演示过程缺乏规范性,并且如果一个班的学生人数多于20人,示范的效果便更不理想。
以微课的形式呈现一项生物实验技术的好处在于:①通过图片、动画、声音、视频等媒介传递知识,可以紧紧抓住学生的注意力,激发学生的学习兴趣,传递更为丰富的信息。
②通过字幕、旁白、整体与细部操作的逐层深入,可以准确呈现实验技术的流程与要点。
③减少授课者的重复劳动,以便将更多精力投入到教学研究之中。
④有效实现教育资源共享,一门优秀的微课可以被广泛传播,使更多的学习者获益。
教学背景本文介绍的“动物组织的石蜡切片制作及HE 染色”技术对于从事细胞生物学、发育生物学、临床医学等学科的教学、科研人员而言是一项常用的实验技术,也是生物学专业本科生需要理解和掌握的一项实验技能。
石蜡切片切片法:切片法是将材料处理后用切片机将标本切成薄片好后封藏观察切片法:❖切片法的种类:石蜡切片技术冷冻切片技术半薄切片技术❖切片法制片的过程:取材(动物或植物)——固定——洗涤——染色(整体染色)——脱水(梯度酒精)——透明——浸蜡透入(包埋剂)——包埋——切片(黏附切片与载玻片上)——脱蜡——复水——染色与复染——脱水——透明——封藏石蜡切片的主要过程:杀生(取材)——固定——冲洗——脱水——保存——透明——石蜡透入——包埋——切片——复水——染色——脱水——封藏——观察保存(一)取材杀生(动物)• 1.目的:动物有时需要杀生,然后取出所需组织• 2.方法:一般采用乙醚(氯仿)麻醉后解剖,取出所需组织。
• 3.注意事项:–尤其细胞学方面的研究,对于材料的新鲜的程度要求十分严格。
尽量割取活的动物组织快。
–性别合适;–麻醉前动物生活正常,以免影响其代谢活动,进而影响细胞结构;–取材部位要准;–速度快。
取材:1.目的:得到所需要的组织2.方法:a.用剪刀剪下组织b.冲洗动物组织,动物(生理盐水、糜蛋白酶溶液)植物(缓冲液或水)冲洗干净,防止失水,避免压挤损伤,用生理盐水、糜蛋白酶冲去表面的血、粘液和赃物。
c.切成小块3注意事项:»要准»要快»避免损伤(方向,刀要快,不能挤压)❖植物取材:用剪刀剪下材料时一定要植物生活正常,不要因缺水、营养和温度光照发生明显改变,影响细胞结构,同时发育程度、部位要准。
(二)固定1.目的:为了使取样的细胞在形态结构和成分方面保持与生活的状态一样,就必须迅速杀死细胞避免失水变形,自溶破坏结构等。
固定液的选择:快;不溶解;不收缩膨胀;软硬适中;增加折光度;增加染色能力;长期保存等7项。
2.方法(1)固定剂的种类:一般采用化学固定单纯固定:只用一种试剂固定:混合固定:用两种或两种以上的试剂混合在一起进行固定如:❖四川师范大学第二章石蜡切片技术单纯固定:乙醇:可与水任何浓度混合❖适合固定浓度为70%_100%:与福尔马林和醋酸等混合使用效果更佳。
动物上皮组织实验报告内容或步骤1. 引言上皮组织是动物体内一种重要的组织类型,它覆盖和保护了动物体表面和内脏器官的表面。
为了更好地了解上皮组织的结构和功能,本实验通过取得动物组织标本,进行显微镜下的观察和研究。
本文将详细介绍实验步骤和观察结果,并对实验结果进行简要分析和讨论。
2. 实验步骤2.1 实验材料准备- 实验动物(如小鼠、大鼠、猪等);- 手术工具(手术刀、手套、止血夹等);- 石蜡切片;- 生理盐水;- 10%中性缓冲福尔马林溶液。
2.2 动物取材1. 实验动物需根据实验需求选择,确保动物权益;2. 使用无菌手术刀和止血夹将实验动物的组织(如皮肤、肠道等)切割取样;3. 将取样的组织迅速放入生理盐水中,避免组织干燥。
2.3 组织固定与包埋1. 取出保存于10%中性缓冲福尔马林溶液中的组织标本;2. 用生理盐水将组织标本洗净,去除多余的缓冲液;3. 将组织标本逐渐脱水处理,分别浸入酒精浓度从低到高的醇溶液中,重复数次;4. 将脱水后的组织标本进行透明化处理,使用透明剂(如xylene)浸渍标本,直至组织透明;5. 将透明的组织标本放入石蜡中,进行包埋处理。
2.4 切片和染色1. 用石蜡切片机将包埋后的组织标本切割成4-6微米厚的切片;2. 将切片平铺于载玻片上,用热力法使切片与载玻片牢固结合;3. 使用特殊染色剂(如血液标本使用伊红染色),将切片染色;4. 染色后,将载玻片上的切片用凝胶剂封装,并标记样本信息。
2.5 显微镜下观察1. 将制作好的载玻片放置于显微镜下;2. 使用适当的物镜(如20倍或40倍)进行观察;3. 观察并记录上皮组织的细胞形态、排列方式、细胞核结构等信息;4. 注意观察上皮组织的细胞间连接方式和是否有微绒毛等特征。
3. 结果与讨论根据观察结果,上皮组织通常由单层或多层上皮细胞组成。
上皮细胞常常具有紧密排列的细胞间连接,如紧密连接、绒毛连接和间接连接等。
在染色后的切片中,可以明显观察到上皮细胞的细胞核和细胞质。
小鼠部分组织的石蜡切片制作一、实验原理:利用脱水剂除去组织中的水分,再用透明剂二甲苯可以去除脱水剂酒精,而二甲苯可以溶解石蜡并将其导入到已脱水的组织细胞中,然后用熔化的石蜡对组织进行包埋,冷却后即可将柔软的组织包埋在石蜡中,使其具有一定硬度,且不改变其大小和形状。
用旋转切片机可将其切为极薄的薄片,经染色、脱水、装片后在显微镜下可以清晰地观察其组织结构.二、材料与用具1.材料:小鼠肝脏、脾脏等.2.用具:溶蜡箱、蜡杯、不同熔点的石蜡、酒精灯等.三、实验内容与步骤1.取材及固定取小鼠,采用拉颈处死或麻醉处死法将其杀死,取其脾脏和肝脏,切为边长约为0。
5cm的组织块。
用先用0.85%的生理盐水漂洗以洗去血液与污渍,如果是管状组织则必须把管腔中污物洗净,可用注射器自一端向管腔中注射生理盐水数次,使其管腔冲洗干净,切忌不可用刀或其他器具刮之。
由动物身上切取的组织必须是新鲜的,材料越新鲜越好,一般不应超过死后24 hr.如果是管状器官或是其中有分泌之消化液,则死后应迅速采取,以免组织自溶或上皮剥落.取下的材料马上进行固定,采用FAA固定液,固定液的用量与组织块体积之比一般在20:1,固定时间2 hr以上,超过24hr时可继续浸泡或转入70%酒精中保存。
不应使组织块贴于容器壁上,应记录固定液的名称,材料的种类,动物品种及开始固定的时间.2.冲洗固定后的组织块在进行脱水前用70%酒精洗去固定液。
3.脱水和硬化经过固定后的组织在水洗后要进行脱水,脱水的目的将组织内的水分用酒精或其他溶剂置换出来,使组织逐渐变硬,便于油类或其他透明及浸入,为熔化的石蜡浸渗到组织中创造条件。
常用的脱水剂是不同浓度的酒精,因为酒精与水有很大的亲和力,酒精浓度可以逐渐升高,置换出组织中的水。
脱水必须充分,脱水不充分会影响透明和浸蜡。
脱水过程要逐级上升,不能操之过急,跳级脱水会引起组织块强烈的收缩变形。
脱水所用的酒精浓度及过程如下:30%—→50%—→70%—→80%—→90%—→95%—→100%(Ⅰ)—→100%(Ⅱ)组织块在各级较低浓酒精(小于70%)中脱水的时间应视组织块的大小而定,大小不超过0.5立方厘米的组织块脱水时间为6~12 hr,在高浓度酒精中(大于70%)脱水时间为3 hr 左右。