4-4酸碱滴定的滴定终点误差解析
- 格式:ppt
- 大小:530.00 KB
- 文档页数:28

滴定分析中滴定终点误差问题分析摘要:滴定分析是化学分析中最常见的一种定量分析方法,它既是检验化学特性的一种重要手段,又是测定化学成分的一种重要手段。
由于滴定法是一种高质量、高水平的滴定法,它可以为化学试验和原材料生产提供可靠的数据分析,提高生产效率,提高试验精度,提高滴定终点的精度,提高滴定分析的精度。
文章介绍了滴定法的基本内涵,介绍了滴定法的重要意义,并对滴定法中存在的误差进行了分析,以期对其进行化学特性的分析和评价。
关键词:滴定分析;滴定终点;问题分析引言:滴定法是化学试验中非常重要的一项检测技术,尽管不能直接用于生产,但是对提高产品质量和优化生产过程起到了积极的作用。
与国外先进国家比较,我国的滴定法技术发展相对滞后,这直接造成了其总体质量低下、滴定终点偏差较大,严重影响了其检测的质量。
一、滴定法的概念与功能滴定分析法是根据滴定指标的颜色变化来判定滴定终点,再根据测定液的用量来确定最后的测定值,其主要有两种:手工滴定和点位滴定。
根据滴定目的和计算公式,将滴定分析分为四大类:酸碱滴定、配位滴定、氧化还原滴定、沉淀滴定。
在化学分析中,化学滴定法的结果不仅会直接影响到有关数据的准确性,还会对建筑工程质量产生重要的影响。
从当前情况来看,国内的滴定分析技术虽然有了很大的进展,但由于自身存在的问题,限制了其发展。
在这样的环境下,为了保证工程质量,必须要保证滴定的准确度。
具体地说,可以通过滴定法产生一份完整的数据分析报告,以此作为相关的生产操作指南;其次,通过对运行状况的监测和反馈,可以使原材料生产过程中出现的问题得到及时的反映。
二、滴定法中的终点误差分析1.滴定点的判定标准不清目前,国内有关部门和企业已形成了比较完备的检测系统,但是缺乏专门的滴定检验部门,往往是由科研人员兼|职,这就造成了很多问题,比如滴定终点的误差。
另外,在滴定终点的测定中,往往以颜色的改变为基础,缺乏一个统一的判断标准,使得滴定终点的确定往往会出现较大的偏差。


酸碱中和滴定是中学化学实验中的重要定量实验, 特别是对它的实验误差分析更是学生学习和掌握本实验的重点和难点。
根据引起误差的原因, 笔者对其分析归纳如下:一、仪器洗涤不当酸碱中和滴定实验中, 滴定管、移液管和锥形瓶都要用蒸馏水洗净, 且滴定管、移液管还要用待装液润洗2~3 次, 锥形瓶不润洗。
若洗涤不当就会引起误差, 如:1. 滴定管用蒸馏水洗后未用标准液润洗, 就直接装入标准液,造成标准液稀释, 溶液浓度降低,滴定中消耗V( 标) 偏大, C( 待) 偏高。
2. 盛待测液的滴定管或移液管水洗后, 未用待测液润洗就取液加入锥形瓶, 造成待测液被稀释, V( 标) 偏小, C( 待) 偏低。
3. 锥形瓶水洗后, 又用待测液润洗, 再取待测液, 造成V( 标) 偏大, C( 待) 偏高。
4. 滴定前, 锥形瓶用水洗涤后, 或锥形瓶中残留水未干燥, 或取完待测液后再向锥形瓶中加点水便于观察, 虽然V( 待) 增大, 但C( 待)变小, 其物质的量不变, 无影响。
二、读数不当1. 盛标准液的滴定管, 在滴定前仰视滴定管读数, 滴定后平视滴定管读数, 造成V( 标) 减小,C( 待)偏低。
2. 盛标准液的滴定管, 在滴定前平视滴定管刻度线, 滴定终了仰视刻度线, 读数偏大, 造成V( 标)偏大, C( 待) 偏高。
3. 盛标准液的滴定管, 在滴定前平视滴定管刻度线, 滴定终了俯视刻度线, 读数偏小, 造成V( 标)减小,C( 待) 偏低。
4. 盛标准液的滴定管, 在滴定前仰视滴定管刻度线, 读数偏大,滴定后俯视刻度线, 读数偏小。
造成V( 标) 减小, C( 待) 偏低。
三、操作不当1. 用滴定管取待测液时, 滴定管尖嘴处有气泡未排出就取液加入锥形瓶, 由于气泡填充了部分待测液, 使得待测液体积减小, 造成滴定时V( 标) 偏小, 则C( 待) 偏低。
2. 滴定前, 液面在“0”刻度线之上, 未调整液面, 造成V( 标) 偏小, C( 待) 偏低。

酸碱滴定反应的终点和滴定误差酸碱滴定反应是化学实验中常见的一种定量分析方法,用于确定溶液中酸碱的浓度。
在滴定过程中,滴定剂的加入量与被滴定物质的摩尔比例达到化学计量比时,称为滴定终点。
滴定的准确性主要受滴定终点的判断和滴定误差的影响。
本文将探讨酸碱滴定反应的终点判断方法以及滴定误差的产生原因。
一、酸碱滴定反应的终点判断方法滴定终点的准确判断对于酸碱滴定反应的准确性至关重要。
以下是几种常用的滴定终点判断方法。
1. 颜色指示剂法颜色指示剂常用于酸碱滴定反应终点的判断。
它是一种在酸碱滴定过程中改变颜色的物质,可以通过颜色变化来判断滴定终点。
常见的指示剂有酚酞、溴脱色液等。
例如,酚酞指示剂在酸性溶液中呈红色,在碱性溶液中呈无色。
当滴定剂与被滴定物质的摩尔比例达到化学计量比时,酸性溶液中的酚酞指示剂会由红色转变为无色,此时即为滴定终点。
2. pH指示剂法pH指示剂是一种能够根据溶液的酸碱性质而改变颜色的物质。
它可以通过检测溶液的pH值来判断滴定终点。
常见的pH指示剂有酚酞、溴脱色液等。
以酚酞为例,当滴定剂与被滴定物质的摩尔比例达到化学计量比时,溶液的pH值会发生变化,致使酚酞指示剂的颜色发生变化。
通过检测颜色的变化,可以准确判断滴定终点。
3. 过滴定法过滴定法是通过向滴定溶液中加入滴定剂超过滴定终点的量,然后再回滴定剂至滴定终点,以确定滴定终点并计算误差。
此方法需要在滴定过程中精确调节滴定剂的加入量,对于需要高精度滴定的情况非常适用。
二、滴定误差的产生原因滴定误差是指在酸碱滴定实验中由于各种因素造成的测量误差。
以下是几种常见的滴定误差产生原因。
1. 滴定剂的进度误差滴定剂的进度误差是由于滴定过程中溶液滴下速度的不准确引起的。
这可能是由于操作不慎、仪器不精确或眼力不够准确等原因造成的。
2. 终点判断误差终点判断误差是由于判断滴定终点的方法不准确引起的。
如颜色变化的判断不明显、pH计测量的误差或人眼判断的主观性等。
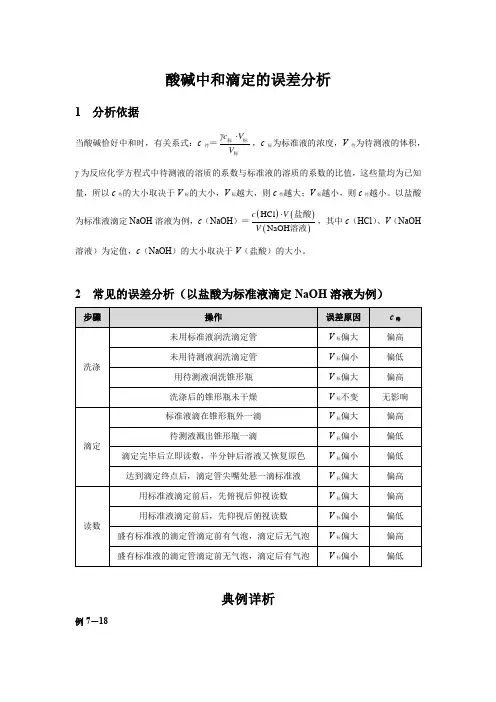
酸碱中和滴定的误差分析1 分析依据当酸碱恰好中和时,有关系式:c 待=,c 标为标准液的浓度,V 待为待测液的体积,γ为反应化学方程式中待测液的溶质的系数与标准液的溶质的系数的比值,这些量均为已知量,所以c 待的大小取决于V 标的大小,V 标越大,则c 待越大;V 标越小,则c 待越小。
以盐酸为标准液滴定NaOH 溶液为例,c (NaOH )=,其中c (HCl )、V (NaOH溶液)为定值,c (NaOH )的大小取决于V (盐酸)的大小。
2 常见的误差分析(以盐酸为标准液滴定NaOH 溶液为例)典例详析例7-18γc V V ⋅标标标()()()HCl NaOH c V V ⋅盐酸溶液某化学兴趣小组采用以下方法测定绿矾(FeSO 4·7H 2O )样品的纯度。
a .称取2.850 g 绿矾样品,溶解,在250 mL 容量瓶中定容配成待测液;b .量取25.00 mL 待测液于锥形瓶中;c .用硫酸酸化的0.010 0 mol ·L -1 KMnO 4溶液滴定待测液至终点,消耗KMnO 4溶液的平均体积为20.00 mL 。
下列说法不正确的是( ) A .a 步骤中定容时仰视,会使所配溶液浓度偏低 B .滴定时盛放KMnO 4溶液的仪器为酸式滴定管C .滴加最后半滴KMnO 4溶液时,溶液变为粉红色,即达到滴定终点D .样品中FeSO 4·7H 2O 的质量分数约为97.5%解析◆a 步骤中定容时仰视,会使配制溶液的体积偏大,浓度偏低,A 项正确。
酸性KMnO 4溶液具有强氧化性,应盛放在酸式滴定管中,B 项正确。
滴定终点的现象为滴入最后半滴KMnO 4溶液时,溶液变为粉红色且半分钟内不褪色,C 项错误。
n (MnO - 4)=20×10-3L ×0.010 0 mol ·L -1=2.0×10-4 mol ,根据滴定时的离子方程式5Fe 2++MnO - 4+8H +===5Fe 3++Mn 2++4H 2O 可得,25.00 mL 待测液中n (Fe 2+)=5×2.0×10-4 mol =1.0×10-3 mol ,则样品中n (Fe 2+)=10×1.0×10-3 mol =1.0×10-2 mol ,m (FeSO 4·7H 2O )=278 g ·mol -1×1.0×10-2 mol =2.780 g ,w (FeSO 4·7H 2O )=×100%≈97.5%,D 项正确。

浅谈“酸碱中和滴定”的原理及误差分析【摘要】本文从实验原理、指示剂选择、具体步骤等方面,就酸碱中和滴定可能产生的误差进行讨论。
【关键词】酸碱中和滴定原理误差分析引言酸碱中和滴定是高中重要的定量实验之一,也是高考中的重点,而每一个不当或错误的操作都会带来实验误差,所以误差分析是学生必备的实验能力。
由于产物误差的原因有很多,因此在教学过程中一定先掌握实验原理,把握规律,找到突破口,各个击破。
让学生从根本上掌握误差分析的基本方法。
一、酸碱中和滴定原理1、定义:用已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法2、原理:在酸碱中和反应中,使用一种已知物质的量浓度的酸或碱溶液跟未知浓度的碱或酸溶液完全中和,测出二者的体积,根据化学方程式中酸和碱的物质的量的比值,就可以计算出碱或酸的溶液浓度。
n(H+) = n(OH-)公式:c酸v酸=c碱v碱(一元酸和一元碱)3、实验的关键:(1)准确测量参加反应的两种溶液的体积(2)准确中和反应是否恰好完全反应4、实验仪器及试剂:(1)仪器:酸式滴定管、碱式滴定管、锥形瓶、 铁架台、滴定管夹、烧杯、白纸(2)试剂:标准液、待测液、指示剂、蒸馏水。
(3)滴定管的使用①酸式滴定管:下端是玻璃活塞,用来盛放酸性或氧化性(KMnO 4、溴水等)的溶液。
②碱式滴定管:下端由乳胶管、玻璃球组成的阀,用来盛放碱性溶液。
(4)读数:滴定管0刻度在上,从上往下读,量程有25mL 、50mL 。
精确度:0.01mL 。
二、指示剂的选择:1、原则:1)终点时,指示剂的颜色变化明显2)变色范围越窄越好,对溶液的酸碱性变化较灵敏2、酸碱指示剂:一般是有机弱酸或有机弱碱(定性测定)紫色石蕊因为变色范围宽,不灵敏,而且颜色变化不明显,所以一般不选用紫色石蕊。
3、酸碱中和滴定中指示剂的选择:4、滴定终点判断标准:加入最后半滴标准液,溶液变为××色,且半分钟内无变化。

酸碱滴定实验中的滴定误差分析与改进酸碱滴定实验是化学实验中常见的一种分析方法,用于确定溶液中酸或碱的浓度。
然而,在实际操作中,由于仪器设备、人为误差、试剂质量等多种因素的影响,滴定误差常常会出现。
本文将针对酸碱滴定实验中的滴定误差进行分析,并提出改进方法。
一、滴定误差的原因分析1.体积误差:滴定管、移液管等玻璃仪器的刻度误差或使用不当,导致溶液加入量与目标值存在偏差。
2.指示剂误差:指示剂选择不当或使用不当,导致滴定终点判断的不准确。
3.滴定液浓度误差:滴定液浓度制备不准确或保存不当,导致滴定液浓度与标称值存在差异。
4.滴定操作误差:滴定速度不均匀、滴定终点判断失误等操作问题,导致滴定结果的不准确。
二、改进滴定误差的方法1.准确选择仪器:使用准确刻度的滴定管或移液管,并严格按照操作规范进行使用和清洗,以降低体积误差。
2.优化指示剂的选择:根据滴定反应的性质选择合适的指示剂,使其变色点与滴定终点尽可能接近,减小指示剂误差对实验结果的影响。
3.确保滴定液浓度准确:制备滴定液时应注意使用准确称量仪器,严格按照配比制备,确保溶液浓度与标称值尽可能接近。
4.规范操作过程:控制滴定速度,使滴定速度均匀稳定;注意观察滴定终点的变化,多次实验以验证终点判断的准确性。
5.重复实验:进行多次滴定实验,计算平均值,以降低随机误差的影响。
6.交叉验证与比较:可以通过与其他准确的分析方法进行交叉验证,比较结果的一致性,进一步确认滴定结果的准确性。
7.培养操作技能:加强实验人员的操作技能和经验积累,熟练掌握滴定实验的操作要点和注意事项,减少人为误差。
三、案例分析以测定硫酸溶液中硫酸铜含量为例,进行滴定误差分析与改进。
实验中发现,滴定管刻度不清晰,给滴定操作带来一定困难,容易出现体积误差。
改进方案是使用刻度清晰的滴定管,并严格按照刻度读数进行滴定,从而减小体积误差。
另外,在选择指示剂时,根据反应性质选用了溴甲酚绿。
但由于溴甲酚绿的变色范围与滴定终点不完全一致,导致滴定过程中无法准确判断终点。

酸碱滴定实验中的滴定误差分析在酸碱滴定实验中,滴定误差是不可避免的。
滴定误差主要由以下几个方面引起:试剂体积计量误差、滴定剂的使用误差、指示剂的选择问题以及观察误差等。
本文将针对这些方面进行详细分析,以帮助读者更好地理解和解决滴定误差问题。
一、试剂体积计量误差在酸碱滴定实验中,试剂体积计量误差是一种常见的误差来源。
这种误差可能是由于试剂瓶口有液滴残留、读数不准确、试剂注入时会有一定体积的挥发等造成的。
为减小体积计量误差,可以采取以下几种方法:1. 使用准确的体积计量器具,例如准确度高的移液管或分度筒,确保测量结果的准确性。
2. 注意排气操作,避免试剂在倒入容器时产生气泡,从而导致读数误差。
3. 注意试剂的保存和使用,避免试剂挥发或因长期存放而变质,影响测量结果。
二、滴定剂的使用误差滴定剂的使用误差是指在实验操作过程中,由于滴定剂使用不当或滴定过程中滴下的滴液大小不一致等因素导致误差产生。
为减小滴定剂使用误差,应注意以下几点:1. 使用适当的滴定管和滴定管支架,保持滴定管与溶液垂直,以确保滴液的大小和速度基本一致。
2. 控制好滴定剂的滴定速度,避免过快或过慢,以免造成误差。
3. 试剂的滴定剂使用前需摇匀,以确保溶液的均匀性。
三、指示剂的选择问题指示剂的选择对滴定结果具有重要的影响,不同的指示剂适用于不同的酸碱滴定反应。
在选择指示剂时,应考虑以下几个因素:1. 酸碱滴定反应的pH范围:选择的指示剂应在滴定终点的pH范围内发生显色变化。
2. 指示剂的色谱特性:不同指示剂的显色特性和变化过程不同,因此在试验前应了解不同指示剂的特点,并根据实际需要进行选择。
3. 指示剂的添加量:指示剂的添加量应适当控制,过多或过少都会影响滴定结果。
四、观察误差观察误差是指在滴定过程中,读数或记录数据时产生的误差。
为减小观察误差,可以采取以下方法:1. 重复滴定:重复滴定可以减小个别误差的影响,提高测量结果的可靠性。
2. 注意终点的判断:终点判断的准确性对滴定结果具有很大影响,应细心观察,尽量避免主观误差。
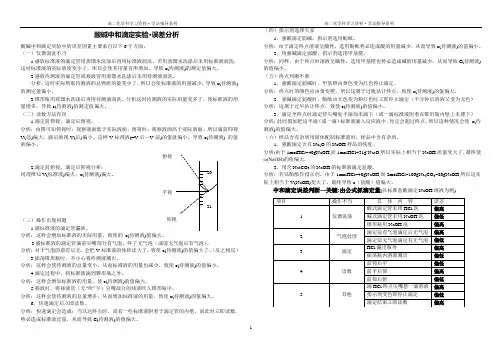
高二化学科学习资料·学法指导系列 高二化学科学习资料·学法指导系列1酸碱中和滴定实验·误差分析酸碱中和滴定实验中的误差因素主要来自以下6个方面: (一)仪器润洗不当1.盛放标准液的滴定管用蒸馏水洗涤后再用标准液润洗。
若用蒸馏水洗涤后未用标准液润洗,这时标准液的实际浓度变小了,所以会使其用量有所增加,导致c(待测液)的测定值偏大。
2.盛放待测液的滴定管或移液管用蒸馏水洗涤后未用待测液润洗。
分析:这时实际所取待测液的总物质的量变少了,所以会使标准液的用量减少,导致c(待测液)的测定值偏小。
3.锥形瓶用蒸馏水洗涤后再用待测液润洗。
分析这时待测液的实际用量变多了,使标准液的用量增多,导致c(待测液)的测定值偏大。
(二)读数方法有误1.滴定前仰视,滴定后俯视。
分析:由图可知仰视时:观察液面低于实际液面。
俯视时:观察液面高于实际液面。
所以滴前仰视V(前)偏大,滴后俯视V(后)偏小。
这样V 标准液(=V 后—V 前)的值就偏小,导致c(待测液) 的值就偏小。
2.滴定前俯视,滴定后仰视分析:同理推知V(标准液)偏大,c(待测液)偏大。
(三)操作出现问题1.盛标准液的滴定管漏液。
分析:这样会增加标准液的实际用量,致使的 c(待测液)值偏大。
2.盛标准液的滴定管滴前尖嘴部分有气泡,终了无气泡(或前无气泡后有气泡)。
分析:对于气泡的前有后无,会把V 标准液的体积读大了,致使c(待测液)的值偏大了。
(反之相反)3.振荡锥形瓶时,不小心将待测液溅出。
分析:这样会使待测液的总量变小,从而标准液的用量也减少,致使c(待测液)的值偏小。
4.滴定过程中,将标准液滴到锥形瓶之外。
分析:这样会增加标准液的用量,使c(待测液)的值偏大。
5.移液时,将移液管(无“吹”字)尖嘴部分的残液吹入锥形瓶中。
分析:这样会使待测液的总量增多,从而增加标准液的用量,致使c(待测液)的值偏大。
6.快速滴定后立即读数。

高中化学酸碱滴定误差与滴定终点判定方法题解析酸碱滴定是高中化学中常见的实验操作,也是考试中常见的题型。
在酸碱滴定实验中,我们常常会遇到误差的问题,同时也需要准确地判定滴定终点。
本文将针对这两个问题进行详细的解析,并给出一些解题技巧。
一、酸碱滴定误差的来源及解决方法在酸碱滴定实验中,误差主要来自以下几个方面:1. 体积误差:体积误差是指实际滴定液的体积与理论值之间的差异。
这种误差通常是由于滴定管或分液器的刻度不准确、读数不准确等原因导致的。
解决方法是使用精确的量筒或分液器,并注意准确读数。
2. 滴定液浓度误差:滴定液的浓度误差会直接影响到滴定的准确性。
这种误差通常是由于滴定液的制备不准确、保存不当等原因导致的。
解决方法是制备滴定液时要注意精确称取药品和溶解液,同时要避免滴定液的长时间保存。
3. 滴定终点判定误差:滴定终点是指滴定过程中酸碱反应达到化学计量的点。
滴定终点的判定误差通常是由于滴定指示剂的选择不当、判定方法不准确等原因导致的。
解决方法是选择合适的指示剂,并注意观察颜色变化的细节。
二、滴定终点判定方法及解题技巧在酸碱滴定实验中,准确判定滴定终点是非常重要的。
以下是一些常见的滴定终点判定方法及解题技巧:1. 颜色指示法:使用酸碱指示剂,根据颜色变化来判定滴定终点。
例如,使用酚酞指示剂进行酸碱滴定,当溶液由无色变为粉红色时,即为滴定终点。
解题技巧是要选择合适的指示剂,并注意观察颜色变化的细节。
2. pH计法:使用pH计测量溶液的pH值,当pH值发生突变时,即为滴定终点。
解题技巧是要熟悉常见酸碱溶液的pH值范围,以便准确判定滴定终点。
3. 导电性法:使用电导仪测量溶液的电导率,当电导率发生突变时,即为滴定终点。
解题技巧是要了解酸碱溶液的导电性规律,以便准确判定滴定终点。
三、举一反三通过以上的解析,我们可以将酸碱滴定误差与滴定终点判定方法的解题技巧应用到其他相关的题目中。
例如,题目可能会要求计算滴定液的浓度、判断滴定终点的pH值范围等等。

如何进行酸碱滴定实验的误差分析酸碱滴定实验是化学实验中常见的一种实验方法,用于测定溶液中的酸碱度。
在进行酸碱滴定实验时,由于实验条件、仪器设备、试剂质量等因素的限制,难免会引入一定的误差。
因此,正确进行误差分析对于保证实验结果的准确性和可靠性至关重要。
本文将介绍如何进行酸碱滴定实验的误差分析,以帮助读者更好地理解和应用该实验方法。
一、实验仪器与设备的误差分析在进行酸碱滴定实验时,使用的仪器和设备可能会存在一定的误差。
例如,滴定管的刻度误差、滴定管内悬殊液滴溢出的误差、电子天平的示值误差等。
为了准确评估仪器和设备的误差,可以采用以下方法:1.滴定管的刻度误差:使用标准溶液进行试验,重复测量滴定管中的液体体积,计算平均值和标准差,根据标准差的大小确定刻度误差的范围。
2.滴定管内悬殊液滴溢出误差:使用标准溶液进行试验,记录每滴溢出的体积,根据平均值和标准差计算误差值。
3.电子天平示值误差:使用标准物质进行称量,多次测量并计算平均值和标准差,根据标准差确定示值误差的范围。
二、试剂质量的误差分析试剂的质量是酸碱滴定实验中的另一个重要因素。
试剂质量的误差可能来自于天平的示值误差、试剂容器的残余、试剂纯度的误差等。
为了准确评估试剂质量的误差,可以采用以下方法:1.天平示值误差:使用称量瓶或瓶盖进行称量,并多次测量,计算平均值和标准差,根据标准差确定示值误差范围。
2.试剂容器的残余:在称取试剂前,先称取空容器,记录重量,并在称取试剂后再次称取空容器。
根据两次测量的差值计算残余质量。
3.试剂纯度误差:对于纯度已知且已标定的试剂,可以使用标准曲线或其他方法进行纠正;对于纯度未知的试剂,应尽量选用质量较高的试剂品牌。
三、操作误差的分析操作误差是在实验操作过程中产生的误差,如滴定过程中的滴液速度、指示剂的添加量、反应终点的判断等。
正确分析操作误差的方法如下:1.滴液速度:在标准溶液中进行试验,记录每滴滴液的时间,并根据滴液速度计算滴定过程中的误差范围。
“酸碱中和滴定指示剂选择”误差分析案例[引言]2003年4月,教育部正式颁发了《普通高中化学课程标准(实验)》,从而拉开21世纪初我国高中化学课程改革的序幕。
在千呼万唤中浙江省也将在今年下半年实施新课程标准。
传统的高中教学还是把学生限定在教室和习题中,排斥学生自主探究和实践活动,学生分析、解决实际问题和合作交流的能力得不到应有的锻炼,学生学习化学的兴趣在“题海战”中普遍下降,化学的趣味性和实践性得不到很好体现。
取而代之的新课程理念尊重学生个性发展的需要,以全面提高学生的科学素养为宗旨,强调把学生培养成不同领域的人才。
新课标强调的就是“你需要什么,我给你什么”,而不是“我给你什么,你接受什么”。
[背景]高中化学第二册第三章酸碱中和滴定是中学化学中一个重要的定量实验,而酸碱指示剂的选择和滴定终点的判断又是做好酸碱中和滴定实验的根本保证。
因此使学生认识指示剂和滴定终点的关系显得尤为重要。
为了能上好这堂组内公开课,我事先作了精心准备,考虑到面对的是一批学习成绩优秀的,思维敏捷而发言又很积极的学生,也考虑到中和滴定实验的难度,事先我也作了许多假设和可能出现的问题,期望按照我的思路上好这堂公开课。
[问题提出]师:在定量分析中,用已知物质的量浓度的酸和碱来测定未知浓度的碱和酸的方法叫酸碱中和滴定。
滴定的目的是测定酸或碱的物质的量浓度。
据中和反应的实质:H+OH=H2O推出:K.c标.V标=c待.V待即:c待=K. c标.V标/V待师:酸碱中和滴定所需的仪器(一一展示并简单介绍它们的作用和使用要注意的问题)酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹等。
(学生认真的听着,不时对新看到的仪器表现出一种好奇心和新鲜感)师:准确的做好酸碱中和滴定实验的关键是什么?生:我想,根据上面的公式准确测出V标的体积很重要。
师:很好,那么我怎么知道V待的体积是多少呢?生:我认为V待的体积事先也应该测好,可以把它放在锥形瓶中(看来学生事先也作了预习)师:酸碱中和滴定的关键有两点:①准确测定参加反应的两溶液V标和V待的体积;②准确判断中和反应是否恰好完全进行,可借助于酸碱指示剂来判断滴定终点;师:其中强酸与强碱互滴时,可选用酚酞(变色范围8—10)或甲基橙(变色范围3.1—4.4)作指示剂。
酸碱中和滴定的误差分析湖南省澧县一中余志宏酸碱中和滴定实验是中学化学中十分重要的定量实验,而其误差分析又是一个难点。
那么酸碱中和滴定的误差如何分析?下面就待测液放在锥形瓶中,标准液放在滴定管中的情况进行探讨一下:1、来自滴定管产生的误差:①、滴定管水洗后,未用标准液润洗析:因标准液被附在滴定管内壁的水珠稀释了,故消耗的标准液体积多了,所以结果偏高。
②、滴定管水洗后,未用待测液润洗析:因待测液被附在滴定管内壁的水珠稀释了,故消耗的标准液体积少了,所以结果偏低。
③、盛标准液的滴定管滴定前有气泡,滴定后气泡消失析:读出来的标准液体积为实际消耗的标准液体积+ 气泡体积, 故消耗的标准液体积读多了,所以结果偏高。
④、盛待测液的滴定管滴定前有气泡析:读出来的待测液体积为实际量取的待测液体积+ 气泡体积, 即待测液量少了,故消耗的标准液也少,所以结果偏低。
2、来自锥形瓶产生的误差:①、锥形瓶用蒸馏水水洗后又用待测液润洗析:因瓶内壁附着待测液,故锥形瓶内的待测液多了,消耗的标准液也多,所以结果偏高。
②、锥形瓶未洗净,残留有与待测液反应的少量物质,故消耗的标准液少了,所以结果偏低。
③、锥形瓶水洗后未干燥就加入待测液或滴定过程中向锥形瓶内加水析:实际参与中和反应的待测液的总量没变,实际消耗的标准酸液也就不变,故结果不变。
3、来自读数带来的误差:①、用滴定管量取待测液时A、先俯视后仰视(先俯视后平视或先平视后仰视)析:量取待测液的实际体积偏小,消耗的标准液也少,所以结果偏低。
B、先仰视后俯视(先仰视后平视或先平视后俯视)析:量取待测液的实际体积偏多,消耗的标准液也多,所以结果偏高。
②、用滴定管量取标准液时A、先俯视后平视析:读出来的标准液体积为V终-V始,而俯视时V始读小了,读出来的标准液体积偏大了,所以结果偏高。
B、先仰视后平视析:读出来的标准液体积为V终-V始,而俯视时V始读大了,读出来的标准液体积偏小了,所以结果偏低。
酸碱中和滴定实验误差分析以一元酸和一元碱的中的滴定为例因C标、V定分别代表标准液浓度、所取待测液体积,均为定值,代入上式计算。
但是实际中C标、V定都可能引起误差,一般可把各因素引起的误差转嫁到V读上,若V读偏大,则测定结果偏大;若V读偏小,则测定结果偏小,故通过分析V读的变化情况,可分析滴定的误差。
引起误差可能因素有以下几种:(1)视(读数)注意:①滴定管中液体读数时精确到0.01mL ②一般需滴定2-3次,取其平均值(2)洗(仪器洗涤)正确洗法:二管二洗——酸式滴定管和碱式滴定管先用蒸馏水清洗多次,再用待装液润洗几次。
一瓶一洗——锥形瓶只能用蒸馏水洗。
注意:一般滴定管装标准液,锥形瓶里装待测液。
错误洗法导致结果:①滴定管仅用水洗,使标准液变稀,故消耗标准液体积一定变大,V读变大,结果偏大。
②移液管仅用水洗,则待测液变稀,所取待测液溶质物质的量变少,V读变小,结果偏小。
③锥形瓶用待测液洗过,则瓶内待测液的溶质量偏多,V读偏大,结果偏大。
④第一次滴定完后,锥形瓶内液体倒去后,尚未清洗,接着第二次滴定,滴定结果如何,取决于上次滴定情况如何。
(3)漏(液体溅漏)①滴定过程中锥形瓶内液体溅出,则结果偏小。
②终点已到,滴定管下端尖嘴中有液滴,则V读偏大,测定结果偏大。
(4)泡(滴定管尖嘴气泡)正确操作应在滴定前把尖嘴管中的气泡赶尽,最后也不能出现气泡。
如滴定开始有气泡,后气泡消失,则结果偏大。
若先无气泡,后有气泡,则结果偏小。
(5)色(指示剂变色控制与选择)滴定时,眼睛应紧盯着锥形瓶内溶液的颜色变化。
指示剂变色后应半分钟内不复原。
如变色后立即复原,则结果偏小。
另外,同一种滴定,选择的指示剂不同,测定结果不同。
(6)杂(标准物含杂质)用于配制标准液的固体应该是纯净物。
但其中有可能混有杂质,称量时又按需标准物固体质量来称取的,帮一般均会产生误差,在此杂质又分两种情况:①杂质与待测液不反应如NaOH中含NaCl,所配的NaOH溶液浓度变小,滴定盐酸时,NaCl不参与反应,所需标准液的体积偏大,故测定结果偏大。