终点误差计算
- 格式:docx
- 大小:19.33 KB
- 文档页数:1








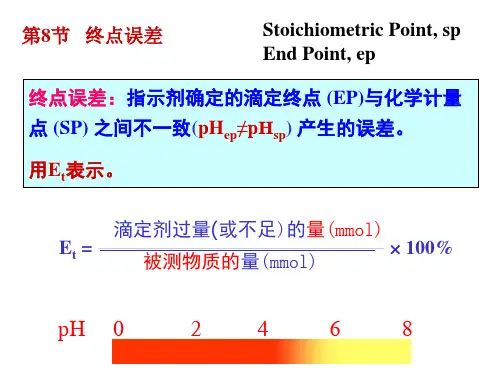
题目:滴定终点误差摘要:终点误差:指示剂确定的滴定终点(EP)与化学计量点(SP) 之间存在着差异(pHep≠pHsp) ,使滴定结果产生的误差,用Et表示。
Et =﹙过量或不足的滴定剂物质的量/被测物质的物质的量﹚×100%。
适合于所有滴定终点误差的计算,其包括酸碱中和滴定、络合滴定、氧化还原滴定和沉淀滴定含有指示剂的化学分析操作。
关键词:误差分析酸碱络合前言:在滴定中,通常利用指示剂来确定滴定终点。
若滴定终点与化学计量点不一致,就会产生滴定误差,这种误差叫做终点误差。
它不包括滴定操作本身所引起的误差。
为了便于理解在络合滴定中提到了林邦公式推导、讨论和应用,外加部分例题。
主题一、酸碱中和滴定的误差分析终点误差:指示剂确定的滴定终点(EP)与化学计量点(SP) 之间存在着差异(pHep≠pHsp) ,使滴定结果产生的误差,用Et表示。
Et =﹙过量或不足的滴定剂物质的量/被测物质的物质的量﹚×100%1、强碱滴定强酸NaOH 滴定HClPBE: [H+]ep+[Na+]ep= [OH-]ep+[Cl-]ep cepNaOH-cepHCl=[OH-]ep-[H+]ep– pHsp注意:csp 不等于原始浓度HCl 滴定NaOH ,则为:2、弱酸弱碱滴定NaOH 滴定HA强酸滴定弱碱则是:3、多元酸滴定NaOH 滴定H3A :4、终点误差总结终点误差定义Et计算式及林邦误差公式二、络合滴定误差分析㈠、络合滴定的终点误差的定义式为:化学计量点时溶液中金属离子平衡浓度的求算设滴定终点(ep)与化学计量点(sp)处pM之差为ΔpM,即㈡、终点误差公式的讨论1.该公式只能在化学计量点附近使用,因为在推导该公式的过程中所做近似处理的前提条件是滴定终点与化学计量点很接近。
2.滴定时越大,越大,越小时,也就是说终点越接近化学计量点时,用林邦公式计算的误差值偏离真实误差值的程度就越小。
3.由该公式可以看到终点误差既与有关,也与有关。


终点误差是指在化学反应中滴定分析实验测试的最终结果与实际结果之间存在的误差大小。
终点误差在氧化还原滴定分析中也被广泛应用,一般滴定的绝对精度不能超过1%,也就是说所有滴定结果的终点误差之和应该小于或等于最终结果的1%。
在氧化还原滴定分析中,由于反应本身的复杂性,终点误差的程度也比较大。
氧化还原滴定分析中的终点误差是由两个因素引起的:一是过度氧化和还原反应没有准确控制;另一个因素是电位滴定反应终点的识别可能会出错。
在氧化还原滴定实验中,可能的误差源包括:1、检测仪器的误差:滴定仪器的精度和稳定性决定了滴定结果的准确性。
2、控制反应的精确性:一般滴定化学反应反应需要控制,控制反应温度、pH以及反应时间等是关键,以降低出现误差的概率。
如果控制反过程不够准确,会累积误差,影响滴定结果。
3、调整反应过程:仪器检测和控制反应过程有了误差,误差会随着反应过程累积,所以控制反应过程对减少终点误差的影响是至关重要的。
4、校准控制死角:死角是指滴定仪器反应过程中出现的误差,如果有死角,会影响终点误差大小,所以需要及时校准仪器死角,以降低终点误差。
此外,氧化还原滴定还可能受到样品稀释、滴定反应液配置、氧化还原反应抗性和参比电解质的稳定性等因素的影响,这些因素都可能影响到氧化还原滴定实验的准确性,也会引起终点误差。
尽管氧化还原滴定分析中的终点误差可能较大,但只要采取正确的措施,一定可以将终点误差降到较小。
最重要的是要定期校准仪器,使仪器能准确反映实际滴定实验结果;另外,要确保氧化还原反应准确控制,确保反应液稳定,样品正确稀释,以及确保滴定过程正确无误操作等,这样才能保证滴定结果终点误差较小。
计算强酸和强碱互相滴定时的终点误差
现以强碱(NaOH)滴定强酸(HCl)为例,滴定终点误差应用终点时过量物质的量占应加入物质的量百分数表示,即
这里设C、V为化学计量点时被测酸的实际浓度和体积,V为滴定终点时溶液
的体积,则V≈V。
又因滴定过程中溶液的质子条件式是
[H] + C= [OH]+ C
C- C= [OH]-[H]
所以上式可写作
(4·12a)
如指示剂在化学计量点变色时,[H]=[OH],滴定终点误差为零;如指示剂在化学计量点后变色,即碱加过量了,则滴定终点误差为正值;若指示剂在化学计量前变色,即溶液在有剩余的酸,则滴定终点误差为负值。
若用强酸滴定强碱,可用同法推算出滴定终点误差的计算式,应写作
(4·12b)。