络合滴定终点误差计算
- 格式:ppt
- 大小:484.00 KB
- 文档页数:36


络合滴定法学习要点1、络合滴定ABC2、络合滴定的条件是什么?3、络合滴定曲线是怎样绘制的?4、络合滴定曲线有什么意义和用途?5、络合滴定突跃如何计算?6、络合滴定误差如何计算?1、络合滴定ABC络合滴定法又叫配位滴定法,是以生成金属络合物为滴定反应基础的容量分析,通常教材中介绍的络合滴定是指以EDTA滴定M(或M滴定EDTA)的反应体系。
络合滴定受到pH值(EDTA酸效应和M的水解效应)、共存的其他络合剂L(M的络合效应)、共存的其他金属离子N(争夺EDTA,对EDTA 的共存离子效应)的四重影响。
分析化学中将各种影响用副反应系数α来表示,计算出各自的α值,再与绝对稳定常数K合并,构成条件稳定常数K’MY,或lgK’MY。
引入条件稳定常数后,原来简单溶液的EDTA-M络合平衡的平衡定律表达式就可替换成用M总浓度M’和EDTA总浓度Y’及MY总浓度MY’(一般情况下忽略MY的副反应)表示的化学平衡定律。
各项副反应系数的定义式和计算式如下:(1)酸效应系数(影响EDTA,使EDTA质子化,降低[Y]浓度):6Y(H)1[Y']1[H ][Y]H ii i αβ+===+∑其中:6EDTA [Y']=[Y]+[HY]+......[H Y]=c(M ’中不含MY 项,络合滴定中必须考虑,可以查表)(2)络合效应系数(影响M ,L 与M 络合,降低[M]浓度):M(L)1[M']1[L][M]n ii i αβ===+∑ 其中:n [M']=[M]+[ML]+......[M L](Y ’中不含MY 项,络合滴定中比较常见的影响,重点)(3)水解效应系数(影响M ,生成羟基络离子,降低[M]浓度):M(OH)1[M']1[OH][M]n ii i αβ===+∑ 其中:n [M']=[M]+[MOH]+......[M OH](不含MY 项,该效应相当于OH 对M 的络合效应,滴定条件下一般可以忽略)(4)共存离子效应系数(对EDTA ):''Y(H)NY NY [Y']1[N]1[N ][Y]K K α==+=+ 其中:[Y']=[Y]+[NY](Y ’中不含MY 项,络合滴定中考虑共存金属离子干扰及消除时要用到,通过加入一种掩蔽剂进去,使干扰的N 生成稳定络离子,就不再干扰M 的滴定了。





络合滴定计算公式络合滴定是一种常用的化学分析方法,通过形成络合物来测定溶液中金属离子的浓度。
在这个过程中,涉及到一些重要的计算公式,咱们今天就来好好唠唠。
我记得有一次在实验室里,我带着一群学生做络合滴定的实验。
那场景,可真是热闹非凡。
学生们一个个既兴奋又紧张,都想把实验做好。
其中有个叫小李的同学,特别积极,一双大眼睛紧紧盯着滴定管,手里还不停地记录着数据。
咱们先来说说络合滴定中的一个关键公式——条件稳定常数(K')的计算公式。
这公式是K' = K / αM(αY) 。
其中 K 是稳定常数,αM是金属离子的副反应系数,αY 是 EDTA 的副反应系数。
这个公式就像是一把钥匙,能帮咱们打开准确测定金属离子浓度的大门。
比如说,在测定钙离子浓度的时候,如果溶液中有其他离子会与钙离子发生反应,影响测定结果,这时候就要通过计算副反应系数来修正,从而得到更准确的条件稳定常数。
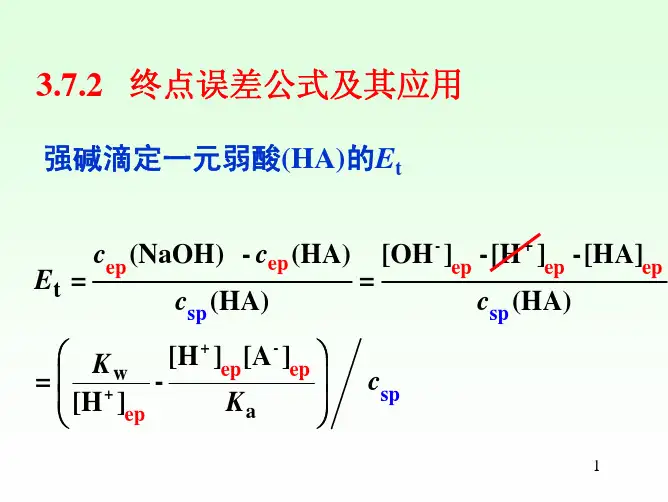
再来讲讲络合滴定的终点误差计算公式。
这可是判断咱们实验结果准不准的重要依据。
终点误差(TE)的计算公式是TE = [ 10^ΔpM' -10^(-ΔpM') ] / √(cMsp·K') 。
这里的ΔpM' 是终点时金属离子浓度的对数差值,cMsp 是计量点时金属离子的浓度。
举个例子,如果在滴定锌离子时,终点时的ΔpM' 计算有误,那最终得出的终点误差就会偏差很大,可能导致整个实验结果都不靠谱。
还有一个很重要的公式,就是金属离子能被准确滴定的判别式。
当cM·K' ≥ 10^6 时,金属离子才能被准确滴定。
这个判别式就像是一个门槛,达不到的话,实验结果的准确性可就没保障啦。
就像那次实验中的小王同学,因为没搞清楚这个判别式,着急忙慌地就开始实验,结果可想而知,数据乱七八糟,还得重新来过。
在实际应用中,咱们要根据具体的实验条件和要求,灵活运用这些公式。
可别死记硬背,得理解其中的原理。



第六章 思考题与习题1. 填空〔1〕 EDTA 是一种氨羧络合剂,名称,用符号表示,其结构式为。
配制标准溶液时一般采用EDTA 二钠盐,分子式为,其水溶液pH 为,可通过公式进展计算,标准溶液常用浓度为。
〔2〕 一般情况下水溶液中的EDTA 总是以等型体存在,其中以与金属离子形成的络合物最稳定,但仅在时EDTA 才主要以此种型体存在。
除个别金属离子外。
EDTA 与金属离子形成络合物时,络合比都是。
〔3〕 K /MY 称,它表示络合反响进展的程度,其计算式为。
〔4〕 络合滴定曲线滴定突跃 的大小取决于。
在金属离子浓度一定的条件下,越大,突跃;在条件常数K /MY 一定时,越大,突跃 。
〔5〕 K /MY 值是判断络合滴定误差大小的重要依据。
在pM /一定时,K /MY 越大,络合滴定的准确度。
影响K /MY 的因素有,其中酸度愈高愈大,lg /MY;的络合作用常能增大,减小。
在K /MY 一定时,终点误差的大小由决定,而误差的正负由决定。
〔6〕 在[H +]一定时,EDTA 酸效应系数的计算公式为。
解:〔1〕 EDTA 是一种氨羧络合剂,名称 乙二胺四乙酸 ,用符号 H 4Y 表示,其结构式为HOOCCH 2-OOCCH2CH 2COO -2COOH++HN CH 2CH 2NH。
配制标准溶液时一般采用EDTA二钠盐,分子式为O H Y H Na 2222⋅,其水溶液pH 为 4.4 ,可通过公式54][a a K K H ⋅=+进展计算,标准溶液常用浓度为•L -1。
〔2〕 一般情况下水溶液中的EDTA 总是以 H 6Y 2+、H 5Y +、H 4Y 、H 3Y -、H 2Y 2-、HY 3-和Y 4-等 七种 型体存在,其中以 Y 4-与金属离子形成的络合物最稳定,但仅在pH ›10时EDTA 才主要以此种型体存在。
除个别金属离子外。
EDTA 与金属离子形成络合物时,络合比都是1∶1。
〔3〕 K /MY 称 条件形成常数 ,它表示 一定条件下 络合反响进展的程度,其计算式为Y M MY MY K K ααlg lg lg lg /--=。
滴定分析中的误差及数据处理滴定分析是将已知准确浓度的标准溶液滴加到被测物质的溶液中直至所加溶液物质的量按化学计量关系恰好反应完全,然后根据所加标准溶液的浓度和所消耗的体积,计算出被测物质含量的分析方法。
包括酸碱滴定法、配位滴定法、氧化还原滴定法、沉淀滴定法。
滴定分析时产生的误差被分为系统误差和随机误差。
系统误差是在相同条件下,对同一对象进行多次测量,有一种绝对值和符号不变,或按某一规律变化的误差,称为系统误差。
系统误差由分析测量过程中确定性的影响因素所产生的,具有重复性、单向性和可测性。
产生系统误差的原因有一下几种:(1)方法误差。
方法误差是由于分析方法本身在理论上和具体操作步骤上存在不完善之处。
如反应不完全或存在副反应,指示剂的变色点不与化学计量点重合。
(2)仪器和试剂误差仪器误差来源于一起本身的缺陷或没有按照规定使用仪器。
如仪器检查不彻底,滴定管漏液;滴定管、移液管使用前没有润洗而锥形瓶误被润洗;注入液体后滴定管下端留有气泡;读数时滴定管、移液管等量器与水平面不垂直、液面不稳定、仰视(或俯视)刻度;液体温度与量器所规定的温度相差太远;移液时移液管中液体自然地全部流下。
标准溶液误差①标准溶液浓度的大小造成的误差来源。
滴定所需标准溶液体积的大小,滴定管读数的相对误差较大。
一般使用的体积控制在20mL~24mL的范围内,使滴定管的读数误差不大于1‰,为此应使用适当浓度的标准溶液,从而控制标准溶液的体积。
②标准溶液的配制不规范造成的误差来源。
终点误差(指示剂误差)①指示剂用量过多或浓度过大,使其变色迟钝,同时指示剂本身也能多消耗滴定剂。
②强酸滴定强碱时,用酚酞作指示剂。
③强酸滴定弱碱时因生成的盐水解,等当点时溶液显酸性。
同理强碱滴定弱酸在等当点时溶液呈碱性。
若指示剂选用不当,等当点与滴定终点差距大,则产生误差。
(3)操作误差操作误差通常是由于分析人员没有按正确的操作规程进行分析操作引起。
操作方面误差可能有以下几点:①滴定中左手对酸式滴定管旋塞控制不当,旋塞松动导致旋塞处漏液;使用碱式滴定管时,左手拿住橡皮管中玻璃球用力挤压或按玻璃球以下部位,导致放手时空气进入出口管形成气泡。