1.3 原子内电子的排布
- 格式:pdf
- 大小:660.01 KB
- 文档页数:29

原子核外电子排布教案第一章:引言1.1 学习目标:了解原子核外电子排布的概念及其重要性。
掌握电子的基本性质和电子云的概念。
1.2 教学内容:介绍原子的基本结构,包括原子核和核外电子。
解释电子的基本性质,如负电荷、量子化等。
引入电子云的概念,解释其表示电子分布的方式。
1.3 教学活动:通过图片和示例介绍原子的基本结构。
利用动画演示电子的基本性质。
引导学生思考为什么电子不能随意分布在原子核周围。
1.4 作业与评估:设计一些简答题,让学生回答关于电子基本性质的问题。
让学生绘制简单的电子云示意图。
第二章:电子分层排布2.1 学习目标:掌握电子在原子核外的分层排布规律。
了解不同层上的电子数量限制。
2.2 教学内容:介绍电子的分层排布规律,包括K层、L层、M层等。
解释每个层上的电子数量限制,如K层最多容纳2个电子。
2.3 教学活动:通过示例和图解展示电子的分层排布。
引导学生理解电子在不同层上的排布规律。
2.4 作业与评估:设计一些填空题,让学生填写不同层上的电子数量限制。
让学生根据给定的原子核,绘制其电子的分层排布图。
第三章:电子亚层排布3.1 学习目标:掌握电子在同一层内的亚层排布规律。
了解不同亚层的名称和特点。
3.2 教学内容:介绍电子在同一层内的亚层排布规律,包括s亚层、p亚层、d亚层等。
解释不同亚层的名称和特点,如s亚层具有较低的能量。
3.3 教学活动:通过示例和图解展示电子在同一层内的亚层排布。
引导学生理解不同亚层的排布规律和特点。
3.4 作业与评估:设计一些选择题,让学生区分不同亚层的名称和特点。
让学生根据给定的原子核,绘制其电子的亚层排布图。
第四章:电子自旋排布4.1 学习目标:掌握电子自旋排布的规则。
了解电子自旋量子数和自旋状态。
4.2 教学内容:介绍电子自旋排布的规则,如泡利不相容原理、洪特规则等。
解释电子自旋量子数和自旋状态的概念。
4.3 教学活动:通过示例和图解展示电子自旋排布的规则。
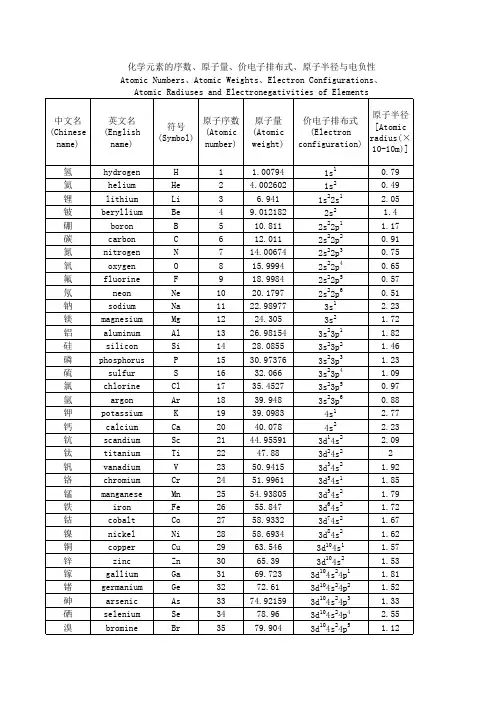

化学前36号元素电子排布式和简式化学前36号元素电子排布式和简式是一种通过绘制电子排布式图或简式来表示元素在原子中的电子排布情况的方法。
排布式图可以准确地描述原子内电子在不同能量等级上的排布情况,而简式可以提供一个有限的、容易理解的定性描述。
化学前36号元素电子排布式及简式如下:氢(H):排布式:1s1,简式:1氦(He):排布式:1s2,简式:2锂(Li):排布式:1s22s1,简式:2.1硼(B):排布式:1s22s22p1,简式:2.3碳(C):排布式:1s22s22p2,简式:2.4氮(N):排布式:1s22s22p3,简式:2.5氧(O):排布式:1s22s22p4,简式:2.6氟(F):排布式:1s22s22p5,简式:2.7氖(Ne):排布式:1s22s22p6,简式:2.8钠(Na):排布式:1s22s22p63s1,简式:2.8.1镁(Mg):排布式:1s22s22p63s2,简式:2.8.2铝(Al):排布式:1s22s22p63s23p1,简式:2.8.3磷(P):排布式:1s22s22p63s23p3,简式:2.8.5硫(S):排布式:1s22s22p63s23p4,简式:2.8.6氯(Cl):排布式:1s22s22p63s23p5,简式:2.8.7 氩(Ar):排布式:1s22s22p63s23p6,简式:2.8.8 钾(K):排布式:1s22s22p63s23p64s1,简式:2.8.8.1钙(Ca):排布式:1s22s22p63s23p64s2,简式:2.8.8.2钡(Ba):排布式:1s22s22p63s23p64s23d1,简式:2.8.8.2.1铁(Fe):排布式:1s22s22p63s23p64s23d6,简式:2.8.8.2.6锌(Zn):排布式:1s22s22p63s23p64s23d10,简式:2.8.8.2.10铜(Cu):排布式:1s22s22p63s23p64s13d10,简式:2.8.8.3.10氯(Br):排布式:1s22s22p63s23p65s1,简式:2.8.8.4氪(Kr):排布式:1s22s22p63s23p65s24d5,简式:2.8.8.4.52.8.9.2钯(Pd):排布式:1s22s22p63s23p64d10,简式:2.8.10铑(Rh):排布式:1s22s22p63s23p64d86s1,简式:2.8.10.1铱(Ir):排布式:1s22s22p63s23p64d106s2,简式:2.8.10.2铂(Pt):排布式:1s22s22p63s23p64d106s26f1,简式:2.8.10.2.6金(Au):排布式:1s22s22p63s23p64d105f14,简式:2.8.10.2.5锡(Sn):排布式:1s22s22p63s23p64d105f46s2,简式:2.8.10.2.5.6锑(Sb):排布式:1s22s22p63s23p64d105f26d1,简式:2.8.10.2.5.2碲(Te):排布式:1s22s22p63s23p64d105f26d2,简式:2.8.10.2.5.2碘(I):排布式:1s22s22p63s23p64d105f46d17s1,简式:2.8.10.2.5.6.7砹(At):排布式:1s22s22p63s23p64d105f76d17s2,简式:2.8.10.2.5.7.7氙(Xe):排布式:1s22s22p63s23p64d105f76d17s2,简式:2.8.10.2.5.7.7 氖(Rn):排布式:1s22s22p63s23p64d105f86d18s2,简式:2.8.10.2.5.8.8 钍(Tl):排布式:1s22s22p63s23p64d105f146d2,简式:2.8.10.2.5.14.2铯(Cs):排布式:1s22s22p63s23p65s24d105f146d17s1,简式:2.8.10.3.14.6.7铵(Fr):排布式:1s22s22p63s23p64f145d106s27p1,简式:2.8.11.1.5.6.7 钇(Y):排布式:1s22s22p63s23p64d104f14,简式:2.8.12铒(Er):排布式:1s22s22p63s23p64d104f145d1,简式:2.8.12.1铥(Dy):排布式:1s22s22p63s23p64d104f145d16s2,简式:2.8.12.1.5.6 镤(Pu):排布式:1s22s22p63s23p64d104f145d106s4,简式:2.8.12.1.5.10.4以上就是化学前36号元素的电子排布式和简式。

元素周期表价层电子排布式元素周期表是化学中用来组织化学元素的工具,根据元素的原子序数按照规律排列。
每个元素都有自己的电子排布式,即电子在原子内的分布情况。
电子排布式分为两部分:价层电子和内层电子。
价层电子指的是原子的层次,从外向内编号为1、2、3……层。
每一层由一个以上的电子组成,并且由于电子间的相互作用,同一层的电子会形成一个电子云。
内层电子指的是原子的轨道,从内向外编号为1、2、3……轨道。
每个轨道都有自己的能量级,并且可以容纳一定数量的电子。
在元素周期表中,通常会根据价层电子的数量将元素分为几大族,如金属族、半金属族、非金属族等。
而内层电子的数量则决定了元素的化学性质。
例如,同一族的元素通常会有相似的化学性质。
此外,元素周期表还可以帮助我们理解元素的化合反应规律。
例如,对于非金属元素来说,通常会接受电子而成为负离子;而对于金属元素来说,通常会损失电子而成为正离子。
总之,元素周期表是一种重要的化学工具,能够帮助我们理解元素的电子排布式和化学性质,以及元素之间的化合反应规律。

教案《原子核外电子的排布》第一章:引言1.1 教学目标让学生了解原子核外电子排布的概念和重要性。
让学生掌握原子核外电子排布的基本原理。
1.2 教学内容原子核外电子的定义和特点。
原子核外电子排布的意义和应用。
1.3 教学方法讲授法:讲解原子核外电子的定义和特点。
提问法:引导学生思考原子核外电子排布的意义和应用。
第二章:电子云和原子轨道2.1 教学目标让学生了解电子云的概念和特性。
让学生掌握原子轨道的定义和分类。
2.2 教学内容电子云的定义和特性。
原子轨道的定义和分类。
2.3 教学方法讲授法:讲解电子云的概念和特性。
提问法:引导学生思考原子轨道的定义和分类。
第三章:泡利不相容原理3.1 教学目标让学生了解泡利不相容原理的内容和意义。
让学生掌握泡利不相容原理在电子排布中的应用。
3.2 教学内容泡利不相容原理的内容和意义。
泡利不相容原理在电子排布中的应用。
3.3 教学方法讲授法:讲解泡利不相容原理的内容和意义。
举例法:通过具体例子引导学生掌握泡利不相容原理在电子排布中的应用。
第四章:能量最低原理4.1 教学目标让学生了解能量最低原理的概念和意义。
让学生掌握能量最低原理在电子排布中的应用。
4.2 教学内容能量最低原理的概念和意义。
能量最低原理在电子排布中的应用。
4.3 教学方法讲授法:讲解能量最低原理的概念和意义。
举例法:通过具体例子引导学生掌握能量最低原理在电子排布中的应用。
第五章:洪特规则5.1 教学目标让学生了解洪特规则的内容和意义。
让学生掌握洪特规则在电子排布中的应用。
5.2 教学内容洪特规则的内容和意义。
洪特规则在电子排布中的应用。
5.3 教学方法讲授法:讲解洪特规则的内容和意义。
举例法:通过具体例子引导学生掌握洪特规则在电子排布中的应用。
第六章:电子排布的表示方法6.1 教学目标让学生了解电子排布的表示方法。
让学生掌握电子排布图和电子排布式的书写。
6.2 教学内容电子排布图的定义和表示方法。
电子排布式的定义和表示方法。

高中化学原子核外电子排布原子的组成由原子核和电子构成。
原子核位于原子的中心,由质子和中子组成。
而原子核外围则存在着一定数量的电子。
这些外电子的排布方式对于原子的性质和化学反应具有重要影响。
本文将介绍高中化学中原子核外电子的排布规律及其相关知识。
1. 电子排布的原则每个原子的电子排布遵循一定的规律和原则。
其中最为重要的是以下三个原则:1.1. 伯利兹定则伯利兹定则(Bau rule)表明,电子从低能量轨道开始填充。
这意味着在填满外电子壳层时,首先填充内层能量较低的轨道,然后逐渐填满能量较高的轨道。
简单来说,电子排布的顺序是由内向外进行。
1.2. 阿尔尼奥定则阿尔尼奥定则(Aufbau rule)指出,电子填充各能级轨道时,要优先填充能量最低的轨道。
在每个能级轨道中,需要先填满低能量的子能级,然后再填充高能量的子能级。
这样可以保证整个原子结构的稳定性。
1.3. 保里排除原理保里排除原理(Pauli exclusion principle)规定,每个轨道最多只能容纳两个电子,并且这两个电子的自旋要相反。
也就是说,同一个轨道上的两个电子必须具有相反的自旋角动量。
2. 原子核外电子层和子层原子核外的电子都存在于各种能级的轨道中。
高中化学通常会涉及到以下几个电子层和子层:2.1. 电子层电子层是指位于原子核外部的能级,用字母表示(K、L、M、N、O、P、Q)。
K层最接近原子核,能量最低,因此分布的电子最少。
随着电子层数的增加,能量逐渐升高,电子数也逐渐增多。
2.2. 子层子层是电子层内部的能级,用字母和数字表示(s、p、d、f、g、h)。
s子层能量最低,容纳电子数最少;p子层次之;d子层再次增加;f子层电子数最多。
3. 原子核外电子排布的案例分析以下是几种常见原子核外电子排布的案例分析:3.1. 氢原子(H)氢原子只有一个质子和一个电子,根据伯利兹定则和阿尔尼奥定则,电子会填充能量最低的1s轨道。
3.2. 氦原子(He)氦原子有两个质子和两个中子,根据伯利兹定则和阿尔尼奥定则,前两个电子会填充1s轨道。

前三十六号元素价层电子排布式1.氢(H)的电子配置为1s^1,其中的1表示电子所在的能级(层),s表示轨道类型,上标1表示轨道中只有一个电子。
2.氦(He)属于2族元素,它的电子配置为1s^23.锂(Li)属于3族元素,它的电子配置为1s^22s^14.铍(Be)属于4族元素,它的电子配置为1s^22s^25.硼(B)属于5族元素,它的电子配置为1s^22s^22p^16.碳(C)属于6族元素,它的电子配置为1s^22s^22p^27.氮(N)属于7族元素,它的电子配置为1s^22s^22p^38.氧(O)属于8族元素,它的电子配置为1s^22s^22p^49.氟(F)属于9族元素,它的电子配置为1s^22s^22p^510.氖(Ne)属于10族元素,它的电子配置为1s^22s^22p^6从11到18号元素,它们的电子配置均符合2s层和2p层的填充顺序:11.钠(Na)属于11族元素,它的电子配置为1s^22s^22p^63s^112.镁(Mg)属于12族元素,它的电子配置为1s^22s^22p^63s^213.铝(Al)属于13族元素,它的电子配置为1s^22s^22p^63s^23p^114.硅(Si)属于14族元素,它的电子配置为1s^22s^22p^63s^23p^215.磷(P)属于15族元素,它的电子配置为1s^22s^22p^63s^23p^316.硫(S)属于16族元素,它的电子配置为1s^22s^22p^63s^23p^417.氯(Cl)属于17族元素,它的电子配置为1s^22s^22p^63s^23p^518.氩(Ar)属于18族元素,它的电子配置为1s^22s^22p^63s^23p^6从19到36号元素,它们的电子配置符合3s层、3p层和3d层的填充顺序:19.钾(K)属于19族元素,它的电子配置为1s^22s^22p^63s^23p^64s^120.钙(Ca)属于20族元素,它的电子配置为1s^22s^22p^63s^23p^64s^221.钪(Sc)属于21族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^122.钛(Ti)属于22族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^223.钒(V)属于23族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^324.铬(Cr)属于24族元素,它的电子配置为1s^22s^22p^63s^23p^64s^13d^51s^22s^22p^63s^23p^64s^23d^526.铁(Fe)属于26族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^627.钴(Co)属于27族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^728.镍(Ni)属于28族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^829.铜(Cu)属于29族元素,它的电子配置为1s^22s^22p^63s^23p^64s^13d^10。

原子结构知识:原子的电子布居规则原子结构知识:原子的电子布居规则原子是由原子核和围绕在核周围的电子组成的基本结构单元。
原子内的电子数量和排列方式决定了化学元素的属性。
在原子结构的研究中,原子的电子布居规则是非常重要的一个概念。
本文将为大家介绍原子的电子布居规则及其一些重要原理。
1.布居规则的历史背景早在19世纪初期,化学家们就已经开始了原子结构的研究。
当时,最先提出原子结构模型的是英国化学家道尔顿,他认为原子是一个不可分割的小球体。
随后,汤姆逊发现了电子,这个小球体模型受到了挑战,化学家们认识到原子并不是一个不可分割的实体。
于是乎,另一位英国化学家里瑟福又提出了原子为一个带正电荷的核和围绕核运动的电子的模型。
随着原子结构的研究的深入,化学家们发现原子内的电子并不是随意排布的,而是有一定的规律。
这些规律便被整理成原子的电子布居规则。
2.电子布居规则的基本原理电子在原子内的位置是由其能量级别决定的,即越靠近原子核的能级越低,越远离核的能级越高。
根据这个原理,我们可以得出以下电子布居规则:2.1.泡利不相容原理泡利不相容原理是最基本的电子布居规则之一。
其表述为:在同一原子内,不能有两个电子的四个量子数都相同。
这意味着每个电子在原子内必须有其独特的位置。
2.2.奥卡规则奥卡规则是指电子在原子内的填充应遵循最低能量原理,即先填充最低能量的轨道。
2.3.求和原理每个能级的电子数量等于其对应的主量子数的平方。
例如,第一能级能够容纳的电子数是2,第二能级能够容纳的电子数就是4,第三能级能够容纳的电子数是9,以此类推。
2.4.光谱线的解释原子内的电子被束缚在离核的轨道中,并在其他轨道之间跃迁。
当电子受到能量激励时,它会跃迁到更高能级的轨道上。
当电子跃迁回原来的能级时,它会释放出一个能量与频率相对应的光子。
因此,光谱线可以用来解释原子内电子的跃迁和能级结构。
3.电子布居规则的应用电子布居规则可以应用于各种化学和物理领域,如量子力学、原子能和亚原子化学等。



1.3元素周期表的应用一、选择题(本题共23道小题,每小题2分,共46分)1.不能作为判断硫、氯两种元素非金属性强弱的依据是A. 单质氧化性的强弱B. 单质沸点的高低C. 单质与氢气化合的难易D. 最高价氧化物对应的水化物酸性的强弱2.下列元素中原子半径最小的是A. CB. NC. OD. F3.下表所示为部分短周期元素的原子半径及主要化合价,以下叙述错误的是A. A、B的单质与稀盐酸反应速率A>BB. D、E形成单质的氧化性D2>E2C. A单质着火时,可以用干粉灭火D. 最高价氧化物对应的水化物的酸性 H2CO4<HEO44.下列各组性质比较中,错误的是A. 热稳定性: SiH4< PH3 < NH3B. 沸点: H2O > H2Se > H2SC. 离子的还原性: Cl- < Br- < I-D. 最高化合价: N < O < F5.X、Y、Z为短周期非金属元素,其相关性质如下:下列叙述正确的是()A. 非金属性:Z<X<YB. 气态氢化物稳定性:Z>Y>XC. 最高价氧化物对应水化物的酸性:X>Z>YD. Y、Z的氢化物能反应形成离子化合物6.下列物质的性质比较,正确的是()A. 气态氢化物稳定性:HF>HCl>H2SB. 碱性:NaOH>KOH>RbOHC. 还原性强弱: F- > Cl- > Br- > I-D. 酸性:H2SO4>HClO4>HBrO47.已知X、Y、Z、T、W是短周期中原子序数依次增大的5种主族元素,其中X、T同主族,X与Y形成的简单气态化合物能使湿润的红色石蕊试纸变蓝,Z原子的最外层电子数是电子层数的3倍,W是一种重要的半导体材料。
下列说法正确的是A. 原子半径: X<Y<Z<TB. Y元素的含氧酸都属于强酸C. Z、T和W三种元素形成的化合物的水溶液呈碱性D. 元素Z、T组成的化合物中阴阳离子个数之比为2∶18.短周期元素W、X、Y、Z 的原子序数依次增大,四种元素的原子最外层电子数总和为17。
《材料科学基础》教学大纲四年制本科材料科学与工程专业用80 学时 4 学分一、课程性质和任务《材料科学基础》是材料科学方法与工程专业一级学科公共主干课,是介于一般基础课与专业课之间的专业基础课。
本课程将系统全面介绍材料科学的基础理论知识,诸如固体材料的结合键,材料的结构与性能,材料中的扩散,材料的相变,材料的塑性变形与强化,以及材料科学研究方法等,将金属材料、无机非金属材料、聚合物材料紧密地结合在一起,使学生更好地把握材料的属性,熟悉材料的共性,为后继课程的学习、进一步深造和从事科技工作奠定基础。
二、课程学习的目标和基本要求:1.对能力培养的要求通过学习,要求学生掌握材料组织结构—成分—工艺—性能相互关系的基本规律和基本理论,深入理解材料组织结构—成分—工艺—性能相互关系,培养学生应用所学的知识,分析、解决材料研究、开发和使用中实际问题的能力。
初步掌握材料科学研究的思路和方法,为后续课程的学习和进一步深造奠定理论基础。
2 .课程的重点和难点本课程重点是料组织结构—成分—工艺—性能相互关系的基本规律和基本理论,如材料结构与缺陷,材料凝固与相图,塑性变形与强韧化等,并能应用所学的理论分析和解决实际问题。
难点是材料结构,位错理论,合金凝固,二元相图,三元相图,材料强韧化,晶体塑性变形等,3 .先修课程及基本要求无机化学、物理化学、材料力学三、课程内容及学时分配•教学基本内容第一章材料的结构( 22 学时)1.1 晶体学基础1.2 常见的晶体结构1.3 固溶体的晶体结构1.4 金属间化合物的晶体结构1.5 硅酸盐结构1.6 非晶态固体结构1.7固体的电子能带结构理论1.8 团簇与纳米材料结构1.9 准晶结构本章重点:•结晶学基础知识 (晶体的概念与性质、晶体宏观对称要素、晶体定向、•单位平行六面体的划分、配位数与配位多面体的概念、鲍林规则 )。
•常见材料的结构理论与模型(常见无机化合物的晶体结构、硅酸盐晶体结构分类及特征、固溶体晶体结构类型及影响因素、缺陷化学反应表示法、金属间化合物的结构类型及影响因素,玻璃的结构)。
元素周期表中元素的电子排布规律元素周期表是化学中最基础且最重要的工具之一,它按照元素的原子序数、原子结构和化学性质的规律排列了所有已知元素。
元素的电子排布规律是元素周期表的核心内容之一,其中包含了电子分布的规则和原则。
本文将详细介绍元素电子排布的规律,以及这些规律背后的科学原理。
一、原子结构和电子排布简介在了解元素的电子排布规律之前,我们首先需要了解元素的原子结构。
一个原子由质子(位于原子核中,带正电荷)、中子(位于原子核中,无电荷)和电子(位于原子外层,带负电荷)组成。
原子的质子数和电子数相等,而中子数量可以变化。
电子排布指的是电子在原子中的分布方式,可以分为核心电子和价电子。
核心电子指的是位于原子核内的电子,它们的能量较低,不参与化学反应。
价电子指的是位于原子外层的电子,它们的能量较高,决定了元素的化学性质。
二、奥布规则奥布规则是描述电子排布的基本原则之一。
根据奥布规则,电子在原子中的排布方式遵循“低能量优先,同能量填满,电子自旋相反”的原则。
具体来说,奥布规则可以总结为以下三条:1. 质子数增加时,电子会按照能量顺序填充最低能量的轨道,也就是说,电子首先填充1s轨道,然后依次填充2s、2p、3s、3p等轨道。
2. 同一轨道的电子填充时,会尽量让每个轨道填充一个电子,直到轨道的容纳电子的数量达到最大值为止。
这种填充方式称为洪特定则。
3. 每个电子都具有自旋,自旋的方向有两种可能,分别表示为上自旋和下自旋。
按照奥布规则,每个轨道填充一个电子时,上自旋和下自旋的电子数量应该尽量相等。
奥布规则的应用使得元素的电子排布变得有序和可预测,为化学研究和元素性质的理解提供了重要的基础。
三、朗道规则朗道规则是描述电子排布的另一个重要原则。
根据朗道规则,电子在填充轨道时,会尽量使轨道的总角动量(包括轨道角动量和自旋角动量)取最小能量。
朗道规则可以概括为以下三个原则:1. 在一个主量子数n相同的壳层中,总角动量为零的子壳层会比总角动量不为零的子壳层更稳定。