氧气的制取与性质实验报告
- 格式:docx
- 大小:86.98 KB
- 文档页数:2
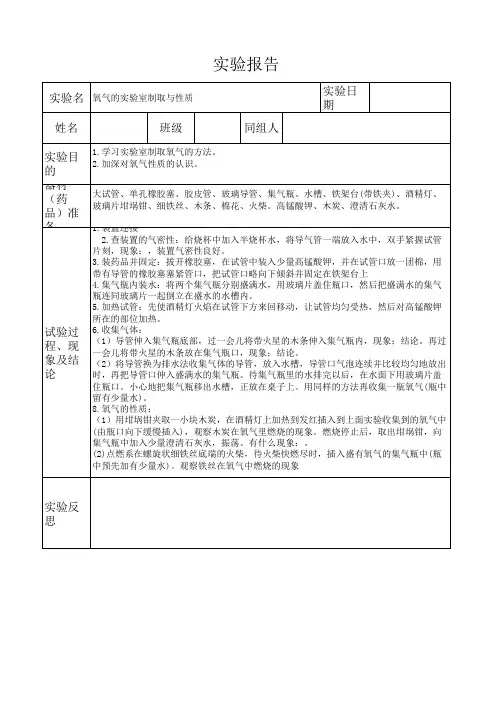

第1篇实验名称:氧气制取实验实验日期:____年__月__日实验地点:____实验室实验目的:1. 掌握实验室制取氧气的方法。
2. 理解氧气的物理和化学性质。
3. 学会使用排水法收集氧气。
4. 熟悉实验操作步骤和注意事项。
实验原理:氧气是一种无色、无味的气体,不易溶于水。
在实验室中,可以通过以下两种方法制取氧气:1. 加热高锰酸钾(KMnO4)分解:2KMnO4 → K2MnO4 + MnO2 + O2↑2. 加热氯酸钾(KClO3)与二氧化锰(MnO2)的混合物:2KClO3 →2KCl + 3O2↑实验器材:1. 高锰酸钾2. 氯酸钾3. 二氧化锰4. 试管5. 铁架台6. 导气管7. 集气瓶8. 酒精灯9. 水槽10. 橡皮塞11. 棉花12. 燃烧匙13. 火柴14. 澄清石灰水15. 托盘天平16. 称量纸17. 药匙实验步骤:一、加热高锰酸钾制取氧气1. 将高锰酸钾放入试管底部,用橡皮塞塞紧试管口,并在塞子中插入导气管。
2. 用铁架台固定试管,使试管口略向下倾斜。
3. 点燃酒精灯,加热试管底部的高锰酸钾。
4. 观察到高锰酸钾由紫色变为黑色,产生气泡。
5. 将集气瓶倒置在水槽中,用导管将氧气导入集气瓶中。
6. 收集满氧气后,将导管从水槽中取出,用毛玻璃片盖住集气瓶口。
二、加热氯酸钾与二氧化锰混合物制取氧气1. 称取适量的氯酸钾和二氧化锰,混合均匀。
2. 将混合物放入试管底部,用橡皮塞塞紧试管口,并在塞子中插入导气管。
3. 用铁架台固定试管,使试管口略向下倾斜。
4. 点燃酒精灯,加热试管底部混合物。
5. 观察到混合物由白色变为黑色,产生气泡。
6. 将集气瓶倒置在水槽中,用导管将氧气导入集气瓶中。
7. 收集满氧气后,将导管从水槽中取出,用毛玻璃片盖住集气瓶口。
实验现象:1. 加热高锰酸钾时,高锰酸钾由紫色变为黑色,产生气泡,收集到的气体为氧气。
2. 加热氯酸钾与二氧化锰混合物时,混合物由白色变为黑色,产生气泡,收集到的气体为氧气。

氧⽓的性质与制备实验报告MnO2氧⽓的制备与性质实验探究报告⼀实验⽬的1、熟悉实验室制取氧⽓的反应原理,掌握实验室制取和收集氧⽓的⽅法及其性质实验的操作技巧。
2、初步掌握本实验的演⽰教学⽅法。
3、练习药品的取⽤及装置⽓密性检查。
⼆实验原理我们都知道,约占空⽓体积1/5的氧⽓与⼈类的⽣活、⽣产有着很密切的关系,是⼈类维持⽣命不可缺少的物质,动物和植物的⽣存也都离不开氧⽓。
在通常情况下,O2为⽆⾊⽆味的⽓体。
在标准情况下,O2⽐空⽓的密度⼤。
不易溶于⽔(每升⽔溶解O2约30ml)氧⽓的化学性质很活泼。
它不仅可以助燃,⽽且在点燃或⾼温条件下可以和⼤多数⾦属(如铁、镁)、⾮⾦属(⽊炭、硫、磷、和⽯蜡等)发⽣反应,放出⼤量的热。
2KMnO4===K2MnO4 + MnO2 + O2↑2H2O2 === 2H2O+O2↑三仪器、材料与药品硬质⼤试管、锥形瓶、分液漏⽃、单孔橡⽪塞、酒精灯、⽕柴、垫⽊、⽔槽、集⽓瓶、蒸发⽫、研钵、⽑玻璃⽚、橡⽪软管、铁架台、玻璃棒、钥匙、脱脂棉、托盘天平、燃烧匙、·⼤烧杯、坩埚钳、砂纸、试管及试管架;KMnO4、10﹪H2O2、硫磺、⽊炭、铁丝、蜡烛、澄清⽯灰⽔。
四实验内容⑴KMnO4加热分解法2KMnO4===K2MnO4 + MnO2 + O2↑实验步骤①----按照下图组装好仪器组装仪器的顺序是从上到下,从左到右。
注意:试管⼝略向下倾斜约15度。
②----检查装置的⽓密性⽤⼿握住试管(或⽤热⽑⼱捂住试管),若有⽓泡冒出则证明装置的⽓密性良好。
③----装药品由于KMnO4是固体药品,所以纸槽装好KMnO4,缓缓倒⼊试管中。
④----把试管固定到铁架台上注意将将试管固定在1/3处。
⑤----点燃酒精灯加热确保酒精灯内的酒精约为1/4—2/3。
先预热。
注意,让试管均匀受热,否则会因冷热不均炸裂试管。
⑥----收集⽓体(可以使⽤排⽔法、向上排空法)⑦----把导⽓管从⽔槽中取出如果使⽤向上排空法,此步骤基本不需要,但是最好先取出导管在盖上玻⽚。

氧气的制备与性质一、实验原理 1.氧气的性质在通常情况下,O 2为无色无味的气体。
在标准情况下,O 2比空气的密度大。
不易溶于水(每升水溶解O 2约30ml ),氧气的化学性质很活泼。
它不仅可以助燃,而且在点燃或高温条件下可以和大多数金属(如铁、镁)、非金属(木炭、硫、磷、和石蜡等)发生反应,放出大量的热。
2、制法主要方法:(1)过氧化氢法:2H 2O 22MnO ===2H 2O+O 2↑(2)高锰酸钾法:2KMnO 4∆===K 2MnO 4+MnO 2+O 2↑ (3)氯酸钾法:2KClO 32MnO ∆===2KCl+3O 2↑其他方法:(4)氧化汞法:2HgO ∆===2Hg+ O 2↑(汞蒸气有毒,不采用)( 5)过氧化钠法:Na 2O 2+2H 2O===4NaOH+ O 2↑(原料昂贵一般不采用) 2 Na 2O 2+2CO 2===2Na 2CO 3+ O 2二、实验操作过程与实验现象 1、O 2的制取与收集(1 )加热分解高锰酸钾首先检查装置气密性。
取3g KMnO 4加入硬质大试管, 装置如上,管口放好脱脂棉,以防药品喷向试管口。
再准 备6只集气瓶装满水后一毛玻璃片横切瓶口盖住,不留水 泡,然后倒置于水槽中。
如图连接装置,点燃酒精灯后先 预热试管,后集中于试管中下部加热,待气泡快速均匀冒 出时开始收集,集气瓶口冒出第一个气泡时表示收集满, 以毛玻璃片盖住瓶口移出水面。
连续收集完后,先移除导 管再熄灭酒精灯,以防倒吸。
(2)催化分解H 2O 2如图连接实验装置,锥形瓶中加入0.5g MnO 2,瓶上加分液漏斗,分液漏斗中装入稀释过的H 2O 2(30%H 2O 2与水的体积比为3:1),控制滴加速度,收集气体。
2、O 2的性质(1)硫在氧气中燃烧取一只洁净的燃烧匙,放入黄豆粒大小的硫,酒精灯上加热至燃烧(此时发出微弱淡蓝色火焰),然后将燃烧匙慢慢深入盛满氧气的集气瓶,此时发出明亮蓝紫色火焰,并有刺激性气味的SO 2生成。

实验活动1 氧气实验室的制取与性质。
(3)木炭在氧气中的燃烧
①如下图所示,用坩埚钳
夹取一小块木炭,在酒精灯上加热到发红,观察现象。
②把点着的木炭由瓶口向下缓慢插入氧气瓶中,观察现象。
思考:为什么操作中要“由上而下缓慢伸入氧气瓶中”,而不是直接伸入瓶内?
③燃烧停止后,取出坩埚钳,木炭在空气中持续
放出
木炭在氧气中燃烧比在空气中燃烧得
发出
(4) 细铁丝在氧气中的燃烧
①把铁丝用砂纸打亮,然后绕
成螺旋状,一端系一根火柴,用坩埚钳夹住铁丝并点燃火柴,伸入盛有氧气的集气瓶中观察现象。
思考:为什么要将细铁丝绕成螺旋状?
②待火柴梗快要烧完时,将它们由上往下缓慢伸进盛有氧气的集气瓶(底部预留少量水)中,观察现象。
思考:
为什么要待火柴梗快要燃尽时,才将铁丝伸入盛有氧气的集气瓶中?
③燃烧停止后,用手轻轻触摸集气瓶靠近水面的外壁。
现象:感觉到:。

第1篇一、实验名称:初中氧气制造实验二、实验目的:1. 掌握实验室制取氧气的方法。
2. 了解氧气的性质及其应用。
3. 培养实验操作技能和科学探究能力。
三、实验原理:氧气是空气中的主要成分之一,约占空气总体积的21%。
在实验室中,我们可以通过加热高锰酸钾(KMnO4)来制取氧气。
高锰酸钾在加热条件下分解,生成锰酸钾(K2MnO4)、二氧化锰(MnO2)和氧气(O2)。
化学方程式为:2KMnO4 → K2MnO4 + MnO2 + O2↑四、实验器材:1. 高锰酸钾2. 铁架台3. 试管4. 导气管5. 集气瓶6. 酒精灯7. 水槽8. 橡皮塞9. 带火星的木条五、实验步骤:1. 检查装置气密性:将导管一端插入水中,另一端用橡皮塞塞紧试管口,用双手握住试管,观察导管内水柱变化。
若水柱上升,说明装置气密性良好。
2. 装入药品:取适量高锰酸钾放入试管中,用带导管的橡皮塞塞紧试管口。
3. 固定试管:将试管固定在铁架台上,使试管口略向下倾斜,药品平铺在试管底部。
4. 加热:点燃酒精灯,给试管加热,排出管内空气。
5. 收集氧气:用排水法收集氧气。
将集气瓶装满水倒扣于水槽中,待气泡连续均匀时,将导管伸入集气瓶中收集氧气。
6. 验证氧气:将带火星的木条伸入集气瓶中,若木条复燃,说明集气瓶中有氧气。
六、实验现象:1. 加热过程中,高锰酸钾逐渐由紫色变为黑色,产生大量气泡。
2. 气泡进入集气瓶中,集气瓶内氧气逐渐增多。
3. 将带火星的木条伸入集气瓶中,木条复燃。
七、实验结论:1. 实验成功制取了氧气。
2. 氧气能使带火星的木条复燃。
3. 氧气是空气中的主要成分之一,具有助燃性。
八、实验讨论:1. 实验过程中,为什么要使试管口略向下倾斜?答:使药品平铺在试管底部,防止加热时药品飞溅,确保实验安全。
2. 实验过程中,为什么要用排水法收集氧气?答:氧气不易溶于水,用排水法可以有效地收集氧气,避免氧气与空气混合。
3. 实验过程中,如何验证氧气已收集满?答:将带火星的木条伸入集气瓶中,若木条复燃,说明氧气已收集满。

氧气制取及其性质实验报告
实验报告:氧气制取及其性质
一、实验目的
1. 了解氧气的制取方法;
2. 研究和探究氧气的性质。
二、实验原理
氧气是一种无色、无味、绝不可再生的气体,它是许多物质燃烧的必需气体,同时也是支撑生物生命所必需的气体。
氧气可以通过氯酸钾与锰(IV)氧化物反应来制取。
三、实验步骤
1. 实验器材准备:氯酸钾、锰(IV)氧化物、干燥试管、梨形瓶、燃烧塞等;
2. 在干燥的试管中加入一定量的氯酸钾和锰(IV)氧化物;
3. 将试管倒置于盛有水的梨形瓶中,使试管口完全浸入水中;
4. 加热试管,观察气泡的产生;
5. 打开燃烧塞,在内部维持微弱的燃烧;
6. 将燃烧塞慢慢拔出,将梨形瓶盖紧,观察梨形瓶内的现象;
7. 观察氧气的性质,如燃烧、再燃烧、熄灭等。
四、实验结果与数据分析
1. 实验现象:在加热试管的过程中,观察到气泡的产生;打开燃烧塞,在内部可维持微弱的燃烧;关闭燃烧塞后,燃烧现象熄灭;
2. 实验数据:无。
五、实验结论
通过本实验,我们成功制取了氧气。
观察到氧气在燃烧过程中起到促进燃烧的作用,同时也能再次燃烧,但需要较强的点燃源,当点燃源被熄灭后,燃烧现象也会随之熄灭。
六、实验注意事项
1. 实验过程应注意安全,避免操作不当导致事故发生;
2. 在进行氧气制取实验时,应控制好反应温度,避免过高温度引发危险;
3. 实验器材应干燥,以避免氧气与水分子反应。


第1篇一、实验目的1. 掌握实验室制取氧气的方法;2. 了解氧气的性质;3. 熟练操作实验仪器,提高实验技能。
二、实验原理1. 实验一:高锰酸钾制取氧气高锰酸钾在加热条件下分解,生成氧气、二氧化锰和锰酸钾。
反应方程式如下:2KMnO4 → K2MnO4 + MnO2 + O2↑2. 实验二:氯酸钾制取氧气氯酸钾在二氧化锰的催化作用下,加热分解生成氧气和氯化钾。
反应方程式如下:2KClO3 → 2KCl + 3O2↑三、实验仪器与药品1. 实验仪器:酒精灯、铁架台、铁夹、集气瓶、水槽、导管、试管、棉花、毛玻璃片、单口塞、燃烧匙、火柴等。
2. 实验药品:高锰酸钾、氯酸钾、二氧化锰、木炭、硫粉、红磷、铁丝、澄清石灰水等。
四、实验步骤1. 实验一:高锰酸钾制取氧气(1)将高锰酸钾装入试管,加入适量的二氧化锰,用棉花塞住试管口;(2)用铁夹将试管固定在铁架台上,试管口略向下倾斜;(3)点燃酒精灯,加热试管,待氧气产生后,用排水法收集氧气;(4)将收集到的氧气进行检验,观察其性质。
2. 实验二:氯酸钾制取氧气(1)将氯酸钾和二氧化锰混合均匀,装入试管;(2)用铁夹将试管固定在铁架台上,试管口略向下倾斜;(3)点燃酒精灯,加热试管,待氧气产生后,用排水法收集氧气;(4)将收集到的氧气进行检验,观察其性质。
五、实验现象1. 实验一:加热高锰酸钾时,试管内出现紫色晶体变为黑色,导管口有气泡冒出,集气瓶内氧气收集满后,带火星的木条复燃;2. 实验二:加热氯酸钾时,试管内出现白色晶体变为黑色,导管口有气泡冒出,集气瓶内氧气收集满后,带火星的木条复燃。
六、实验结论1. 高锰酸钾和氯酸钾在加热条件下都能分解产生氧气;2. 氧气是一种无色、无味、不易溶于水的气体,具有助燃性;3. 通过实验,掌握了实验室制取氧气的方法和氧气的性质。
七、实验注意事项1. 实验过程中,要注意安全,防止烫伤和爆炸;2. 加热试管时,要均匀受热,防止试管破裂;3. 收集氧气时,要保证集气瓶内无气泡,避免氧气收集不纯;4. 实验结束后,要及时熄灭酒精灯,清理实验器材。

O 2的实验室制法及性质验证一、 实验原理 1.O 2的制取反应:1) KMnO 4 在加热的条件下会分解产生O 2,并生成K 2MnO 4、MnO 2,反应方程式如下:2KMnO 4K 2MnO 4MnO 2+△O 2+2) KClO3在加热条件下并伴随MnO2的可以分解生成KCl 、O2,反应的方程式如下: 2KClO 32KCl 3O 2+△MnO 23) H 2O 2在MnO 2的催化作用下也可以生成H 2O 和O 2,化学反应方程式如下:2H 2O 2MnO 22H 2O O 2+4) 考虑到实验安全,本次实验只使用KMnO 4和H 2O 2分解制氧。
2.O 2的收集方法:1) 排水法:排水法收集气体,要求气体不溶于水或难溶于水;2) 排空气法:排空气法分为向上排空气法和向下排空气法,前者要求气体的密度大于空气平均密度,后者反之。
① 3.O 2化学的性质验证:1) O 2的物理性质:O 2是空气的组分之一,约占空气组分20.95%,无色、无臭、无味。
O 2比空气重,在标准状况(0℃和大气压强101325帕)下密度为1.429克/升,能溶于水,但溶解度很小。
在压强为101kPa 时,O 2在约-180摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
2) O 2的化学性质:O 2的化学性质比较活泼。
除了稀有气体、活性小的金属元素如金、铂、银之外,大部分的元素都能与氧起反应,这些反应称为氧化反应,而经过反应产生的化合物(有两种元素构成,且一种元素为氧元素)称为氧化物。
一般而言,非金属氧化物的水溶液呈酸性,而碱金属或碱土金属氧化物则为碱性。
此外,几乎所有的有机化合物,可在氧中剧烈燃生成CO 2与H 2O 。
化学上曾将物质与O 2发生的化学反应定义为氧化反应,氧化还原反应指发生电子转移或偏移的反应。
3) 本次实验主要通过观察金属Fe 、非金属C 和Si 以及石蜡在O 2中的燃烧的实验现象及反应产物来验证O 2支持燃烧的化学性质。

一、实验目的1. 掌握实验室制取氧气的方法。
2. 了解氧气的性质。
二、实验原理氧气是一种无色、无味的气体,在常温常压下不易溶于水。
实验室制取氧气的方法主要有两种:加热高锰酸钾和分解过氧化氢。
本实验采用加热高锰酸钾的方法制取氧气。
加热高锰酸钾的化学反应方程式为:2KMnO4 → K2MnO4 + MnO2 + O2↑三、实验器材1. 试管:1个2. 烧杯:1个3. 铁架台:1个4. 铁夹:1个5. 酒精灯:1个6. 水槽:1个7. 导气管:1根8. 集气瓶:1个9. 高锰酸钾:适量四、实验步骤1. 将高锰酸钾放入试管中,加入适量的水,搅拌均匀。
2. 将试管固定在铁架台上,用铁夹夹住试管口。
3. 将导气管插入试管底部,导气管另一端放入水槽中。
4. 点燃酒精灯,将火焰放在试管底部,加热试管。
5. 观察水槽中的气泡,当气泡连续、均匀地冒出时,开始收集氧气。
6. 收集满氧气后,将导气管从水槽中取出,熄灭酒精灯。
7. 将收集到的氧气倒入集气瓶中,观察氧气的性质。
五、实验现象1. 加热高锰酸钾时,试管底部出现紫色晶体。
2. 随着加热的进行,紫色晶体逐渐变成黑色。
3. 水槽中的气泡连续、均匀地冒出,收集到的气体为无色、无味。
六、实验结论1. 实验室制取氧气的方法可行,且操作简便。
2. 氧气是一种无色、无味的气体,不易溶于水,具有助燃性。
七、实验注意事项1. 实验过程中,要注意安全,防止烫伤。
2. 加热试管时,要均匀加热,避免试管炸裂。
3. 收集氧气时,要注意观察气泡,确保收集到的是氧气。
4. 实验结束后,要及时清理实验器材,保持实验室整洁。
八、实验拓展1. 尝试使用分解过氧化氢的方法制取氧气。
2. 探究氧气的化学性质,如助燃性、氧化性等。
3. 利用氧气进行相关实验,如氧气的溶解性、氧气与其他物质的反应等。
通过本次实验,我们掌握了实验室制取氧气的方法,了解了氧气的性质。
在实验过程中,我们应注意安全,遵守实验操作规程,培养严谨的科学态度。
第1篇一、实验目的1. 掌握实验室制取和收集氧气的方法。
2. 学习氧气的物理和化学性质,并验证其实验现象。
3. 了解氧气在实际应用中的重要性。
二、实验原理氧气(O2)是地球大气中的一种无色、无味、无臭的气体,是生命活动所必需的元素之一。
在实验室中,通常通过分解过氧化氢(H2O2)或加热高锰酸钾(KMnO4)等方法来制取氧气。
氧气的物理性质包括密度略大于空气,不易溶于水等。
氧气的化学性质包括助燃性和氧化性,能与多种物质发生反应。
三、实验仪器与材料1. 实验仪器:- 铁架台- 大试管- 单孔塞- 乳胶管- 弯管- 集气瓶- 火柴- 带火星的木条- 试管夹- 酒精灯- 水槽- 棉花- 高锰酸钾- 过氧化氢溶液2. 实验材料:- 高锰酸钾- 过氧化氢溶液- 水四、实验步骤1. 氧气的制备与收集- 将适量的高锰酸钾放入大试管中。
- 用试管夹固定试管,将一端带有乳胶管的单孔塞塞紧试管口。
- 将乳胶管另一端连接至弯管,弯管末端放入水槽中的集气瓶内。
- 将试管口略向下倾斜,用酒精灯加热试管底部。
- 观察气泡产生情况,待气泡均匀冒出时开始收集氧气。
2. 氧气的物理性质验证- 将收集到的氧气用排水法收集在集气瓶中。
- 观察氧气在集气瓶中的体积变化,记录氧气密度略大于空气的现象。
3. 氧气的化学性质验证- 将带火星的木条伸入集气瓶中,观察木条是否复燃。
- 将集气瓶中的氧气用排水法收集在另一集气瓶中,加入适量的过氧化氢溶液,观察氧气是否使过氧化氢溶液产生气泡。
五、实验现象1. 氧气的制备与收集- 加热高锰酸钾后,试管中产生大量气泡,氧气被收集在集气瓶中。
2. 氧气的物理性质验证- 氧气在集气瓶中的体积略大于空气。
3. 氧气的化学性质验证- 带火星的木条伸入集气瓶中,木条复燃,证明氧气具有助燃性。
- 加入过氧化氢溶液后,集气瓶中产生大量气泡,证明氧气具有氧化性。
六、实验结论1. 实验室成功制取并收集了氧气。
2. 验证了氧气的物理性质:密度略大于空气。
氧气的制法和性质一、实验原理1.高锰酸钾法: 424222KMnO K MnO MnO O ∆++=↑ 2.过氧化氢法:2222222MnO H O H O O =+↑3. 在通常状况下,O 2 为无色无味的气体。
在标准状况下,O 2 的密度(1.429g/L)比空气的平均密度(1.293g/L)大。
不易溶于水( 每升水溶解O 2 约30mL) 。
氧气的化学性质很活泼。
它不仅可以助燃,而且在点燃或高温条件下可以和大多数金属、非金属发生反应,放出大量热。
二、实验操作过程与实验现象1.氧气制备(1)KMnO 4加热分解制备法①组装实验装置如右图:②实验步骤:a 、检查装置气密性;b 、取7.5gKMnO 4加入硬质试管中(药品平铺在试管底部),管口放脱脂棉,塞进单孔塞;c 、点燃酒精灯后,先预热试管,然后集中在试管的中下部加热;d 、用排水法收集(氧气不溶于水)。
反应开始后,待气泡快速、均匀冒出时开始收集,此时整个装置中的空气已排尽,当集气瓶口冒出第一个气泡时,表示已集满,这时用毛玻璃片盖住瓶口,移除水面,如此连续收集两瓶;e 、实验结束后,先撤导管,后撤酒精灯。
③实验现象:a 、观察到KMnO 4颗粒在加热时有强烈的迸裂;b 、伴随有少量烟产生。
④关键操作:a 、在加热时,颗粒容易迸裂而从导气管冲进水槽,或致导气管堵塞,因此要在试管口放一团脱脂棉;b、加热KMnO4时,缓缓向后移动酒精灯,保证高锰酸钾能够充分反应,增加氧气产量。
⑤安全事项:a、用高锰酸钾分解制氧气的优点是不用催化剂,加热分解的温度要比氯酸钾法低;b、加热时应将试管向下倾斜;c、实验结束后,先撤导管,后撤酒精灯(防止水倒吸,使试管炸裂)。
(2)H2O2分解制备法:①组装实验装置如右图:②实验步骤:a、检查装置气密性;b、在蒸馏烧瓶中加入1.0gMnO2,用带有分液漏斗的塞子塞住烧瓶,分液漏斗中加入H2O2(H2O230%与水各20mL稀释为质量分数15%);c、用排水法收集(氧气不溶于水)。
氧气的制取及性质实验报告氧气的制取及性质实验报告引言:氧气是一种非常重要的气体,它在生命活动、燃烧以及许多化学反应中起着关键的作用。
为了更好地了解氧气的性质和制取方法,我们进行了一系列实验。
实验一:氧气的制取实验目的:通过加热过氧化氢来制取氧气,并观察氧气的物理性质。
实验步骤:1. 准备一烧杯和一根玻璃棒。
2. 在烧杯中加入适量的过氧化氢溶液。
3. 将烧杯加热至沸腾,同时用玻璃棒搅拌。
4. 在烧杯口放置一根湿润的玻璃棒,观察玻璃棒上是否有气泡产生。
实验结果:在加热过氧化氢的过程中,我们观察到玻璃棒上产生了大量的气泡。
这些气泡的颜色与氧气相似,且能够使湿润的玻璃棒上的颜色变淡。
实验二:氧气的性质实验目的:通过一系列实验,了解氧气的物理和化学性质。
实验步骤:1. 实验一:将一根点燃的火柴放入一个封闭的容器中,观察火柴的燃烧情况。
2. 实验二:将一片湿润的红色酚酞试纸放入一个封闭的容器中,观察试纸的颜色变化。
3. 实验三:将一根点燃的火柴放入一个装有水的容器中,观察火柴的燃烧情况。
实验结果:实验一:当火柴放入封闭容器中时,火柴燃烧的速度明显加快,并且火焰变得更明亮。
实验二:湿润的红色酚酞试纸变成了蓝色,表明氧气的存在。
实验三:当火柴放入装有水的容器中时,火柴燃烧的速度明显减慢,并且最终熄灭。
讨论:根据实验结果,我们可以得出以下结论:1. 氧气是一种能够支持燃烧的气体,它可以使火焰更明亮并加速燃烧过程。
2. 氧气具有一定的氧化性,它可以将红色酚酞试纸的颜色变为蓝色。
3. 氧气在水中的溶解度较低,可以减缓火焰的燃烧速度。
结论:通过本次实验,我们成功地制取了氧气,并且对其性质进行了初步的了解。
氧气在生命活动、燃烧和化学反应中起着重要的作用。
进一步的研究可以帮助我们更好地理解氧气的特性,并应用于各个领域中。
第1篇一、实验目的1. 掌握实验室制取氧气的原理和方法。
2. 熟悉氧气的性质和检验方法。
3. 提高实验操作技能,培养严谨的科学态度。
二、实验原理氧气是一种无色、无味、无臭的气体,在常温下不易与其他物质发生反应。
实验室制取氧气的方法主要有:加热高锰酸钾、氯酸钾与二氧化锰混合物、过氧化氢溶液与二氧化锰混合物等。
本实验采用加热高锰酸钾的方法制取氧气。
三、实验仪器与试剂1. 仪器:试管、酒精灯、铁架台、集气瓶、导管、水槽、火柴等。
2. 试剂:高锰酸钾、二氧化锰。
四、实验步骤1. 将少量高锰酸钾放入试管中,用铁架台固定试管。
2. 将导管一端插入试管,另一端伸入集气瓶中。
3. 点燃酒精灯,对试管加热,使高锰酸钾分解产生氧气。
4. 观察集气瓶中氧气的变化,用带火星的木条检验氧气。
5. 实验结束后,熄灭酒精灯,将导管从水槽中取出,防止水倒吸。
五、实验结果与分析1. 实验现象:加热高锰酸钾后,试管内出现紫色烟雾,集气瓶内氧气浓度逐渐增加。
2. 氧气检验:用带火星的木条伸入集气瓶中,木条复燃,证明氧气已制取成功。
六、实验结论通过本次实验,我们掌握了实验室制取氧气的原理和方法,熟悉了氧气的性质和检验方法。
在实验过程中,我们培养了严谨的科学态度和良好的实验操作技能。
七、注意事项1. 实验过程中要注意安全,防止火灾和烫伤。
2. 加热时要均匀加热,防止试管破裂。
3. 实验结束后,要熄灭酒精灯,将导管从水槽中取出,防止水倒吸。
八、实验反思本次实验过程中,我们遇到了一些问题,如加热不均匀导致试管破裂、氧气浓度不够高等。
通过反思,我们认识到在实验过程中要严格按照操作规程进行,注意观察实验现象,及时调整实验条件,以提高实验效果。
九、拓展实验1. 尝试采用氯酸钾与二氧化锰混合物制取氧气,比较两种方法的优缺点。
2. 研究氧气在不同条件下的性质,如氧气的溶解度、氧气的催化作用等。
通过本次实验,我们不仅掌握了实验室制取氧气的原理和方法,还提高了自己的实验操作技能和科学素养。
一、实验目的1. 掌握实验室制取氧气的原理和方法。
2. 熟悉氧气的性质及其检验方法。
3. 提高化学实验操作技能。
二、实验原理1. 氧气制备原理:- 高锰酸钾法:在加热条件下,高锰酸钾分解生成氧气。
\[ 2KMnO_4 \xrightarrow{\Delta} K_2MnO_4 + MnO_2 + O_2 \] - 过氧化氢法:在二氧化锰催化下,过氧化氢分解生成氧气。
\[ 2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2 \]2. 氧气性质:- 氧气在常温下为无色、无味的气体。
- 氧气不易溶于水,密度比空气大。
- 氧气具有助燃性,能使带火星的木条复燃。
三、实验仪器与药品1. 实验仪器:- 高锰酸钾或过氧化氢溶液- 二氧化锰- 铁架台- 试管- 火柴- 橡皮塞- 导管- 水槽- 集气瓶- 带火星的木条2. 实验药品:- 高锰酸钾(KMnO_4)- 过氧化氢溶液(H_2O_2)- 二氧化锰(MnO_2)四、实验步骤1. 高锰酸钾法制取氧气:- 将高锰酸钾放入试管中,用橡皮塞塞紧,连接导管。
- 在试管口放置集气瓶,将集气瓶倒扣在水槽中。
- 点燃酒精灯,加热试管,观察气体产生情况。
- 当集气瓶内充满氧气时,用玻璃片封口,取出集气瓶。
2. 过氧化氢法制取氧气:- 在锥形瓶中加入适量的二氧化锰。
- 用带有分液漏斗的橡皮塞塞紧锥形瓶口,分液漏斗中加入过氧化氢溶液。
- 观察气泡产生情况,收集氧气。
3. 氧气的性质检验:- 将带火星的木条伸入集气瓶中,观察木条是否复燃。
五、实验现象与结论1. 高锰酸钾法制取氧气:- 加热试管后,产生大量气泡,气体进入集气瓶。
- 带火星的木条伸入集气瓶中,复燃。
2. 过氧化氢法制取氧气:- 加入过氧化氢溶液后,锥形瓶中产生大量气泡,气体进入集气瓶。
- 带火星的木条伸入集气瓶中,复燃。
结论1. 实验成功制取了氧气,并验证了氧气的性质。
2. 高锰酸钾法和过氧化氢法均可用于实验室制取氧气。
实验活动1 氧气实验室的制取与性质。
(3)木炭在氧气中的燃烧
①如下图所示,用坩埚钳
夹取一小块木炭,在酒精灯上加热到发红,观察现象。
②把点着的木炭由瓶口向下缓慢插入氧气瓶中,观察现象。
思考:为什么操作中要“由上而下缓慢伸入氧气瓶中”,而不是直接伸入瓶内?
③燃烧停止后,取出坩埚钳,木炭在空气中持续
放出
木炭在氧气中燃烧比在空气中燃烧得
发出
(4) 细铁丝在氧气中的燃烧
①把铁丝用砂纸打亮,然后绕
成螺旋状,一端系一根火柴,用坩埚钳夹住铁丝并点燃火柴,伸入盛有氧气的集气瓶中观察现象。
思考:为什么要将细铁丝绕成螺旋状?
②待火柴梗快要烧完时,将它们由上往下缓慢伸进盛有氧气的集气瓶(底部预留少量水)中,观察现象。
思考:
为什么要待火柴梗快要燃尽时,才将铁丝伸入盛有氧气的集气瓶中?
③燃烧停止后,用手轻轻触摸集气瓶靠近水面的外壁。
现象:感觉到:。