实验室制取氧气实验报告单
- 格式:docx
- 大小:8.68 KB
- 文档页数:2

一、实验目的1. 学习实验室制取氧气的原理和方法。
2. 掌握氧气的检验方法。
3. 培养实验操作技能和科学探究能力。
二、实验原理氧气是一种无色、无味、无臭的气体,在标准状况下,氧气的密度为1.429g/L。
实验室制取氧气常用的方法有加热氯酸钾、过氧化氢分解、高锰酸钾分解等。
本实验采用高锰酸钾分解法制取氧气。
高锰酸钾(KMnO4)在加热条件下分解,生成锰酸钾(K2MnO4)、二氧化锰(MnO2)和氧气(O2)。
反应方程式如下:2KMnO4 → K2MnO4 + MnO2 + O2↑三、实验器材1. 高锰酸钾2. 烧杯3. 玻璃棒4. 铁架台5. 铁夹6. 水槽7. 水封管8. 收集瓶9. 氧气检测试纸10. 酒精灯11. 火柴四、实验步骤1. 在烧杯中加入适量高锰酸钾,用玻璃棒搅拌均匀。
2. 将烧杯放置在铁架台上,用铁夹固定。
3. 在烧杯口插入水封管,水封管另一端插入水槽中。
4. 将收集瓶倒置放在水封管上,确保瓶口紧贴水封管。
5. 点燃酒精灯,对烧杯加热,观察高锰酸钾的分解情况。
6. 当收集瓶内氧气收集满时,用酒精灯熄灭加热源。
7. 将收集瓶取出水封管,用氧气检测试纸检验氧气。
8. 实验完毕,清理实验器材。
五、实验结果实验成功制取了氧气,通过氧气检测试纸检验,确认氧气已收集满。
六、实验讨论1. 高锰酸钾分解过程中,反应放热,加热时要均匀加热,避免局部过热。
2. 水封管的作用是防止氧气逸出,同时可以观察氧气收集情况。
3. 实验过程中要注意安全,防止火灾和烫伤。
4. 实验结束后,要清理实验器材,保持实验室整洁。
七、实验总结本次实验成功制取了氧气,掌握了实验室制取氧气的原理和方法。
通过实验,提高了实验操作技能和科学探究能力,为今后学习化学知识奠定了基础。

第1篇实验名称:氧气制取实验实验日期:____年__月__日实验地点:____实验室实验目的:1. 掌握实验室制取氧气的方法。
2. 理解氧气的物理和化学性质。
3. 学会使用排水法收集氧气。
4. 熟悉实验操作步骤和注意事项。
实验原理:氧气是一种无色、无味的气体,不易溶于水。
在实验室中,可以通过以下两种方法制取氧气:1. 加热高锰酸钾(KMnO4)分解:2KMnO4 → K2MnO4 + MnO2 + O2↑2. 加热氯酸钾(KClO3)与二氧化锰(MnO2)的混合物:2KClO3 →2KCl + 3O2↑实验器材:1. 高锰酸钾2. 氯酸钾3. 二氧化锰4. 试管5. 铁架台6. 导气管7. 集气瓶8. 酒精灯9. 水槽10. 橡皮塞11. 棉花12. 燃烧匙13. 火柴14. 澄清石灰水15. 托盘天平16. 称量纸17. 药匙实验步骤:一、加热高锰酸钾制取氧气1. 将高锰酸钾放入试管底部,用橡皮塞塞紧试管口,并在塞子中插入导气管。
2. 用铁架台固定试管,使试管口略向下倾斜。
3. 点燃酒精灯,加热试管底部的高锰酸钾。
4. 观察到高锰酸钾由紫色变为黑色,产生气泡。
5. 将集气瓶倒置在水槽中,用导管将氧气导入集气瓶中。
6. 收集满氧气后,将导管从水槽中取出,用毛玻璃片盖住集气瓶口。
二、加热氯酸钾与二氧化锰混合物制取氧气1. 称取适量的氯酸钾和二氧化锰,混合均匀。
2. 将混合物放入试管底部,用橡皮塞塞紧试管口,并在塞子中插入导气管。
3. 用铁架台固定试管,使试管口略向下倾斜。
4. 点燃酒精灯,加热试管底部混合物。
5. 观察到混合物由白色变为黑色,产生气泡。
6. 将集气瓶倒置在水槽中,用导管将氧气导入集气瓶中。
7. 收集满氧气后,将导管从水槽中取出,用毛玻璃片盖住集气瓶口。
实验现象:1. 加热高锰酸钾时,高锰酸钾由紫色变为黑色,产生气泡,收集到的气体为氧气。
2. 加热氯酸钾与二氧化锰混合物时,混合物由白色变为黑色,产生气泡,收集到的气体为氧气。

一、实验目的1. 掌握实验室制取氧气的方法。
2. 熟练掌握氧气的收集和检验方法。
3. 了解氧气的性质。
二、实验原理氧气是一种无色、无味、无臭的气体,化学式为O2。
在实验室中,氧气可以通过以下方法制备:1. 加热高锰酸钾(KMnO4)分解:2KMnO4 → K2MnO4 + MnO2 + O2↑2. 分解过氧化氢(H2O2):2H2O2 → 2H2O + O2↑本实验采用加热高锰酸钾分解法制备氧气。
三、实验器材1. 仪器:酒精灯、试管、铁架台、铁夹、导管、集气瓶、水槽、毛玻璃片、棉花、试管夹。
2. 药品:高锰酸钾、二氧化锰。
四、实验步骤1. 准备工作:将酒精灯、试管、铁架台、铁夹、导管、集气瓶、水槽、毛玻璃片、棉花、试管夹等实验器材准备好。
2. 制备氧气:(1)将高锰酸钾放入试管中,加入少量棉花,防止加热时高锰酸钾溅出。
(2)用铁夹将试管固定在铁架台上,试管口略向下倾斜。
(3)点燃酒精灯,先对试管进行预热,使试管受热均匀。
(4)将火焰集中在药品处加热,观察氧气生成。
(5)用排水法收集氧气。
3. 检验氧气:(1)将集气瓶倒置放入水槽中,用导管将氧气导入集气瓶。
(2)将毛玻璃片盖在集气瓶口,观察氧气是否充满集气瓶。
(3)用带火星的木条伸入集气瓶内,观察木条是否复燃。
五、实验现象1. 加热高锰酸钾时,试管内出现大量气泡,说明氧气正在生成。
2. 用排水法收集氧气时,集气瓶内充满氧气。
3. 将带火星的木条伸入集气瓶内,木条复燃,证明收集到的气体是氧气。
六、实验结论1. 实验成功制备了氧气。
2. 氧气具有助燃性,能使带火星的木条复燃。
3. 氧气密度比空气大,可用排水法收集。
七、注意事项1. 加热高锰酸钾时,注意安全,防止烫伤。
2. 加热时,试管口略向下倾斜,防止冷凝水倒流使试管破裂。
3. 加热前要对试管进行预热,使试管受热均匀。
4. 停止加热时,先将导管移出水面,防止水倒吸入试管内。
5. 收集氧气时,注意集气瓶内气体充满,防止气体泄漏。

一、实验目的1. 了解实验室制取氧气的原理和方法。
2. 掌握高锰酸钾加热分解制氧气的操作步骤。
3. 学习氧气的检验方法。
4. 培养实验操作技能和科学探究能力。
二、实验原理氧气是一种无色、无味、无臭的气体,化学式为O2。
在实验室中,常用高锰酸钾(KMnO4)加热分解来制取氧气。
反应方程式如下:2KMnO4 → K2MnO4 + MnO2 + O2↑三、实验器材1. 实验室常用仪器:试管、酒精灯、铁架台、集气瓶、水槽、导管、橡皮塞等。
2. 实验药品:高锰酸钾、蒸馏水、澄清石灰水等。
四、实验步骤1. 准备工作:检查实验器材是否完好,清理实验台面。
2. 将高锰酸钾放入试管中,用橡皮塞塞紧试管口。
3. 用铁夹将试管固定在铁架台上,调整试管口向下倾斜。
4. 点燃酒精灯,加热试管底部,使高锰酸钾受热分解。
5. 观察试管内气体产生情况,待气泡连续均匀冒出时,用集气瓶收集氧气。
6. 将收集到的氧气用导管引入澄清石灰水中,观察石灰水的变化。
7. 实验结束后,关闭酒精灯,将试管从铁夹上取下,待冷却后清理实验台面。
五、实验结果与分析1. 氧气产生情况:实验过程中,观察到试管内气泡连续均匀冒出,说明高锰酸钾受热分解产生了氧气。
2. 氧气检验:将收集到的氧气引入澄清石灰水中,石灰水变浑浊,说明氧气与石灰水反应生成了碳酸钙沉淀,证明氧气已制得。
六、实验结论1. 实验成功制取了氧气,反应方程式为2KMnO4 → K2MnO4 + MnO2 + O2↑。
2. 高锰酸钾加热分解是实验室制取氧气的常用方法。
3. 氧气具有助燃性,可用澄清石灰水检验。
七、实验注意事项1. 实验过程中,注意安全,避免高温烫伤。
2. 加热试管时,注意试管口向下倾斜,防止水蒸气倒流入试管。
3. 实验结束后,待试管冷却后再清理实验台面,避免试管破裂。
八、实验反思本次实验成功制取了氧气,加深了我对实验室制取氧气原理和方法的了解。
在实验过程中,我掌握了高锰酸钾加热分解制氧气的操作步骤,并学会了氧气的检验方法。


一、实验目的1. 了解氧气制取的原理和方法;2. 掌握实验室制取氧气的操作技能;3. 学习观察实验现象,分析实验结果。
二、实验原理氧气是空气中的一种重要气体,约占空气总体积的21%。
实验室制取氧气的方法有很多,其中常用的有加热氯酸钾、高锰酸钾、过氧化氢分解等。
本实验采用过氧化氢分解法制取氧气,其化学方程式为:2H2O2 → 2H2O + O2↑。
三、实验器材1. 实验装置:锥形瓶、导管、集气瓶、酒精灯、水槽、铁夹、橡皮塞等;2. 实验试剂:过氧化氢溶液、二氧化锰、水等。
四、实验步骤1. 准备实验装置:将锥形瓶放在铁夹上,用橡皮塞密封,导管连接锥形瓶和集气瓶;2. 将二氧化锰加入锥形瓶底部,加入适量的过氧化氢溶液;3. 用酒精灯加热锥形瓶,观察氧气产生情况;4. 将集气瓶倒置在水槽中,用导管将氧气导入集气瓶中;5. 观察氧气收集情况,待集气瓶中充满氧气后,关闭导管;6. 将集气瓶取出,用酒精灯点燃瓶口,观察氧气燃烧现象。
五、实验现象及结果分析1. 实验现象:加热锥形瓶后,迅速产生气泡,气泡逐渐增多,集气瓶内氧气逐渐充满;2. 结果分析:过氧化氢在二氧化锰的催化作用下分解产生氧气,氧气在集气瓶内逐渐充满。
氧气具有助燃性,点燃瓶口时,氧气与空气中的氧气混合,产生明亮的火焰。
六、实验注意事项1. 实验过程中,注意安全,避免火灾和爆炸;2. 加热锥形瓶时,注意控制火焰大小,避免过热;3. 导管连接要牢固,防止氧气泄漏;4. 收集氧气时,注意观察集气瓶内氧气充满情况,避免收集不完全。
七、实验总结本次实验成功制取了氧气,并观察到了氧气燃烧的现象。
通过实验,掌握了实验室制取氧气的原理和方法,提高了实验操作技能。
在实验过程中,应注意安全,遵循实验规范,确保实验顺利进行。

第1篇一、实验名称:初中氧气制造实验二、实验目的:1. 掌握实验室制取氧气的方法。
2. 了解氧气的性质及其应用。
3. 培养实验操作技能和科学探究能力。
三、实验原理:氧气是空气中的主要成分之一,约占空气总体积的21%。
在实验室中,我们可以通过加热高锰酸钾(KMnO4)来制取氧气。
高锰酸钾在加热条件下分解,生成锰酸钾(K2MnO4)、二氧化锰(MnO2)和氧气(O2)。
化学方程式为:2KMnO4 → K2MnO4 + MnO2 + O2↑四、实验器材:1. 高锰酸钾2. 铁架台3. 试管4. 导气管5. 集气瓶6. 酒精灯7. 水槽8. 橡皮塞9. 带火星的木条五、实验步骤:1. 检查装置气密性:将导管一端插入水中,另一端用橡皮塞塞紧试管口,用双手握住试管,观察导管内水柱变化。
若水柱上升,说明装置气密性良好。
2. 装入药品:取适量高锰酸钾放入试管中,用带导管的橡皮塞塞紧试管口。
3. 固定试管:将试管固定在铁架台上,使试管口略向下倾斜,药品平铺在试管底部。
4. 加热:点燃酒精灯,给试管加热,排出管内空气。
5. 收集氧气:用排水法收集氧气。
将集气瓶装满水倒扣于水槽中,待气泡连续均匀时,将导管伸入集气瓶中收集氧气。
6. 验证氧气:将带火星的木条伸入集气瓶中,若木条复燃,说明集气瓶中有氧气。
六、实验现象:1. 加热过程中,高锰酸钾逐渐由紫色变为黑色,产生大量气泡。
2. 气泡进入集气瓶中,集气瓶内氧气逐渐增多。
3. 将带火星的木条伸入集气瓶中,木条复燃。
七、实验结论:1. 实验成功制取了氧气。
2. 氧气能使带火星的木条复燃。
3. 氧气是空气中的主要成分之一,具有助燃性。
八、实验讨论:1. 实验过程中,为什么要使试管口略向下倾斜?答:使药品平铺在试管底部,防止加热时药品飞溅,确保实验安全。
2. 实验过程中,为什么要用排水法收集氧气?答:氧气不易溶于水,用排水法可以有效地收集氧气,避免氧气与空气混合。
3. 实验过程中,如何验证氧气已收集满?答:将带火星的木条伸入集气瓶中,若木条复燃,说明氧气已收集满。
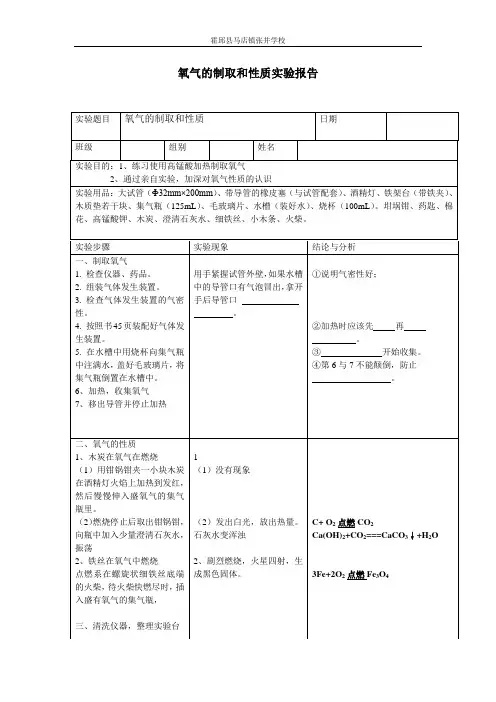

实验室制取氧气及其性质实验报告(5篇范文)第一篇:实验室制取氧气及其性质实验报告实验室用氯酸钾制取氧气、实验目的1 1 练习实验室制取氧气的方法,练习用排水取气法收集气体;2 2、初步了解通过化学实验制取新物质的方法; 3 3、认识分解反应和催化剂的概念。
二、实验原理 MnO :点燃昇 4 4、原理:2KCIOjO 2KCI+3O 厂 2 2、2 02 物理性质:在通常状况下,0 0 2 为无色无味的气体、密度比空气的略大,可以用向上排空气法收集氧气。
0 0 2 不易溶于水,所以通常采用排水法收集氧气。
三、实验用品大试管、单孔橡皮塞、胶皮管、玻璃导管、集气瓶、水槽、铁架台(带铁夹))、酒精灯、玻璃片、坩埚钳(镊子)、研钵、试管夹氯酸钾、二氧化锰、火柴。
四、实验步骤步骤:1 如上图所示连接仪器组装装置。
用带有导管的橡皮塞塞紧试管,并检查装置是否漏气,不漏气的装置才能进行实验。
2、查:检查装置的气密性,将导管口伸入水面以下,用手紧握试管,观察导管口是否有气泡产生,若有气泡产生,则证明装置气密性好。
,在试管里放进约 g 9g 氯酸钾和 g 3g 二氧化锰。
然后 3 3、装:拔下橡皮塞,用药匙取三药匙氯酸钾于研钵中轻轻研碎,再加入一药匙二氧化锰充分混合均匀。
然后用纸槽送入试管底部,把带有导管的橡皮塞塞紧试管口。
并将集气装置图实验室用氯酸钾制取氧气的瓶装满水(不能留有气泡),用玻璃片盖好倒置于水槽中。
4、定:将装有氯酸钾和二氧化锰混合物的试管固定在铁架台,用铁夹夹持在距试管口的三分之一处,试管口略微向下倾斜。
5、点:取下酒精灯灯帽正放于桌面,点燃酒精灯先给试管进行预热(用手端着酒精灯在试管下方左右来回移动,让试管均匀受热),然后集中加热装有药品的部位。
6、收:导管口开始有气泡放出时,不宜立即收集,有连续并均匀的气泡冒出时,再把导管口伸入盛满水的集气瓶口开始收集氧气,当集气瓶口有气泡冒出时,证明已收集满,在水面下用玻璃片盖好瓶口取出集气瓶迅速倒置于桌面。

第1篇一、实验目的1. 掌握实验室制取氧气的方法;2. 了解氧气的性质;3. 熟练操作实验仪器,提高实验技能。
二、实验原理1. 实验一:高锰酸钾制取氧气高锰酸钾在加热条件下分解,生成氧气、二氧化锰和锰酸钾。
反应方程式如下:2KMnO4 → K2MnO4 + MnO2 + O2↑2. 实验二:氯酸钾制取氧气氯酸钾在二氧化锰的催化作用下,加热分解生成氧气和氯化钾。
反应方程式如下:2KClO3 → 2KCl + 3O2↑三、实验仪器与药品1. 实验仪器:酒精灯、铁架台、铁夹、集气瓶、水槽、导管、试管、棉花、毛玻璃片、单口塞、燃烧匙、火柴等。
2. 实验药品:高锰酸钾、氯酸钾、二氧化锰、木炭、硫粉、红磷、铁丝、澄清石灰水等。
四、实验步骤1. 实验一:高锰酸钾制取氧气(1)将高锰酸钾装入试管,加入适量的二氧化锰,用棉花塞住试管口;(2)用铁夹将试管固定在铁架台上,试管口略向下倾斜;(3)点燃酒精灯,加热试管,待氧气产生后,用排水法收集氧气;(4)将收集到的氧气进行检验,观察其性质。
2. 实验二:氯酸钾制取氧气(1)将氯酸钾和二氧化锰混合均匀,装入试管;(2)用铁夹将试管固定在铁架台上,试管口略向下倾斜;(3)点燃酒精灯,加热试管,待氧气产生后,用排水法收集氧气;(4)将收集到的氧气进行检验,观察其性质。
五、实验现象1. 实验一:加热高锰酸钾时,试管内出现紫色晶体变为黑色,导管口有气泡冒出,集气瓶内氧气收集满后,带火星的木条复燃;2. 实验二:加热氯酸钾时,试管内出现白色晶体变为黑色,导管口有气泡冒出,集气瓶内氧气收集满后,带火星的木条复燃。
六、实验结论1. 高锰酸钾和氯酸钾在加热条件下都能分解产生氧气;2. 氧气是一种无色、无味、不易溶于水的气体,具有助燃性;3. 通过实验,掌握了实验室制取氧气的方法和氧气的性质。
七、实验注意事项1. 实验过程中,要注意安全,防止烫伤和爆炸;2. 加热试管时,要均匀受热,防止试管破裂;3. 收集氧气时,要保证集气瓶内无气泡,避免氧气收集不纯;4. 实验结束后,要及时熄灭酒精灯,清理实验器材。
实验室用高锰酸钾制取氧气实验报告单学生用一、实验目的:1.了解高锰酸钾与氢氧化钠反应生成氧气的反应过程;2.学会通过收集氧气的实验操作;3.掌握制取氧气的实验方法。
二、实验原理:高锰酸钾(KMnO4)在氢氧化钠(NaOH)存在下分解产生氧气。
反应方程式如下:2KMnO4+3NaOH→2MnO2+3Na2MnO4+H2O+O2三、实验仪器与药品:1.仪器:烧杯、试管、试管夹、酒精灯、导管等;2.药品:高锰酸钾、氢氧化钠。
四、实验步骤:1.取适量高锰酸钾放入烧杯中;2.加入少量蒸馏水,搅拌均匀,使高锰酸钾溶解;3.取一根试管,套在试管架上;4.取一些氢氧化钠溶液,加入到试管中;5.将试管的出口的玻璃管连接到导管的一端;6.将另一端的导管插入装有蒸馏水的烧杯中;7.在燃烧的酒精灯下方加热试管中的高锰酸钾溶液;8.观察试管内气体的变化,并用试管左上角装设的木塞摇动密封试管。
五、实验结果与现象:1.高锰酸钾溶液加热后,放出大量棕红色气体;2.试管中充满了氧气,试管倾斜时,氧气会向导管中冒泡。
六、实验分析与讨论:1.由于高锰酸钾溶液的燃烧慢,所以需要加热高锰酸钾溶液才能使氧气分解得更彻底;2.高锰酸钾与氢氧化钠反应产生的氧气呈强氧化性,会加速酒精灯燃烧;3.由于氧气密度比空气大,所以氧气会向上冒泡。
七、实验总结:本次实验通过高锰酸钾与氢氧化钠的反应,成功制取了氧气。
在实验过程中,要注意安全操作,确保火源的安全和酒精灯距离试管的适当距离。
同时,要掌握实验操作的正确步骤和实验原理,以便能够顺利地进行实验并得到准确的结果。
通过本次实验,我们进一步加深了对高锰酸钾制取氧气实验的理解,并且了解到了制取氧气的应用前景和实际意义。
实验名称:氧气的制取实验实验日期:2021年10月10日实验地点:实验室实验目的:1. 掌握氧气的制取方法;2. 了解氧气的性质;3. 培养实验操作技能。
实验原理:氧气是一种无色、无味、无臭的气体,在常温常压下不易溶解于水。
实验室制取氧气常用过氧化氢(H2O2)和二氧化锰(MnO2)为原料,在催化剂的作用下分解生成氧气和水。
实验仪器:1. 锥形瓶(250ml)2. 长颈漏斗3. 二氧化锰(MnO2)4. 过氧化氢溶液(30%)5. 烧杯6. 集气瓶7. 水槽8. 橡皮塞9. 铁夹10. 铁架台11. 火柴12. 试管13. 烧杯14. 硅胶15. 滴管实验步骤:1. 在锥形瓶中加入适量的二氧化锰(MnO2);2. 将锥形瓶固定在铁架台上,用长颈漏斗加入过氧化氢溶液(30%);3. 将集气瓶倒置在水槽中,用橡皮塞密封;4. 在锥形瓶口点燃一支火柴,用滴管将过氧化氢溶液滴入锥形瓶中,观察氧气的产生;5. 当集气瓶内充满氧气时,用橡皮塞密封集气瓶;6. 将集气瓶倒置,用铁夹固定在试管上;7. 将试管插入烧杯中,观察氧气的收集;8. 收集完氧气后,将集气瓶倒置在水槽中,用滴管加入适量的水,观察氧气的溶解性;9. 将试管中的氧气点燃,观察氧气的助燃性。
实验结果:1. 氧气在锥形瓶中产生,集气瓶内充满氧气;2. 氧气不易溶解于水;3. 氧气具有助燃性。
实验分析:1. 本实验成功制取了氧气,实验操作符合实验原理;2. 氧气不易溶解于水,表明其在常温常压下不易与水发生反应;3. 氧气具有助燃性,在点燃试管中的氧气时,火苗更加旺盛。
实验结论:1. 通过本实验,掌握了氧气的制取方法;2. 了解氧气的性质,包括不易溶解于水、具有助燃性等;3. 提高了实验操作技能,为今后的实验奠定了基础。
注意事项:1. 实验过程中要注意安全,避免与过氧化氢溶液接触;2. 操作时要小心,避免溅出溶液;3. 实验结束后,将仪器清洗干净,归位。
第1篇一、实验目的1. 了解氧气制取的原理和方法。
2. 掌握实验室制取氧气的装置及其操作方法。
3. 熟悉氧气的性质和检验方法。
二、实验原理氧气是一种无色、无味、无臭的气体,化学式为O2。
在实验室中,常用的制取氧气的方法有加热高锰酸钾、分解过氧化氢和加热氯酸钾等。
本实验采用加热氯酸钾的方法制取氧气。
氯酸钾在加热条件下分解生成氧气和氯化钾,反应方程式如下:2KClO3 → 2KCl + 3O2↑三、实验仪器与药品1. 仪器:酒精灯、试管、导管、集气瓶、铁夹、火柴、水槽等。
2. 药品:氯酸钾、二氧化锰、蒸馏水等。
四、实验步骤1. 将氯酸钾和二氧化锰按一定比例混合均匀,装入试管中。
2. 将试管固定在铁夹上,导管一端伸入集气瓶内,另一端放入水槽中。
3. 点燃酒精灯,对试管加热,观察反应现象。
4. 当气泡连续均匀地产生时,开始收集氧气。
5. 收集一定量的氧气后,关闭导管,停止加热。
6. 将集气瓶倒置在水槽中,观察氧气是否被水排出。
7. 将集气瓶取出,用带火星的木条检验氧气。
五、实验结果与分析1. 实验现象:加热氯酸钾后,试管内产生大量气泡,集气瓶内氧气逐渐充满。
2. 实验结果:集气瓶内氧气被水排出,用带火星的木条检验,木条复燃。
3. 实验分析:氯酸钾在加热条件下分解生成氧气和氯化钾,氧气具有助燃性,能使带火星的木条复燃。
六、实验注意事项1. 加热时,注意观察试管内气泡产生情况,避免加热过猛。
2. 收集氧气时,注意导管插入集气瓶内的深度,确保氧气充满集气瓶。
3. 实验结束后,关闭导管,停止加热,防止水倒吸入试管内。
七、实验总结本次实验成功制取了氧气,掌握了实验室制取氧气的装置及其操作方法。
通过实验,我们了解了氧气的性质和检验方法,提高了实验操作技能。
在实验过程中,应注意安全,遵守实验操作规范,确保实验顺利进行。
第2篇一、实验目的1. 了解实验室制取氧气的方法和原理。
2. 掌握制取氧气的实验步骤和注意事项。
3. 培养学生的实验操作能力和科学思维。
一、实验目的1. 掌握实验室制取氧气的原理和方法。
2. 熟悉氧气的性质及其检验方法。
3. 培养实验操作技能和安全意识。
二、实验原理实验室制取氧气常用过氧化氢(H2O2)分解法,其化学方程式为:2H2O2 → 2H2O + O2↑在该反应中,过氧化氢在二氧化锰(MnO2)的催化作用下分解生成水和氧气。
反应过程中,氧气以气泡形式逸出。
三、实验仪器与试剂1. 仪器:锥形瓶、导管、集气瓶、水槽、酒精灯、铁架台、玻璃片、橡胶塞等。
2. 试剂:过氧化氢溶液、二氧化锰、稀硫酸、澄清石灰水。
四、实验步骤1. 准备工作(1)检查实验仪器是否完好,连接好装置。
(2)在锥形瓶中加入适量的过氧化氢溶液。
(3)在集气瓶中倒入少量水,将玻璃片放在集气瓶口,使其浸入水中。
2. 制取氧气(1)向锥形瓶中加入少量二氧化锰,用橡胶塞塞紧瓶口。
(2)用酒精灯加热锥形瓶,使过氧化氢分解产生氧气。
(3)当集气瓶中充满氧气时,将玻璃片取下,收集氧气。
3. 检验氧气(1)将集气瓶中的氧气用导管导入澄清石灰水中,观察石灰水是否变浑浊。
(2)将带火星的木条伸入集气瓶中,观察木条是否复燃。
五、实验结果与分析1. 实验现象(1)加热锥形瓶后,产生大量气泡,说明氧气开始生成。
(2)集气瓶中的氧气使澄清石灰水变浑浊,说明氧气已收集。
(3)带火星的木条伸入集气瓶中,木条复燃,说明氧气具有助燃性。
2. 实验结果(1)成功制取氧气。
(2)氧气能使澄清石灰水变浑浊,具有助燃性。
六、实验结论1. 通过本实验,掌握了实验室制取氧气的原理和方法。
2. 熟悉了氧气的性质及其检验方法。
3. 培养了实验操作技能和安全意识。
七、实验注意事项1. 实验过程中,注意安全,防止氧气泄漏引起火灾。
2. 加热锥形瓶时,要均匀加热,避免局部过热。
3. 实验结束后,及时清理实验器材,防止污染。
八、实验拓展1. 研究不同浓度过氧化氢溶液对氧气生成速率的影响。
2. 探讨其他制取氧气的实验方法,如氯酸钾分解法等。
一、实验目的1. 学习氧气的制备方法。
2. 掌握实验室制取氧气的操作技能。
3. 了解氧气的性质和用途。
二、实验原理氧气是一种无色、无味、无臭的气体,化学式为O2。
实验室制取氧气通常采用加热高锰酸钾(KMnO4)或过氧化氢(H2O2)分解的方法。
本实验采用加热高锰酸钾制备氧气。
反应方程式:2KMnO4 → K2MnO4 + MnO2 + O2↑三、实验器材1. 高锰酸钾(KMnO4)2. 烧杯3. 铁架台4. 水槽5. 氧气收集瓶6. 火柴7. 玻璃片8. 滴管9. 铁夹10. 滤纸11. 实验记录本四、实验步骤1. 准备工作(1)将高锰酸钾放入烧杯中,用滴管加入适量的水,使高锰酸钾完全溶解。
(2)将溶解好的高锰酸钾溶液倒入氧气收集瓶中,确保瓶底无气泡。
(3)用玻璃片将瓶口盖住,防止氧气逸出。
2. 加热制备氧气(1)将烧杯固定在铁架台上,用铁夹夹住烧杯。
(2)点燃火柴,将火焰放在烧杯底部,加热高锰酸钾溶液。
(3)观察氧气收集瓶,当瓶内出现气泡时,用玻璃片盖住瓶口,收集氧气。
3. 氧气性质验证(1)将点燃的木条插入氧气收集瓶中,观察木条燃烧情况。
(2)将带火星的木条插入氧气收集瓶中,观察火星复燃情况。
4. 实验结束(1)关闭火源,将烧杯从铁架台上取下。
(2)将收集到的氧气倒入事先准备好的水槽中,观察氧气溶解情况。
(3)将实验器材清洗干净,整理实验台。
五、实验结果与分析1. 氧气制备实验成功制备出氧气,观察到氧气收集瓶内出现气泡,且木条在氧气中燃烧旺盛,火星复燃。
2. 氧气性质验证氧气具有助燃性,木条在氧气中燃烧旺盛,火星复燃。
氧气在水中的溶解度较低,倒入水槽中后,大部分氧气逸出水面。
六、实验结论1. 实验成功制备出氧气,掌握了实验室制取氧气的操作技能。
2. 通过实验,了解了氧气的性质和用途,认识到氧气在燃烧过程中的重要作用。
3. 实验过程中,严格遵守操作规程,确保实验安全。
七、实验反思1. 在实验过程中,注意观察现象,及时调整实验条件,确保实验顺利进行。
实验室制取氧气实验报告单实验目的:1.了解制取氧气的原理和方法;2.掌握氯酸钾与二氧化锰的热分解反应制取氧气的实验操作;3.学会利用收集气体、判断气体纯度以及应用气体的一般方法。
实验原理:氯酸钾(KClO3)与二氧化锰(MnO2)进行热分解反应可以制取氧气气体,该反应可以用以下化学方程式表示:2KClO3(s)→2KCl(s)+3O2(g)氯酸钾在高温下分解会产生氧气气体和氯化钾固体。
二氧化锰作为催化剂可以加速该反应的速率。
实验仪器和试剂:仪器:蒸馏水装置、实验袋、试管、锥形瓶、水槽、酒精灯、火花器、醇灯、酒精灯三脚架。
试剂:氯酸钾(KClO3)、二氧化锰(MnO2)实验步骤:1.将氯酸钾和二氧化锰混合均匀,按比例称取10克混合物;2.在烧杯中加入适量的蒸馏水,用玻璃棒搅拌溶解;3.将溶解后的溶液倒入实验袋中,用手将袋口揉紧;4.将实验袋放入三脚架上的水槽中,烧开水槽中的水;5.实验袋中的溶液开始热分解,产生氧气气体,用火花器点燃氧气;6.将点燃的火花器放入锥形瓶中,观察火花的变化;7.重复以上步骤,并观察产生的氧气气体的性质。
实验数据:实验1:用10克混合物进行实验,热分解反应后制得氧气气体。
实验2:用10克混合物进行实验,热分解反应后制得氧气气体。
实验结果:实验1:在实验袋中产生的氧气气体点燃后火焰变为明亮的蓝色,并且能够继续燃烧。
实验2:在实验袋中产生的氧气气体点燃后火焰变为明亮的蓝色,并且能够继续燃烧。
实验讨论:根据实验结果观察,制取的氧气气体能够维持燃烧并支持其他物质的燃烧,说明氧气气体的纯度较高。
实验中使用二氧化锰作为催化剂,加速了氯酸钾的热分解反应速率。
由此可以得出,制取氧气的关键在于高温下进行氧化性分解反应,并有效地收集氧气气体。
实验结论:通过本次实验,我们成功制取到纯度较高的氧气气体,并且观察到氧气气体的燃烧特性。
为了保证实验结果的准确性,我们可以对实验中使用的催化剂、实验袋等进行进一步的改进和优化。