[推荐学习]九年级化学下册《8.2 金属的性质》导学案(无答案) 新人教版
- 格式:doc
- 大小:44.59 KB
- 文档页数:3

第八单元8.2金属的化学性质(1)人教九下三、课堂探究扫一扫有惊喜哟! 金属与氧气的反应在前面的学习中,我们知道镁、铁、铜都能和氧气发生化学反应,试填下表:反应实验现象化学方程式镁在空气中燃烧产生耀眼的强光,生成白色固体2Mg+O22MgO铝在纯氧中燃烧产生更为耀眼的强光,放出大量的热,生成灰色固体4Al+3O22Al2O3铁在纯氧中燃烧剧烈燃烧,火星四射,放出大量的热,生成黑色固体3Fe + 2O2Fe3O4铜在空气中加热红色金属变为黑色固体2Cu+O22CuO总结:从氧气的纯度来看,镁在空气中就能燃烧,而铝、铁需要在纯氧中才能燃烧,说明活泼性上镁比铝、铁活泼。
从反应条件来看,镁、铝在常温下就能和氧气反应,而铁、铜需在加热或点燃时才能和氧气反应,说明活泼性上镁、铝比铁、铜活泼。
从反应现象的剧烈程度来看,镁、铝、铁都比铜剧烈,而铜和氧气反应比较平稳,说明活泼性上镁、铝、铁比铜活泼。
1、铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?答:铝制品表面致密的氧化铝薄膜保护部铝不参加反应(铝的钝化)。
2、为什么不宜用钢刷、沙等来擦洗铝制品?答:原因有二:一是破坏表面氧化层;二是新生成氧化层短期不能形成致密保护层,用作餐具会导致铝过多进入食品,长期使用会导致人发生铝中毒。
3、从化学的角度解释“真金不怕火炼”。
答:黄金化学性质稳定,不容易被氧化。
即便高温下也不发生氧化反应。
【例1】下列关于金属的说确的是()A.铝在空气中能生成一层致密的氧化铝保护膜B.铜的化学性质不活泼,在潮湿的空气中也不会生锈C.钛不具有耐腐蚀性,不可以用来制造轮船外壳D.镀锌的“白铁片”不易生锈,说明锌没有铁活泼扫一扫有惊喜哟!(3)铁单质与稀盐酸或稀硫酸反应生成的均为亚铁化合物,含亚铁离子(Fe2+)的溶液呈浅绿色。
(4)金属与酸反应中的酸一般指盐酸和稀硫酸,硝酸和浓硫酸与金属反应不能产生氢气,因为这两种酸具有较强的氧化性。
(5)金属与酸反应时有热量放出,反应后溶液的质量一定增加。
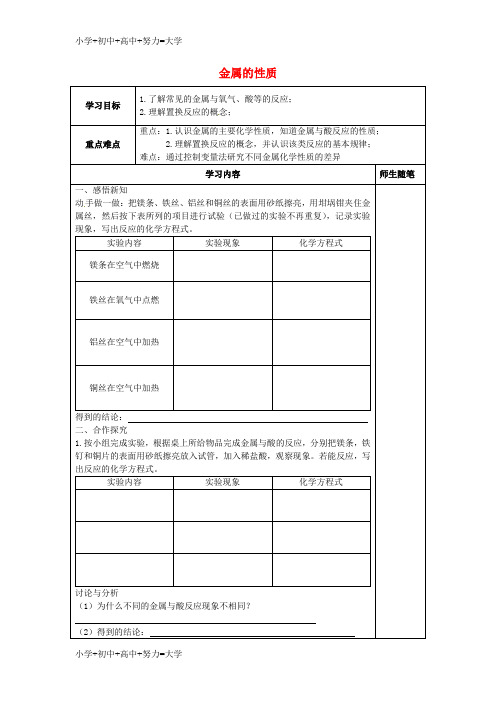

人教版九年级下册第八单元课题2 金属的化学性质之《金属活动性顺序及其应用》导学案一、导学目标1.了解金属的活动性顺序及其应用;2.掌握金属的活动性规律及与其他物质的反应。
二、导学内容1.金属的活动性顺序及其应用;2.金属与其他物质的反应。
三、导学步骤1. 复习提纲•复习上次课内容:金属与酸的反应;•引入本节课主题:金属的活动性顺序及其应用。
2. 导入新知2.1 金属的活动性顺序•引导学生观察以下金属与非金属材料的反应实验现象:–锌与酸反应产生氢气;–铝与酸反应产生氢气;–铁与酸反应产生氢气;–铅与酸反应不产生氢气。
2.2 金属的活动性顺序表•显示金属的活动性顺序表,让学生观察并思考活动性的规律。
金属钾钠钙镁铝锌铁铅氢铜银金活动性强强强强强强中弱微弱微弱微弱微弱3. 活动探究•分组讨论:利用实验现象和活动性顺序表,思考以下问题:–为什么铅不与酸反应产生氢气?–为什么金属的活动性顺序中氢气的活动性最弱?–如何利用活动性顺序表判断金属与其他物质的反应性?4. 实验操作•实验一:金属与酸的反应–实验步骤:1.将锌、铁、铅分别与稀盐酸反应,观察产生的气体现象。
2.通过实验验证活动性顺序表中金属的活动性顺序。
5. 反思总结•小结金属的活动性顺序及其应用;•总结金属与其他物质反应的规律。
总结本节课我们学习了金属的活动性顺序及其应用。
通过观察金属与非金属材料的反应实验现象和分析活动性顺序表,我们掌握了金属的活动性规律及与其他物质的反应。
通过实验操作,我们进一步验证了活动性顺序表中金属的活动性顺序。
这对我们理解金属与其他物质反应的规律具有重要意义。

广东省珠海十中九年级化学下册《8.2 金属的化学性质(第二课时)》导学案(无答案) 新人教版【学习目标】1.了解置换反应2.了解金属的活泼性强弱的另一种判断方式—金属与金属化合物溶液的反应 【温故知新】 写出下列方程式:锌和稀硫酸反应 锌和稀盐酸反应 镁和稀硫酸反应 铝和稀盐酸反应 铁和稀硫酸反应 【参与学习】【分组讨论】有 元素组成的纯净物单质;由 元素组成的纯净物叫化合物。
根据活泼金属与酸的反应方程式,分析该类反应的反应物和生成物具有什么特点。
置换反应:由一种 和一种 反应,生成另一种 和另一种 的反应。
自我检测11.判断下列化学变化是否属于置换反应;如果不是请说出原因(1)CH 4+2O 2CO 2+2H 2O (2)C+2CuO2Cu+CO 2↑(3)2H2O 2 2H 2O+O 2↑ (4)2CO+O 2 2CO 2 (5)Zn+H 2SO 4==ZnSO 4+H 2↑ (6)Fe+CuSO 4 = FeSO 4+Cu 2.(2012•肇庆)下列反应中属于置换反应的是( ) A. CO+CuO Cu+CO 2 B. CaO+H 2O = Ca(OH)2 C. Zn+CuSO 4==ZnSO 4+Cu D. 2NaOH+SO 2=Na 2SO 3+H 2O从金属与氧气、酸反应的实验探究过程中,我们可以知道,铁的活动性比铜的要 (填“强”或 “弱”)提出问题:铁(金属)和硫酸铜溶液(金属化合物溶液)反应会有什么现象 【分组实验1】铁与硫酸铜溶液的反应小结:【分组实验2】比较金属的活动性(根据下列表格完成实验并写出实验现象)【讨论】从分组实验1和分组实验2,我们可以得出:1.铁、铜、银和铝四种金属的活动性强弱为:>>>2.发生反应的化学方程式具有什么特点,属于什么基本反应类型?自我检测21.判断下列物质能否反应?写出能发生反应的化学方程式。
2.(2010•南充)波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成。


人教版九年级化学下册导学案第八单元课题2 金属的化学性质导学案一、学习目标1.了解金属的化学性质;2.掌握金属与非金属的区别;3.掌握金属的常见化学性质;4.理解金属在化学反应中的作用。
二、课前预习1. 金属与非金属的区别•金属:具有一定的延展性、导电性和热传导性,易于加工成各种形状;•非金属:大部分为气体或固体,导电性和热传导性相对较差,质地较脆。
2. 金属的常见化学性质•金属的活泼性:金属元素的活泼性与其放电电位有关,放电电位越高,金属越活泼,反应性越强;•金属的腐蚀:金属在大气中、水中、酸中等环境下容易发生腐蚀,主要表现为氧化反应;•金属的与非金属的反应:金属与非金属的反应可以产生离子化合物,也可以产生共价化合物。
3. 金属在化学反应中的作用•金属的催化作用:金属可以作为催化剂,加速化学反应的进行;•金属的还原性:金属可以参与氧化还原反应,还原其他物质。
三、课堂讲解与探究1. 金属与非金属的区别•讲解金属与非金属的区别,让学生了解两者在物理性质和化学性质方面的差异,引导学生思考金属和非金属的不同应用场景。
2. 金属的常见化学性质•讲解金属的活泼性、腐蚀性和与非金属的反应性质,结合实例让学生理解不同金属的反应行为,并且让学生归纳总结金属的常见化学性质。
3. 金属在化学反应中的作用•讲解金属的催化性质和还原性质,通过实验和示意图的展示使学生理解金属在化学反应中的重要作用,并引导学生思考金属催化剂的应用领域。
四、课后练习1.金属与非金属的区别是什么?2.金属的腐蚀与哪些环境有关?3.金属的哪些性质与其放电电位有关?4.金属在化学反应中的作用有哪些?5.金属在哪类反应中常被用作催化剂?五、拓展延伸1.研究不同金属的腐蚀速度,设计实验并进行观察比较。
2.研究金属催化剂在不同化学反应中的应用情况,并撰写实验报告。
通过本节课的学习,我们对金属的化学性质有了更深入的了解,明白了金属与非金属的区别以及金属在化学反应中的作用。
第八单元金属和金属材料课题2 金属的化学性质第1课时学习目标:1.熟练掌握常见金属与氧气的反应以及与盐酸和某些金属化合物溶液的置换反应,进一步熟悉常见金属的化学性质。
2.自主学习、合作探究,加深对常见金属化学性质以及对置换反应概念的理解;3.积极投入全力以赴享受学习的过程,体会进步的快乐;重点:常见金属与氧气的反应;金属与盐酸、金属化合物溶液的置换反应;难点:常见金属的置换反应;自主预习使用说明及学法指导:1 .认真阅读教材9—11页,了解金属与氧气以及盐酸的反应,了解置换反应的概念,记忆金属活动性顺序,再完成教材助读设置的问题,依据发现的问题,然后再读教材或查阅资料,解决问题。
2.将预习中不能解决的问题标识出来,并填写到后面“我的疑惑”处。
3.完成时间15分钟。
一、知识准备1.请同学们回忆在氧气的化学性质中,我们研究了哪几种金属和氧气的反应?你还能回忆起这些反应的现象吗?2.回忆化合反应、分解反应的概念。
二、教材助读1.金属与氧气的反应实验证明大多数金属都能与氧气发生反应,但反应的难易与剧烈程度不同,铝能与氧气反应吗?若能,写出化学方程式。
金呢?其他金属呢?⑴结合教材“活动与探究”,思考反应现象不同的原因?⑵从反应物与生成物的物质类别如单质、化合物的角度分析,金属与酸的反应有什么特点?⑶对置换反应与化合反应、分解反应进行比较。
三、预习自测1、下列可用于配制或盛放玻尔多液的容器是()A、玻璃瓶B、铁桶C、塑料桶D、铅桶答案:AC2、医疗上的“理疗热法”,是利用细铁粉缓慢氧化放出均匀稳定的热,使患处保持温热活血状态,则5.6克铁粉完全氧化成红色粉末,消耗氧气的质量为()答案:B3、“真金不怕火炼”的原因是()A、金的熔点高B、金的硬度大C、金的密度大D、金不活泼高温时也不与氧气反应答案:D4、写出镁、铜、氧气、盐酸两两间能发生反应的化学方程式,并注明反应类型。
5.“目前世界上有近20亿的人患有缺铁性贫血”。
第八单元金属和金属材料课题2 金属的化学性质第1课时探究目标:1、常见金属与氧气、盐酸和稀硫酸的反应,并会推断常见金属活动性强弱;2、掌握置换反应的概念,并与化合反应、分解反应相比较;3、通过亲自做探究实验,激发并形成持续的学习化学的兴趣,并学会与别人合作、交流,增强协作精神。
探究重、难点:认识常见金属重要的化学性质,并会用金属活动性解释某些与生活有关的化学问题。
探究过程【知识小竞赛】1、金属除具有一些共性之外,还具有各自的特性,如铁、铝等大部分金属都呈银白色,但铜呈_______色;常温下,铝、铜等大部分金属为固体,但汞为______。
2、判断下列关于合金的说法的正误(正确的划“√”,错误的划“×”):①合金均是混合物();②合金中至少含有一种金属();③合金具有金属特性();3、铁的两种合金是_____和___,它们组成上的主要区别是__________不同。
【探究之旅一】金属和氧气的反应【自主学习】阅读课本第9页第2、3段,写出金属Mg、Al、Fe、Cu与O2反应的化学方程式:Mg、Al与O2的反应(均在常温下):2Mg + O2=2MgO;________________________________Fe、Cu与O2的反应(分别在点燃和高温的条件下):___________________________;2Cu + O22CuO真金不怕火炼:金(Au)即使在高温下也不与氧气反应【展示交流】1、由Mg、Al、Fe、Cu、Au 与氧气反应的难易和剧烈程度知道:____、____活动性较强,_____、____次之,____最不活泼。
2、铝是一种比较活泼的金属,但是铝制品耐腐蚀性能好,原因是:铝在空气中与氧气反应,表面生成一层致密的___________薄膜,从而阻止铝进一步被氧化。
【探究之旅二】金属和酸的反应【活动与探究】实验内容:分别取4只试管,各放入金属镁、锌、铁、铜各2小块,分别加入5ml稀盐酸或稀硫酸,观察现象,并比较反应的剧烈程度,完成下表:注意事项:①安全第一,切不可将酸流到手上或衣服上;②化学实验基本操作要正确,如固体药品的取用,液体药品的倾倒;③药品取用要按规定量取用;④小组各成员分工明确,团结合作。
人教版九年级化学下册第八单元课题2金属的化学性质导学案(无答案)一、学习目的:知识与技艺:⑴基本目的:了解铁、铝、铜等罕见金属与氧气的反响。
⑵中层目的:看法罕见金属与盐酸、硫酸的置换反响,⑶开展目的:了解物质的性质和用途的关系。
进程与方法:初步学会运用观察、实验等方法获取信息,并能用图表和化学言语表达有关信息。
情感、态度与价值观:激起学习化学的兴味培育勤于思索、严谨务实、勇于实际的迷信肉体。
二、学习重点:金属与氧气、罕见酸的反响三、学习难点:罕见的置换反响。
四、教具预备:仪器药品、铁片、铜片、铝片、铁丝、铜丝、铝丝、酒精灯、火柴、砂纸、稀盐酸、稀硫酸等。
五、教学流程:预习案学习指点:1.仔细阅读课本P-9~11中基础知识局部及图片、表格等,看法金属与氧气、盐酸、硫酸的反响,完成温故知新和教材助读设置的效果。
2.把不能处置的标志出来,并填写到前面〝我的疑惑〞处。
Ⅰ、温故知新:1.什么是金属资料,金属资料有什么共异性质?2.回想化合反响、分解反响的概念。
Ⅱ、教材助读:合金1.〔先生自读课本P9第一局部外容完成以下效果:〕写出以下金属与氧气反响的化学方程式:镁,铁,铝,铜,2、为什么铝具有很好的抗腐蚀功用?3、观看图片猜想:镁、锌、铁、铜这四种金属与盐酸、稀硫酸反响的猛烈水平:反响最猛烈是,次之为,较为缓慢的是,没有清楚现象的是。
4、什么是置换反响?Ⅲ预习自测:〔实际,是检验真理的独一规范〕1.以下金属中,常温下就易和氧气反响的是 ( )A.铝B.铂C.铁D.铜2.以下表达中,属于金属化学性质的是〔〕A.纯铁是雪白色固体 B.铝在空气中易与氧气反响生成致密的氧化膜C.铜容易传热、导电 D.钨有很高的熔点我的疑惑:〔学贵有疑!〕请将预习中不能处置的困难或疑问写上去,供课堂处置。
__________探求案Ⅰ、我思索、我收获: 1.为什么铝具有很好的抗腐蚀功用?2.能不能用纯铁制运输盐酸?Ⅱ、【协作探求】〔让你我的思想碰撞出智慧的火花!〕探求一:金属与氧气的反响实验现象生动性比拟铁丝在氧气中熄灭镁条在空气中熄灭思是?结论:镁、铝、铁、铜、金几种金属中,比拟生动,次之,最不生动。
8.2 金属的化学性质课型:新授课设计审批:班级:小组:姓名:使用时间:月日星期课题:第课时累计课时学习过程(定向导学:教材9页至11页)流程及学习内容学习要求和方法一、目标解读(2分钟)1、知道铁、铜、铝等金属与氧气的反应。
2、初步认识常见金属与酸的置换反应。
3、识记金属活动顺序表,能利用金属活动顺序判断金属活动性的强弱,并能设计实验证明金属活动性的强弱。
学习重点:掌握金属与氧气、与酸反应的化学性质。
学习难点:会根据实验现象比较金属的活泼性。
二、夯实基础(25分钟)知识点一:金属的化学性质1、写出下列反应的化学方程式,并写出现象(1)镁在空气中燃烧(2)铝在空气中生成致密氧化铝保护膜(3)铁丝在氧气中燃烧(4)铜在空气中加热(5)“真金不怕火炼”是金在高温下也不与反应,说明金的(填“物理”、“化学”)性质非常稳定。
以上能说明哪些金属化学性质活泼,哪些金属化学性质不活泼?思考:铝的化学性质很活泼,为什么通常铝制品却很难腐蚀?为什么不宜用钢刷、沙等来擦洗铝制品?。
2、探究金属和酸发生的反应(结合课本第10页活动与探究动手完成)(1)按照实验过程填写下表反应物反应现象剧烈程度反应化学方程式镁与稀盐酸锌和稀盐酸铁和稀盐酸铜和稀盐酸提示:可以从反应的剧烈程度、难易程度或者反应的条件等来思考。
常见的酸有盐酸(HCl)、硫酸(H2SO4)提示:将稀盐酸改为稀硫酸的现象也是一样的。
你能确定那一种金属作制取氢气的原料吗?制取氢气要使用稀硫酸,而不宜用盐酸(氯化氢气体的水溶液),原因氯化氢气体可以挥发,导致收集的氢气不纯。
(2)思考:怎么检验生成的气体?三、能力提升(8分钟)1、以上金属中,能与酸发生反应(产生氢气)的金属是,不能与酸发生反应(不产生氢气)的金属是。
可根据反应时是否由氢气产生将金属分成两类。
根据实验现象结合本图,你能得出这四种金属的活动性顺序吗?2、讨论:以上各金属与酸的反应,从反应物和生成物的物质类别如:单质、化合物的角度分析,这些化学方程式有什么共同的特点?知识点2:置换反应置换反应的概念: ,用字母表示为:。