最新2020年高考化学专题复习《电解质溶液中的图像分析》
- 格式:pdf
- 大小:3.55 MB
- 文档页数:11
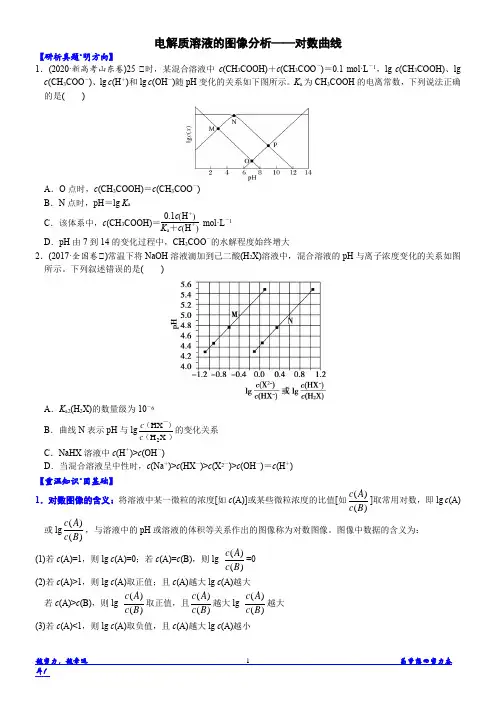
2020届高考化学提分攻略题型13 电解质溶液图像题一、解题策略1.审题:弄清图像含义,通过观察弄清横坐标、纵坐标的含义及单位;搞清特殊点的意义,如坐标轴的原点,曲线的起点、终点、交叉点、极值点、转折点等;分析曲线的变化趋势如斜率的大小及升降。
2.信息提取:挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算。
3.答题:联想化学原理,根据选项内容,确定正确选项。
二、题型分析【典例1】【2019·课标全国Ⅱ,12】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。
硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。
下列说法错误的是()A.图中a和b分别为T1、T2温度下CdS在水中的溶解度B.图中各点对应的K sp的关系为:K sp(m)=K sp(n)<K sp(p)<K sp(q)C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动【答案】B【解析】a、b分别表示温度为T1、T2时溶液中Cd2+和S2-的物质的量浓度,可间接表示对应温度下CdS在水中的溶解度,A项正确;K sp只受温度影响,即m、n、p三点对应的K sp相同,又T1→T2,c(S2-)、c(Cd2+)都增大,故K sp(m)=K sp(n)=K sp(p)<K sp(q),B项错误;向m点的溶液中加入少量Na2S固体,溶液中c(S2-)增大,温度不变,K sp不变,则溶液中c(Cd2+)减小,溶液组成由m点沿mpn线向p方向移动,C 项正确;温度降低时,CdS的溶解度减小,q点的饱和溶液的组成由q沿qp线向p方向移动,D项正确。
【典例2】【2018·课标全国Ⅲ,12】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.050 0 mol·L-1 Cl-溶液的滴定曲线如图所示。

2019-2020年高三化学复习专练—电解质溶液中离子平衡图像分析1、在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,所得滴定曲线如下图所示。
下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )A.a点:c( HCO3-)>c(Cl-)>c(CO32-)B.b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO2-3)+c(OH-)C.c点:c(OH -)+c(CO32-)=c(H+)+c(H2CO3)D.d点:c(Cl-)=c(Na+)2、25℃时,向盛有50 mL pH=3的HA溶液的绝热容器中加入pH =14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。
下列叙述正确的是( )A.HA溶液的物质的量浓度为0 0l mol/LB.a-b的过程中,混合溶液不可能存在:c(A-)=c(Na+)C.b—c的过程中,温度降低的主要原因是溶液中A一发生了水解反应D.25℃时,HA的电离平衡常数K约为1.25×10-63、常温下,向10mL某浓度的H2SO3溶液中滴加0.2mol﹒L-1 NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )A.曲线Ⅱ代表H2SO3的浓度B.V(NaOH)=10ml时,溶液温度最高,c(H2SO3)= 0.1mol﹒L-1C.水的电离程度大小:a点<b点<c点D.若c点pH=6,则K2(H2SO3)=10—84、在某温度时,将nmol/L的氨水滴入10mL0.1mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。
下列有关说法正确的是( )A .a 点K W =1.0×10-14B .b 点:c(NH 4+)>c(Cl -)>c(H +)>c(OH -)C .25℃时,一水合氨的电离平衡常数为10-7/(10n-1)(用n 表示)D .水的电离程度:b>c>a>d5、电解质溶液的电导率越大,导电能力越强。


高考电解质溶液中的图像分析1、弱酸H2A 溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ(X)随溶液pH变化的关系如图所示[已知δ(X) = ],下列说法不正确的是(图中:a=1.25、b=4.27)()A. 已知pK a=-lgK a,则pK a1=1.25B. 0.1mol·L-1的NaHA溶液显碱性C. 0.1mol·L-1Na2A溶液中:2c(H2A)+c(HA-)=c(OH-)-c(H+)D. 0.1mol·L-1NaHA溶液中:c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-12、常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是()A. 当V( NaOH )= 20mL时,pH<7B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)3、25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH 的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。
下列说法错误的是()A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-)C. 25℃时,反应CO32-+H2O HCO3-+OH-的平衡常数对数值1gK=-3.79D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)4、室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,下列说法不正确的是( )A. H2A的电离方程式为:H2A==H++HA-HA-A2-+H+B. 室温下,电离平衡HA-A2-+H+的平衡常数Ka=10-3C. 等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)D. 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)5、室温下,用0.1000mol/L盐酸分别滴定20.00mL浓度均为0.1000mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积V[HCl(aq)]的变化关系如图所示。

电解质溶液的图像分析与解题思路【常见图像与解题思路】1、强碱滴定一元弱酸——抓“五点”室温下,向20 mL 0.1 mol·L -1 HA 溶液中逐滴加入0.1 mol·L -1 NaOH 溶液,溶液pH 的变化如图所示关键点分析溶液中溶质成分及粒子浓度大小关系抓反应的“起始”点,即A 点,判断酸、碱的相对强弱溶质为HA ,0.1mol·L -1 HA 溶液的pH>1,故HA 为弱酸 粒子浓度大小关系:c (HA)>c (H +)>c (A -)>c (OH -) 抓反应的“一半”点,即B 点,判断是哪种溶质的等量混合溶质是等物质的量的CH 3COOH 和CH 3COONa ,且pH<7 粒子浓度大小关系:c (A -)>c (Na +)>c (HA)>c (H +)>c (OH-)抓溶液的“中性”点,即C 点,判断溶液中溶质的成分及哪种物质过量或不足 溶质是NaA 和少量的HA ,pH=7粒子浓度大小关系:c (Na +)=c (A -)>c (H +)=c (OH -) 抓“恰好”反应点,即D 点,判断生成的溶质成分及溶液的酸碱性溶质是NaA ,pH>7粒子浓度大小关系:c (Na +)>c (A -)>c (OH -)>c (H +) 抓反应的“过量”点,即E 点,判断溶液中的溶质,判断哪种物质过量 溶质是等物质的量的NaA 和NaOH ,pH>7粒子浓度大小关系:c (Na +)>c (OH -)>c (A -)>c (H +)【对点训练1】1、25℃时,向20.00 mL 的NaOH 溶液中逐滴加入某浓度的CH 3COOH 溶液。
滴定过程中,溶液的pH 与滴入CH 3COOH 溶液的体积关系如图所示,点②时NaOH 溶液恰好被中和。
则下列说法中,错误的是( )A .CH 3COOH 溶液的浓度为0.1 mol·L -1B .图中点①到点③所示溶液中,水的电离程度先增大后减小C .点④所示溶液中存在:c (CH 3COOH)+c (H +)=c (CH 3COO -)+c (OH -)D .滴定过程中会存在:c (Na +)>c (CH 3COO -)=c (OH -)>c (H +)2、HR 是一元酸。





专项 电解质溶液中陌生图像的分析在新高考山东卷中该类题型一般出现在不定项选择题中,以第15个选择题的形式压轴出现。
通过分析整体的溶液图像分为两大类:【类型1 溶液反应过程中陌生图像】1.两坐标为对数的直线型示例分析(1)常考有关对数示例①pC :类比pH ,即为C 离子浓度的负对数。
规律为pC 越大,C 离子浓度越小。
②p K :平衡常数的负对数,规律为p K 越大,平衡常数越小。
对于一元弱酸(HX):p K a =pH -lg c (X -)c (HX ),lg c (X -)c (HX )越大,HX 的电离程度越大。
③AG =lg c (H +)c (OH -),规律为AG 越大,酸性越强。
AG =0时,溶液为中性。
(2)图像示例①pOH—pH 曲线:⇒⎩⎨⎧ Q 点为中性,M 点为酸性,c (OH -)H 2O =1×10-b mol·L-1N 点为碱性,c (H +)H 2O =1×10-b mol·L -1②常温下将KOH 溶液滴加到二元弱酸(H 2X)溶液中,混合溶液的pH 与离子浓度变化的关系图:⇒③常温下,二元弱酸H 2Y 溶液中滴加NaOH 溶液,所得混合溶液的pH 与离子浓度变化的关系如图所示:⇒⎩⎪⎨⎪⎧ L 1代表lg c (HY -)c (H 2Y )-pH H 2Y 的K a1=10-2.7,K a2=10-4.3e 点:c (H 2Y )=c (Y 2-)二元弱酸(H 2X )一级电离程度大于二级电离程度。
横坐标越大代表电离程度越大,因此,N 代表一级电离曲线,M 代表二级电离曲线。
根据m 点、n 点的坐标计算Ka1和Ka2。
2.粒子的物质的量分数或浓度与pH 的关系图像分析T ℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH 溶液,所得溶液中三种粒子H 2C 2O 4、HC 2O -4、C 2O 2-4的物质的量分数(δ)与pH 的关系如图所示: ⇒⎩⎪⎨⎪⎧ HC 2O -4的电离程度大于水解程度K a1=10-1.2,K a2=10-4.2pH =2.7时,c (C 2O 2-4)·c (H 2C 2O 4)c 2(HC 2O -4)=10-33.酸、碱反应过程中lg c (H +)H 2O 与酸或碱的体积关系25 ℃,以10 mL 0.1 mol·L -1一元弱碱BOH 溶液中滴加0.1 mol·L -1盐酸为例⇒⎩⎨⎧ a 点:若a 点lg c (H +)H 2O =-11,则K b =10-5b 点:BOH 与盐共存,为中性d 点:盐酸与盐共存,为酸性c 点:V 0=10 mL ,恰好反应生成盐【类型2 沉淀、溶解平衡图像】1.两坐标为离子浓度的曲线型图像⇒⎩⎪⎨⎪⎧ K sp (CaSO 4)=8×10-6b 点的Q c >K sp ,有沉淀析出d 点的Q c <K sp ,溶液不饱和温度不变,增加c (SO 2-4), 沿曲线a →c 变化2.两坐标为对数或负对数的直线型图像已知pCu =-lg c (Cu +),pX =-lg c (X -),式中X -表示卤素离子。
解读3 电解质溶液图像【考点过关】(1)(2017年高考全国卷Ⅰ)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
下列叙述错误的是A.K a2(H 2X)的数量级为10-6B 。
曲线N 表示pH 与2(HX )lg (H X)c c -的变化关系 C.NaHX 溶液中(H )(OH )c c +->D 。
当混合溶液呈中性时,2(Na )(HX )(X )(OH )(H )c c c c c +---+>>>=(2)(2017年高考全国卷Ⅱ)改变0。
11mol L -⋅二元弱酸2H A 溶液的pH ,溶液中的2H A 、HA -、2A -的物质的量分数(X)δ随pH 的变化如图所示[已知22(X)(X)(H A)(HA )(A )c c c c δ--=++]。
下列叙述错误的是A .pH=1。
2时,2(H A)(HA )c c -=B .22lg[(H A)] 4.2K =-C .Ph=2.7时,22(HA )(H A)(A )c c c -->=D .pH=4。
2时,2(HA )(A )(H )c c c --+==(3)(2016年高考全国卷Ⅰ)298K 时,在20.0mL 0。
10mol 1L -⋅氨水中滴入0.10 mol 1L -⋅的盐酸,溶液的pH 与所加盐酸的体积关系如图所示。
已知0.10 mol 1L -⋅氨水的电离度为1.32%,下列有关叙述正确的是A .该滴定过程应该选择酚酞作为指示剂B .M 点对应的盐酸体积为20.0 mLC .M 点处的溶液中c (NH 4+)=c (Cl -)=c (H +)=c (OH -)D .N 点处的溶液中pH<12(4)(2016年高考天津卷)室温下,用相同浓度的NaOH 溶液,分别滴定浓度均为0.1mol·L -1的三种酸(HA 、HB 和HD )溶液,滴定的曲线如图所示,下列判断错误的是( )A .三种酸的电离常数关系:K HA >K HB >K HDB .滴定至P 点时,溶液中:c(B -)>c(Na +)>c(HB )>c (H +)>c (OH -)C .pH=7时,三种溶液中:c (A -)=c (B -)=c(D -)D .当中和百分数达100%时,将三种溶液混合后:c(HA )+c (HB)+c(HD )=c(OH -)-c(H +)(5)(2015年高考全国卷Ⅰ)浓度均为0.10mol/L 、体积均为V 0的MOH 和ROH 溶液,分别加水稀释至体积V ,pH 随0lg V V 的变化如图所示,下列叙述错误..的是()A .MOH 的碱性强于ROH 的碱性B .ROH 的电离程度:b 点大于a 点C .若两溶液无限稀释,则它们的c(OH -)相等D .当0lg V V =2时,若两溶液同时升高温度,则)()(++R c M c 增大(6)(2015年高考山东卷)室温下向10mL0.1mol·L-1NaOH溶液中加入0。