电解质溶液图像专题
- 格式:pptx
- 大小:325.15 KB
- 文档页数:8


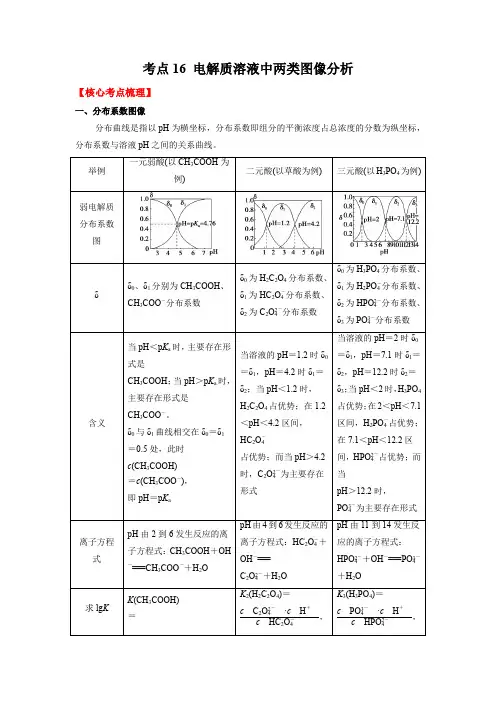
考点16 电解质溶液中两类图像分析【核心考点梳理】一、分布系数图像分布曲线是指以pH为横坐标,分布系数即组分的平衡浓度占总浓度的分数为纵坐标,分布系数与溶液pH之间的关系曲线。
举例一元弱酸(以CH3COOH为例)二元酸(以草酸为例)三元酸(以H3PO4为例)弱电解质分布系数图δδ0、δ1分别为CH3COOH、CH3COO-分布系数δ0为H2C2O4分布系数、δ1为HC2O-4分布系数、δ2为C2O2-4分布系数δ0为H3PO4分布系数、δ1为H2PO-4分布系数、δ2为HPO2-4分布系数、δ3为PO3-4分布系数含义当pH<p K a时,主要存在形式是CH3COOH;当pH>p K a时,主要存在形式是CH3COO-。
δ0与δ1曲线相交在δ0=δ1=0.5处,此时c(CH3COOH)=c(CH3COO-),即pH=p K a当溶液的pH=1.2时δ0=δ1,pH=4.2时δ1=δ2;当pH<1.2时,H2C2O4占优势;在1.2<pH<4.2区间,HC2O-4占优势;而当pH>4.2时,C2O2-4为主要存在形式当溶液的pH=2时δ0=δ1,pH=7.1时δ1=δ2,pH=12.2时δ2=δ3;当pH<2时,H3PO4占优势;在2<pH<7.1区间,H2PO-4占优势;在7.1<pH<12.2区间,HPO2-4占优势;而当pH>12.2时,PO3-4为主要存在形式离子方程式pH由2到6发生反应的离子方程式:CH3COOH+OH-===CH3COO-+H2OpH由4到6发生反应的离子方程式:HC2O-4+OH-===C2O2-4+H2OpH由11到14发生反应的离子方程式:HPO2-4+OH-===PO3-4+H2O求lg K K(CH3COOH)=K2(H2C2O4)=c C2O2-4·c H+c HC2O-4,K3(H3PO4)=c PO3-4·c H+c HPO2-4,c CH 3COO -·c H+c CH 3COOH ,从图可知, c (CH 3COO -) =c (CH 3COOH) 时pH =p K =4.76。



专题7-电解质溶液图像题真题演练1. 【2021广东选择考适应性测试9】. 叠氮酸(HN 3)与NaOH 溶液反应生成NaN 3。
已知NaN 3溶液呈碱性,下列叙述正确的是A. 0.01 mol·L -1HN 3溶液的pH=2 B. HN 3溶液的pH 随温度升高而减小 C. NaN 3 的电离方程式: NaN 3= Na ++3N 3-D. 0.01 mol·L -1 NaN 3溶液中: c (H +)+ c (Na + )= c (N 3-)+ c (HN 3) 【答案】B【解析】A .由题意,NaN 3溶液呈碱性,叠氮酸根(N 3-)会发生水解,说明HN 3为弱酸,在水溶液中不能完全电离,故0.01 mol·L -1 HN 3溶液的pH>2,A 错误;B .HN 3为弱酸,电离方程式为HN 3=H + +N 3-,电离是吸热过程,升高温度促进HN 3的电离,c (H +)增大, pH 减小,B 正确;C .NaN 3是强电解质,完全电离出Na +和N 3-,电离方程式为 NaN 3= Na ++ N 3-,C 选项错误;D .0.01 mol·L -1 NaN 3溶液中:由物料守恒 c (Na +)= c (N 3-)+ c (HN 3),故D 错误。
2.2.【2021重庆市学业水平选择性考试13】 草酸H 2C 2O 4是二元弱酸。
向100 mL 0.40 mol/L H 2C 2O 4溶液中加入1.0 mol/L NaOH 溶液调节pH ,加水控制溶液体积为200 mL 。
测得溶液中微粒的δ(x)随 pH 变化曲线如图所示,δ(x)=-2-2242424c(x)c(H C O )+c(HC O )+c(C O ),x 代表微粒H 2C 2O 4、HC 2O -4或C 2O 2-4。
下列叙述正确的是A. 曲线Ⅰ是HC 2O -4的变化曲线 B. 草酸H 2C 2O 4的电离常数K= 1.0×10-1.22C. 在 b 点,c(C 2O 2-4)+2c(OH -)= c(HC 2O -4)+c(H +) D. 在c 点,c(HC 2O -4)=0.06 mol/L 【答案】B【解析】A .当酸性越强时,曲线Ⅰ表示的微粒的含量越高,可推知曲线Ⅰ是H 2C 2O 4的变化曲线,曲线Ⅱ是HC 2O -4的变化曲线,曲线Ⅲ是C 2O 2-4的变化曲线,A 错误;B .在a 点H 2C 2O 4的浓度和HC 2O -4的浓度相等,pH=1.22,则草酸H 2C 2O 4的电离常K =()()()-24224c HC O ?c H c H C O+=()c H +=10-1.22,则B 正确;C .在 b 点,c(C 2O 2-4)= c(HC 2O -4),且溶液呈酸性,若c(C 2O 2-4)+2c(OH -)= c(HC 2O -4)+c(H +),则2c(OH -)= c(H +),显然不成立,C 错误;D .在c 点,HC 2O -4的含量为0.15,而H 2C 2O 4的物质的量为0.1L× 0.40 mol/L=0.04 mol,则HC 2O -4的物质的量为0.15×0.04 mol=0.006 mol,溶液体积为0.2L ,c(HC 2O -4)=0.006 mol÷0.2L=0.03 mol/L,D 错误。


电解质溶液图像专题探究(二课时)电解质溶液图像专题探究的意义:电解质溶液的图像题,从知识载体的角度看:一可用于考查溶液中离子浓度的大小比较;二可考查溶液中离子浓度的守恒问题;三可考查有关电解质溶液的各种计算;四可结合生产和生活实际考查分离和提纯等具体的化学应用问题。
从图像的主要类型看:第一类,是有关电离平衡的图像(包括今天要讲的分布分数图);第二类,是有关滴定曲线的图像;第三类,是有关沉淀溶解平衡的图像。
探究1 分布分数图例1.(2012江苏∙15)25℃,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。
下列有关离子浓度关系叙述正确的是()A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(Na+)+c(H+)=c(CH3COOH)+c(OH-) +c(Cl-)【反思】本题同其它的直接考查离子浓度大小比较和离子浓度守恒问题的题有什么不同?【图像含义】上述这种图可叫分布分数图,可以表示溶液中各种组分随pH的变化而变化的曲线,以下为二元弱酸H2C2O4的分布分数图。
请同学们先观察图像,再回答下列问题①大约在什么pH范围内H2C2O4浓度较其它组分浓度高?②大约在什么pH 时HC 2O 4-浓度最高?③大约在什么pH 范围内C 2O 42-浓度较其它组分浓度高? ④大约在什么pH 时HC 2O 4-和C 2O 42-浓度相等?【拓展】不仅是弱酸的各种组分可随pH 变化,实际上弱碱以及配合物的组分也可随pH 发生变化,生产生活中常利用这种图像指导物质的分离和提纯。



电解质溶液图像专题电解质溶液的图像题,从知识载体的角度看:一可用于考查溶液中离子浓度的大小比较;二可考查溶液中离子浓度的守恒问题;三可考查有关电解质溶液的各种计算;四可结合生产和生活实际考查分离和提纯等具体的化学应用问题。
常见的图像题类型:1.pH(或pOH)—体积的变化曲线2.微粒分布分数(或系数)—pH(或pOH)的变化曲线3.浓度—浓度的变化曲线4.对数的变化曲线5.导电能力(或电导率) —体积(或浓度)变化曲线【练1】分布分数图:可以表示溶液中各种组分随pH的变化而变化的曲线。
1.25℃,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。
下列有关离子浓度关系叙述正确的是()A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(Na+)+c(H+)=c(CH3COOH)+c(OH-) +c(Cl-)2.草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:(1)图中曲线1表示的分布系数变化;曲线3表示的分布系数变化.现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4 ②NaHC2O4 ③H2C2O4 ④(NH4)2C2O4 ⑤NH4HC2O4 已知NaHC2O4溶液显酸性.(2)Na2C2O4溶液中,c(Na+)/c(C2O42-) 2 (填“>”、“=”、“<”),原因是(用离子方程式表示).(3)常温下,向10mL 0.1mol/L H 2C 2O 4溶液中滴加0.1mol/L NaOH 溶液,随着NaOH 溶液体积的增加,当溶液中c (Na +)=2c (C 2O 42-)+c (HC 2O 4-)时,溶液显 性(填“酸”、“碱”或“中”),且V (NaOH ) 10mL (填“>”、“=”或“<”).(4)下列关于五种溶液的说法中,正确的是A .溶液②中,c (C 2O 42-)<c (H 2C 2O 4)B .溶液②中,c (H 2C 2O 4)+c (OH -)=c (C 2O 42-)+c (H +)C .溶液④⑤中都符合c (NH 4+)+c (H +)=c (HC 2O 4-)+2c (C 2O 42-)+c (OH -)D .五种溶液都符合c (H 2C 2O 4)+c (HC 2O 4-)+c (C 2O 42-)=0.1mol ·L -1.(5)五种溶液中c (H 2C 2O 4)由大到小排列的顺序是具体解法:“四看三联系一注意”:四看:(1)先看图像的面与线,面要看横坐标和纵坐标的含义,线要看各组分浓度随pH 的变化趋势(2)再看图像的点,点要看起点,终点和交点对应的pH(3)点还要看最高点和最低点对应的pH 和各组分存在的pH 范围(4)最后看各条曲线相互重叠程度的大小三联系: 找出某个pH 对应的成分后再联系电离平衡和水解平衡的规律进行判断;一注意: 答题时还要特别注意在图表中没有提供的信息或潜在信息。