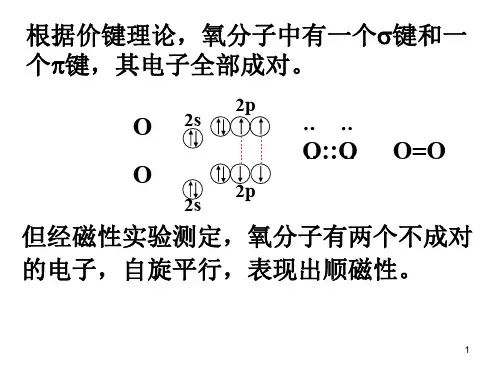
0
eg
t2 g
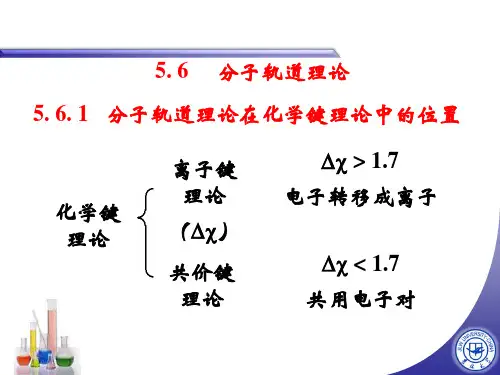
遇到中性配体,例如N2、CO等与中性原子结合而成得 络合物,晶体场理论完全失效,只有用分子轨道理论加以
说明。
例如
在[FeF6]3-及[Co(NH3)6]3+中可认为6个成键分子轨 道由六个配位体得12个电子所占用。因前者分裂 能△0大于成对能P,后者△0小于成对能P。则可得 结论:在[Co(NH3)6]3+中六个d电子刚好占用三个 t2g(dxy,dyz,dxz)金属轨道,故[Co(NH3)6]3+就是低自 旋配合物,这与晶体场理论中强场作用相一致。而 [FeF6]3-中Fe3+得五个d电子分别占用三个t2g及两个 eg*轨道,形成高自旋配合物,这相当于弱晶体场 作 用得结果。总得排布情况如图6,7、
极大值方向沿x,y,z轴指向配位 体,可形成以轴为称得ó分子轨道
这六个原子轨道与六个配位体L得ó型 轨道进行线性组合,形成ó键。为有效成键, 这种组合必须就是对称性匹配得,有四种 情况,如图1-4。组合成得十二个分子轨道, 一半就是成键得,一半就是反键得,具体能 级如图5。
ɑ1g=s+ ó1+ …+ó6
t 1u
图6
a 1g
4p 4s 3d
t1u
ɑ1g
e g
eg
△
t2g ó
t2geg t1uɑ源自g Fe3+6F-
图7
4p 4s 3d
t1u ɑ1g eg t2g
Co3+
t 1u
a 1g
e g
△ ó
t2g eg t1u ɑ1g
6NH3
二 ∏分子轨道 金属离子得t2g(dxy,dxz,dyz)轨道虽不能与配体得ó轨道形成有效分 子轨道,但若配体有∏型轨道时,还就是可以重叠形成∏键得,配位 体所提供得∏轨道可以就是配位原子得p或d原子轨道,也可以就 是配位基团得∏*分子轨道,如图8所示。