OOS调查报告
- 格式:doc
- 大小:59.50 KB
- 文档页数:2


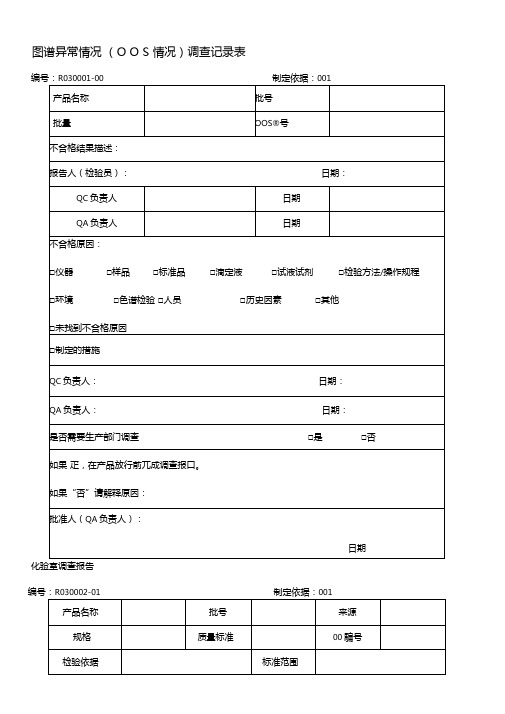
图谱异常情况(O O S 情况)调查记录表编号:R030001-00 制定依据:001化验室调查报告编号:R030002-01 制定依据:001化验室调查□已确认00或生原因(见附件)□未确认00或生原因(见附件)□防止再次发生的纠正措施(见附件)QC审核人:日期:QA审核人:日期:批准人(QC负责人):日期:附件:需要附加的资料:所有的原始记录、重新化验的记录,以及负责整改的措施的人员等。
化验室调查报告常规调查记录表检查项目清单备注1、仪器所用仪器设备是否经过确认或校验[是][ :否][N/A]是否超过了校检的日期[是] [ 否][N/A]所有功能是否正常[ 是][ :否][N/A]校准参数是否正确[是] [ 否][N/A]在检验之前和检验期间有『无进行必要的系统适应性试验[ 是][ 否][N/A]2、样品、标准品、滴液、试液试剂样品取样是否均匀[ 是][ :否][N/A]样品是否被污染[ 是][ :否][N/A]所用的标准品、滴定液、试液等是否都在有效期内[是] [ 否][N/A]所用的标准品、滴定液、试液等配制、稀释是否正确[是] [ 否][N/A]所用的标准品、滴定液、试液等有无明显的杂质或降解[是] [ 否][N/A]所用的标准品、滴定液、试液等标签是否正确[是] [ 否][N/A]标准品的储藏条件是否适当[是][ :否] [N/A]标准品的标示值(反应值)是否同以前相同[是][否][N/A]是否有证据表明化验中所使用的试剂、溶剂、标准品、玻璃器皿(或其他任何容器)或其他物料已经被污染[是][否][N/A]所使用的试剂、溶剂、标准品、玻璃器皿或其他辅助设备是否正确[是][否][N/A]3、检验方法/操作规程计算是否正确[是] [ 否][N/A]所用方法是否正确[ 是][ 否][N/A]化验方法的操作是否严格按照sop执行[ 是][ 否][N/A]检验方法是否为药典或国家标准或检验方法有无经过验证[是] [ 否][N/A]续4、 环境操作环境的温湿度、气压是否造成了检验结果的误差[N/A]样品及称量是否正确,有效成分是否溶解完全,稀释、振摇和萃取时间是否 足够、方法是合适 [ 是][[N/A]标准品、溶液储存是否符合要求,标准品是否正确干燥,玻璃仪器疋 要求,即所用玻璃仪器是否干燥洁净,容量刻度仪器是否经过校正, 是否采用了校正值。
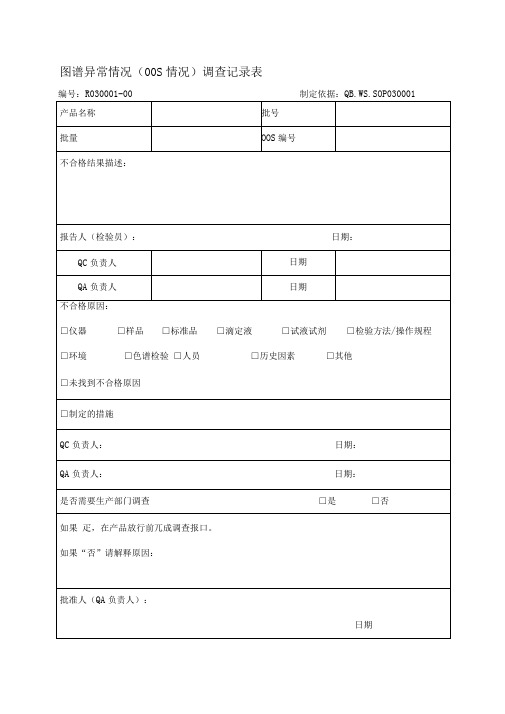
图谱异常情况(00S情况)调查记录表
编号:R030001-00 制定依据:QB.WS.SOP030001
编号:R030002-01 制定依据:QB.WS.SOP030001
化验室调查
□已确认OOS发生原因(见附件)
□未确认OOS发生原因(见附件)
□防止再次发生的纠正措施(见附件)
QC审核人:日期:
QA审核人:日期:
批准人(QC负责人):日期:
附件:
需要附加的资料:所有的原始记录、重新化验的记录,以及负责整改的措施的人员等。
――常规调查记录表
注:按照调查的内容,在[是][否]上打“V”,如果打“V”请在备注中简要说明, 必要时附表。
如果此项内容不在调查范围,可在[N/A](表示不适用)上“V” 。
检测记录
编号R031319-00 制定依据:QB.WS.SOP030001 检品名称:检品批号:
检验日期:检验标准:
检验说明:
检验方法及检验结果:
00S化验室调查评估表
编号:R030003-01 制定依据:QB.WS.S0P030001。

Guidance for Industry,Investigating Out of Specification(OOS) Test Results for Pharmaceutical Production行业指南:药品检验结果OOS的调查DRAFT GUIDANCE指南草案U.S. Department of Health and Human ServicesFood and Drug AdministrationCenter for Drug Evaluation and Research (CDER)September 1998CP #TABLE OF CONTENTS目录I. INTRODUCTION 序言. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. . . . . . . . . . .. . . . .. . . .. . . 1II. BACKGROUND . 背景. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ... . . . . . . 1 III. IDENTIFYING AND ASSESSING OOS TEST RESULTS OOS检验结果的判断和评估. . .. 2 Responsibility of the Analyst 检验员的责任. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. 2 B. Responsibilities of the Supervisor主管的责任. . . . . . . . . . . . . . . .. . . . . .. . . . . . . . . . . . . . . .. . . . .3 IV. INVESTIGATING OOS TEST RESULTS OOS 检验结果的调查. . . . . . . . . . . . . . . . . . . .. 5A. General Investigational Principles . . 一般调查原则. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5B. Laboratory Phase of an Investigation . 实验室的调查阶段. . . . . . . . . . . . . . . .. . . .. . . . . . . . . . . . 6 V. CONCLUDING THE INVESTIGATION . .调查结论. . . . . . . . . . . . . . . . . . . . . . . . .. . .. . . . . . . 10A. Interpretation of Investigation Results . 调查结果的解释. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10B. Reporting . . .报告. . . . . . . . . . . . . . . . . . . . . . . . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11This guidance has been prepared by the Office of Compliance/Division of Manufacturing and ProductQuality, Center for Drug Evaluation and Research (CDER) at the Food and Drug Administration. This guidance document represents the Agency’s current thinking on evaluating OOS test results. It does not create or confer any rights for or on any person and does not operate to bind FDA or the public. An alternative approach may be used if such approach satisfies the requirements of the applicable statute, regulations, or both.本指南由FDA的CDER的达标办公室/制造、产品、质量分部起草,本指南阐明了机构关于评估OOS 检验结果的现行的想法。

oos调查超规(OOS)原因调查一、目的:确定超规(OOS)原因的调查程序。
二、适用范围:适用于成品(原料药、制剂)、中间体放行、稳定性数据超出规格的调查。
三、责任者:四、正文:1 概述:当OOS检验结果出现时应该进行调查,调查的目的是确定引起OOS的原因。
即使因OOS结果判断了不合格批,仍必须进行调查以确定该结果是否影响到同种产品其它批号或其它产品。
对调查包括调查结论和随后采取的措施应进行记录。
调查必须是完全的,及时的,不带有任何偏见的,记录是完整的和经得起科学推敲的。
调查的最初阶段应该在试验溶液丢弃前,对实验室数据正确性进行最初评估,这样,假定认为是实验室错误或仪器故障,可以用原溶液测定。
如果最初的评估评估显示在得到该数据的分析过程中没有发生错误,必须立即开展一个完全的不合格调查。
2 人员职责2.1检验员的责任2.1.1 检验员首要责任是取得正确实验室检验结果。
检验员应该意识到在实验过程中可能发生的潜在的问题和应该注意可能产生OOS结果的问题。
2.1.2 检验员应使用经过批准的检验方法。
2.1.3 检验员应该保证使用经过校验和适当维护的仪器。
2.1.4 检验员应该保证使用现行的标准物质和合格的试剂、试液。
2.1.5 某些分析方法有系统适应性要求,不符合要求的系统不能使用。
例如:在色谱系统中,在进行色谱检测期间内间隔一段时间进样对照品溶液去测定漂移、噪声和重复性。
如果对照品响应值显示该系统功能不正常,在可疑的时间内收集的所有数据应该被适当标识并不能使用。
在决定是否使用可疑期间之前的数据前,应鉴别故障的原因并予以纠正。
2.1.6在丢弃样品制备液和标准制备液之前,检验员应该核查数据对标准的符合性。
当获得意想不到的结果且没有明显的理由时,应该保留样品制备液且检验员应该通知主管。
应该立即开始评估检验结果的正确性。
如果错误是明显的,如:样品溶液有洒出或样品成分的未完全转移,检验员应该立即记录所发生的情况。
检验结果超标情况的调查及处理操作规程内容:1、定义:检验结果超标:超出质量标准的检验结果(简称OOS结果)和超出趋势的检验结果(OOT结果)的统称。
超出质量标准的检验结果(简称OOS结果):不符合既定的质量标准或接受标准的检验结果。
任何有OOS结果的产品都不能被放行。
超出趋势的结果(简称OOT结果):此结果没有超出既定的质量标准或接受标准的限度,但已产生的适当数量的数据不符合正常的结果分布。
任何出现OOT结果的产品仍将要被放行。
OOT 只是用于内部管理控制的目的。
有效结果:在适当、科学并经批准的条件下所产生的检验结果,不管是否在质量标准或接受标准的限度之内。
无效结果:若依照科学的依据,如果某项检验结果在不正确或未获准的条件下产生,该结果即视为无效结果,需摒弃。
局外检验结果:由不明确原因导致的检验结果。
通过统计学分析,它往往超出其它数据的范围之外,可作为被抛弃的结果。
一般用于微生物检验而不是化学检验结果的分析。
实验室的调查:在实验室内展开的调查,(比如,调查是与试剂制备/仪器和分析方法等等有关的)以找出导致异常检验结果的原因。
再分析:对准备的同种样品进行的再次检验,例如可导致异常检验结果的部分样品或稀释液。
再取样:从物料原始的包装和批次中获取额外的物料。
这直接涉及到返回到物料的原包装/批次,并对物料进行额外取样。
再检验:同一样品的不同部分的重复分析。
对照样品:以前曾经检测合格的或具有良好特性的样品。
实验室错误:在实验室发生的,由检验员、仪器或设备的某部分、或物料所引起的错误。
包括使用错误的检验标准;不正确的样品或对照品/标准品的制备程序;使用校准有误的天平,有误差的设备或仪器;计算错误。
2.职责:QA经理:QA经理应确保本规程符合当地和政府的有关药品生产管理规范的要求;对由任何实验物料/产品产生的OOS结果做出质量决定;对调查进行监督,以确保进行了正确的调查及记录,且通知了相关部门。
QC经理:QC经理有责任就本规程的内容要求对检验员进行培训;确保检验员无论何时遇到检验结果超标情况,都要遵守本规程的要求;指导检验员按本规程的要求进行实验室内部调查;协助实施实验室以外的调查;确保进行了正确的调查及记录;确保报告所有的调查结果,且通知了相关部门。