金属金属多重键化学
- 格式:ppt
- 大小:1.68 MB
- 文档页数:57

编号13 特殊键型附重要化合物结构(课堂笔记)(π键缺电子键多重金属键“有张力”的键磷氢键氧桥键过氧键)2010级化学一班李海波一、π键π键代表分子(自己补充)d-pπ反馈键K[Pt(C2H4)Cl3]、K[Pt(C2H2)Cl3]、M x(CO)y[V(CO)6、Fe(CO)5、Co2(CO)8]、H3PO4(p→dπ键)、SiO4d-dπ键p-pπ键CO学习要求:准确知道相关原子之间用的轨道,相关原子提供的电子以及相关原子成键的类型(σ,π,σ、π、δ多重键)......................................................。
.1、[Pt(C2H4)Cl3]-具有平面正方形结构,Pt2+价电子结构5d8,Pt2+先dsp2杂化,杂化轨道分别与3个Cl-和一个CH2=CH2成键。
乙烯的π电子。
3个Cl-的孤对电子和乙烯的π电子进入Pd2+的空轨道,形成σ配键。
另外,Pd2+的未参加杂化的d轨道中的电子可以部分地反馈到乙烯的π*反键轨道,形成d-p反馈π键。
这种结构使乙烯分子活化。
2、在金属羰合物中,配体CO分子以碳原子上的孤对电子向金属原子空的杂化轨道进行端基配位,形成σ键。
同时,为了不使金属原子的负电荷过度集中,金属原子d轨道上的电子可部分地反馈到配体的能级相近的且对称性匹配的π*轨道上,形成d-pπ反馈键,增强了该化合物的稳定性。
类似的配体还有:N2、CN-、NO+、C2H2、C2H4、CP、C6H6。
3、H3PO4中,非羟基氧3个2p轨道上的4个电子被压在2个轨道中,两两成对,空出一个2p 轨道,可以接受磷原子sp3杂化轨道上的孤对电子,形成σ配位键。
与此同时,氧原子上的两对孤对电子可与磷原子空的3d轨道重叠形成2个p→dπ配位键,但是这里的2个p→dπ配位键有效性不强,所以P-O之间虽然是三重键,但实际上测得的键长接近双键。
格氏盐、H2SO4、HClO4等含有非羟基氧的分子中都有p→dπ键。

![[化学]第六章 金属金属多重键](https://uimg.taocdn.com/545e4df728ea81c758f578f8.webp)




多重键的特性及其与单键的区别——化学键教案化学键是连接在一起形成分子的原子之间的相互作用力。
化学键的类型包括离子键、共价键和金属键。
共价键分为单键、双键、三键和四键等。
本文主要讨论多重键与单键的区别及其特性。
一、多重键的特性多重键是共价键的一种,特指两个原子间的共价键中含有两个或两个以上的等效化学键。
通常情况下,多重键由一个σ键和一个或多个π键组成。
σ键由两个原子的核心轨道叠加形成,而π键则由两个原子的非对称轨道叠加形成。
多重键在化学反应中的反应速度通常比单键快。
这是因为多重键中的π电子能够轻易地离开和返回原子核,从而使反应速率增加。
另外,多重键的强度比单键的强度高,这也使得它在化学反应中更为活跃和稳定。
二、与单键的区别1.性质不同多重键和单键在分子的性质上有很大不同。
多重键可以使分子更为稳定,因为它有更多的化学键能量来保持分子的形状和稳定性。
相比之下,单键不那么强劲,它们比多重键更容易产生断裂或改变形状。
2.共价键键长不同多重键和单键在分子的共价键键长上也有很大差别。
多重键的键长通常较短,而单键的键长相对较长。
这是因为多重键中的σ键相对较短和强壮,导致整个键的长度变短。
3.分子形状及能量不同多重键的存在也会影响分子的形状和能量。
多重键可以使分子更加紧密,形状更为对称。
相比之下,单键会使分子看上去更为扭曲,因为单键不能像多重键一样完全覆盖两个原子之间的距离。
多重键还能增加分子的能量,使其更加不稳定和活跃。
4.化学反应速率不同多重键和单键在化学反应中的反应速率也有所不同。
多重键中的高度离域π电子比单键中的离域π电子更易于进行反应,因此多重键的反应速率通常更快。
三、实例多重键在化学反应中的应用非常广泛。
下面以乙炔分解反应为例说明多重键的应用。
乙炔是一种含有三键的气体。
它可以通过加热来分解,并释放出氢气和碳。
这种反应是一个重要的工业反应,因为它可以用来制造工业用的氢气和合成气。
乙炔的分解反应速度非常快,这是因为它含有一个很强的三键。

基础化学无机部分1章习题1.举例说明什么是拉平效应?为什么水不能区分H2SO4, HNO3, HClO4的酸性强弱,也不能区分O2-, NH2-, Ph3C-的碱性强弱?2.BrF3自电离产物是什么?用VSEPR写出BrF3和自电离产物的几何构型。
3.对非水液氨、醋酸和硫酸,写出:4.它们各自的自电离方程。
5.把CH3COOH分别置于上述三种溶剂中,各发生什么变化?写出反应方程式。
6.把b的三种溶液和纯溶剂相比,原溶剂的酸碱性各有何变化?溶质在各溶剂中是酸还是碱?7.为什么在强酸性溶剂中制备阳离子物种如I2+和Se82+,而在强碱性溶剂中制备阴离子物种如S42-, Pb94-?8.亚磷酸H3PO3的结构式可表示为P(OH)3和HPO(OH)2两种异构体,实验测得亚磷酸的pKa值为1.8,判断亚磷酸的结构应该是什么?次磷酸的pKa为2.00,写出其正确的结构式。
9.把NR3, S2-, NF3, O2-, NH3, OH-, NCl3, N3-按照碱性大小排序,并解释。
10.BH3和BF3都可和(CH3)2NPF2生成加合物,在一种加合物中,B原子和N相连,另一种则和P相连,绘出两种结构式,并说明形成两种结构的原因。
2章习题11.2价Ni配合物[Ni(PPh3)2Cl2]为顺磁性,Pt的类似配合物[Pt (PPh3)2Cl2]为反磁性,写出每种化学式的所有异构体。
12.讨论下两组异构体的偶极矩偶极矩情况:(a) 顺式和反式的MA2B4,(b)经式和面式的MA3B3。
13.绘出[Co(en)2Cl2]+、[Co(en)2NH3Cl]2+和[Co(en)(NH3)2Cl2]+的所有几何和光学异构体。
14.[Co(en)3 ]3+、[Ru(bpy)3]2+和[PtCl(dien)]+ (dien二乙三胺)中,哪些是手性化合物?15.Mo(CN)84-水溶液作13C的NMR表征,只得到一个峰,由此你得到什么结构信息?16.绘出五氨络钴(III)-μ-硫氰根-五氰络钴(III)的结构。


多重键(2012江苏(3))在结构化学中,对多重键的研究具有重要意义。
常见的多重键有双键和三键,2005年11月,美国Science杂志发表了Power等人的文章,报导了一种具有Cr Cr五重键的稳定化合物,这是目前发现的最短的铬—铬键。
结构见右图。
化学键的形成可以通过对称性形象地描述为:σ键是成键原子轨道头对头形成的;肩并肩形成的是π键,而面对面形成的是δ键。
那么,在上述具有Cr Cr五重键的化合物中,对其成键情况进行分析发现Cr原子的价层电子排布特点是其成键情况的决定因素,它利用其4s轨道去与相邻的C原子形成Cr-C σ键,5个d轨道形成五重键,其中两个铬原子的d z2轨道沿着z轴方向形成一个σ键。
则轨道d x2-r2和d xy面对面形成两个____键,轨道d xz和d yz肩并肩形成两个____键。
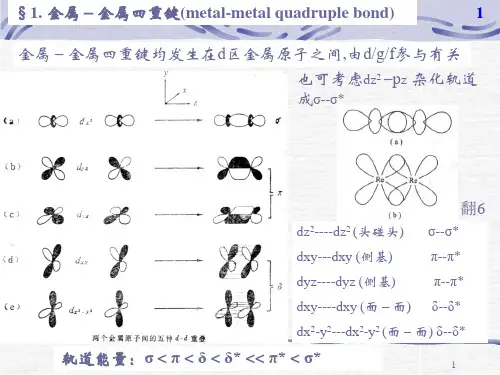
δ,π(2011江苏选拔赛第1题)(8分)1964年,美国的F.A.Cotton研究小组测定了K2[Re2Cl8] ·2H2OCl8]2-结构(如右图所的晶体结构,他们惊讶地发现在[Re示)中Re-Re间距离异常的短,仅为224pm(金属Re中Re-Re间的平均距离为275pm)。
此后,类似结构的化合物不断被发现,无机化学这个古老的学科因此开辟了一个新的研究领域。
关于[Re2Cl8]2- 的结构,请回答下列问题:1-1 Re原子的价电子组态是,[Re2Cl8]2-中Re的化合价为;1-2 [Re2Cl8]2-中Re-Re间距离特别短,是因为存在四重键,它们分别是1σ键、2π键、1δ键(请填键型和个数);1-3 Cl原子的范德华半径和为360pm,因此理应期望[Re2Cl8]2-为式构型,但实验结果如图所示却为重叠式构型,其原因是上下四个Cl重叠才能形成四重键。
(1),+3(2)1σ、2π、1δ(3)交叉式,上下四个Cl重叠才能形成四重键当两个Re3+沿z轴方向相互靠近时,两个Re3+的d z2轨道以“ 头碰头”重叠形成σ键;两个Re3+ 的d xz轨道d yz轨道以“ 肩并肩”重叠形成两个d—d π键;而两个Re3+ 的d xy轨道以“面对面”重叠形成δ键,说明Re和Re之间形成四重键。