四1金属多重键
- 格式:ppt
- 大小:10.19 MB
- 文档页数:93

编号13 特殊键型附重要化合物结构(课堂笔记)(π键缺电子键多重金属键“有张力”的键磷氢键氧桥键过氧键)2010级化学一班李海波一、π键π键代表分子(自己补充)d-pπ反馈键K[Pt(C2H4)Cl3]、K[Pt(C2H2)Cl3]、M x(CO)y[V(CO)6、Fe(CO)5、Co2(CO)8]、H3PO4(p→dπ键)、SiO4d-dπ键p-pπ键CO学习要求:准确知道相关原子之间用的轨道,相关原子提供的电子以及相关原子成键的类型(σ,π,σ、π、δ多重键)......................................................。
.1、[Pt(C2H4)Cl3]-具有平面正方形结构,Pt2+价电子结构5d8,Pt2+先dsp2杂化,杂化轨道分别与3个Cl-和一个CH2=CH2成键。
乙烯的π电子。
3个Cl-的孤对电子和乙烯的π电子进入Pd2+的空轨道,形成σ配键。
另外,Pd2+的未参加杂化的d轨道中的电子可以部分地反馈到乙烯的π*反键轨道,形成d-p反馈π键。
这种结构使乙烯分子活化。
2、在金属羰合物中,配体CO分子以碳原子上的孤对电子向金属原子空的杂化轨道进行端基配位,形成σ键。
同时,为了不使金属原子的负电荷过度集中,金属原子d轨道上的电子可部分地反馈到配体的能级相近的且对称性匹配的π*轨道上,形成d-pπ反馈键,增强了该化合物的稳定性。
类似的配体还有:N2、CN-、NO+、C2H2、C2H4、CP、C6H6。
3、H3PO4中,非羟基氧3个2p轨道上的4个电子被压在2个轨道中,两两成对,空出一个2p 轨道,可以接受磷原子sp3杂化轨道上的孤对电子,形成σ配位键。
与此同时,氧原子上的两对孤对电子可与磷原子空的3d轨道重叠形成2个p→dπ配位键,但是这里的2个p→dπ配位键有效性不强,所以P-O之间虽然是三重键,但实际上测得的键长接近双键。
格氏盐、H2SO4、HClO4等含有非羟基氧的分子中都有p→dπ键。


无机化学实验课大纲2004年修订目的和要求在学生系统的学习了普通化学、分析化学、有机化学和物理化学等理论课程和实验课程的基础上,与主干基础课“中级无机化学”配套讲授,通过本实验课教学使学生以全新的视角对现代无机化学有一个比较深入和全面的了解,学习、掌握相关的实验技术。
通过实验课的学习提高学生学习无机化学的兴趣,培养学生综合运用各方面的知识、各种实验技术、手段以及完整地解决实际问题的能力,培养学生养成良好的实验习惯,培养学生严谨、细致的科学作风和勇于探索的科学精神。
要求学生进行实验前,应认真阅读实验讲义和相关文献,对实验题目涉及的相关理论主题和研究领域做比较充分的了解。
并通过预习对实验内容有一个正确、全面的理解,注意是理解而不仅仅是了解。
因为预习不仅仅是看讲义、抄讲义。
预习的主要目的是要求实验者对实验原理、内容和过程有比较充分的理解;能够有组织、有条理、有针对性的地完成实验,对实验中可能出现的现象、问题及相应的解决办法有所准备。
所以无机实验的预习报告不要求抄实验讲义,而是要求学生对讲义提出的预习思考题进行分析、判断,做出比较正确的理解。
任课教师应在实验前审阅学生的预习报告,然后组织学生就预习和实验中可能出现的问题进行讨论,在此基础上进行实验。
鼓励学生对实验过程中出现的问题做比较深入的,超出讲义要求的研究,以此培养学生的探索精神。
要求学生以规范的格式做原始记录,整理分析数据,对实验现象和结果进行讨论,并按规范书写实验报告。
要求学生学会使用有关的手册、文献资料及信息网络查阅相关的公式和常数。
要求学生在实验中进行规范的操作,保证学生的人身安全和实验室的安全。
要求学生保持实验室的整洁、卫生、节约药品,培养良好的科研道德。
学时:60实验评分:预习20%,实验30%,报告40%,卫生5%,纪律5%。
实验讲义:自编主要参考书:1.项斯芬、姚光庆,“中级无机化学”,北京大学出版社,20032.Zvi Szafran, Ronald M.Pike,Mon M.Singh,“Microscale Inorganic Chemistry-a comprehensivelaboratory experience”New York : J. Wiley, c1991.3.北京大学化学系分析化学教学组,“基础分析化学实验”,北京大学出版社,1998年第二版4.北京大学化学学院物理化学教学组,“物理化学实验”,北京大学出版社,2002年第4版5.北京大学化学学院有机化学研究所编关烨第, 李翠娟, 葛树丰修订,“有机化学实验”,北京大学出版社2002第2版对实验大纲的说明:1.强化学生对无机化学领域的深入了解。

元素周期表中的次周期性现象一.p区第二周期元素的特殊性1.单键与多重键的键能下表给出了p区的某些元素部分单键与重键键能的变化表:一般来说,每族元素的键能自上而下会因为原子半径的增大而有规律的减少,但是从表1-a可知对于p区第二周期的C, N, O, F的某些单键的键能会反常的小,这可能是因为它们的原子半径小,参与成键的原子中又有孤对电子,它们的排斥作用抵消了部分的键能。
而p区第三周期的单键键能很大,是因为它们的原子半径合适,既削弱了孤对电子的排斥作用,又不足以使得原子核对外层电子的吸引力过弱;同时d-pπ键也有一定的贡献。
另一方面,从表1-b又可以看出p区非金属元素与H形成的键能以及ⅣA族同核双原子的键能均是有规律的下降没有出现异常,这是因为H没有孤对电子,而ⅣA元素自身成键时4个价电子全部被用于成键没有多余的孤对电子。
从表1-c可以清楚的知道第二周期的重键比第三周期的大很多,显然第二周期的元素的这些键中的p-pπ键因为离核近,明显比第三周期的p-pπ键稳定。
2.d轨道引起的最大配位数的改变因为第二周期p区元素的价电子层只有2s和2p共4个价轨道没有d轨道,同时2s,2p与3s的能量相差甚远无法激发,因此只能利用2s和2p轨道以sp、sp2或sp3的杂化方式成键,所以在这些元素的化合物中,这些化合物的原子的最大配位数只能是4。
然而同族第三周期以后的元素因为有了多余的d轨道,配位数将大大丰富,杂化方式也可以是sp3d、sp3d2甚至是sp3d3。
最大配位数的限制引起的元素的性质的巨大不同主要体现在了卤化物的水解上。
由于C没有d轨道,CCl4中四个价电子全部被占据因而水无法进攻CCl4所以无法水解,而SiCl4以后的四卤化物有空的d轨道留给水去进攻,因此会剧烈水解。
对于NCl3来说由于有孤对电子因此也能水解,但同一主族的PCl3却因为同时有孤对电子与空的d轨道,因此有和NCl3完全不同的水解机理与产物。



多重键的特性及其与单键的区别——化学键教案化学键是连接在一起形成分子的原子之间的相互作用力。
化学键的类型包括离子键、共价键和金属键。
共价键分为单键、双键、三键和四键等。
本文主要讨论多重键与单键的区别及其特性。
一、多重键的特性多重键是共价键的一种,特指两个原子间的共价键中含有两个或两个以上的等效化学键。
通常情况下,多重键由一个σ键和一个或多个π键组成。
σ键由两个原子的核心轨道叠加形成,而π键则由两个原子的非对称轨道叠加形成。
多重键在化学反应中的反应速度通常比单键快。
这是因为多重键中的π电子能够轻易地离开和返回原子核,从而使反应速率增加。
另外,多重键的强度比单键的强度高,这也使得它在化学反应中更为活跃和稳定。
二、与单键的区别1.性质不同多重键和单键在分子的性质上有很大不同。
多重键可以使分子更为稳定,因为它有更多的化学键能量来保持分子的形状和稳定性。
相比之下,单键不那么强劲,它们比多重键更容易产生断裂或改变形状。
2.共价键键长不同多重键和单键在分子的共价键键长上也有很大差别。
多重键的键长通常较短,而单键的键长相对较长。
这是因为多重键中的σ键相对较短和强壮,导致整个键的长度变短。
3.分子形状及能量不同多重键的存在也会影响分子的形状和能量。
多重键可以使分子更加紧密,形状更为对称。
相比之下,单键会使分子看上去更为扭曲,因为单键不能像多重键一样完全覆盖两个原子之间的距离。
多重键还能增加分子的能量,使其更加不稳定和活跃。
4.化学反应速率不同多重键和单键在化学反应中的反应速率也有所不同。
多重键中的高度离域π电子比单键中的离域π电子更易于进行反应,因此多重键的反应速率通常更快。
三、实例多重键在化学反应中的应用非常广泛。
下面以乙炔分解反应为例说明多重键的应用。
乙炔是一种含有三键的气体。
它可以通过加热来分解,并释放出氢气和碳。
这种反应是一个重要的工业反应,因为它可以用来制造工业用的氢气和合成气。
乙炔的分解反应速度非常快,这是因为它含有一个很强的三键。


c14结构的金属间化合物-回复现代科学已经证明,金属间化合物是一类具有特殊结构和性质的化合物。
在这些化合物中,金属原子通过共享电子形成一个稳定的晶格结构。
金属间化合物的结构可以通常用c14结构来描述,这种结构是一种非常稳定且具有良好机械性能的结构。
C14结构的金属间化合物中,金属原子呈密堆积的排列方式。
这种结构是由彼此相连的平面层构成,其中平面层之间通过金属原子之间的键合连接。
这种结构的一个特点是,每个原子都与其他14个原子形成键合,因此被称为c14结构。
接下来,让我们详细介绍一下金属间化合物的c14结构及其相关特性。
首先,由于金属原子之间的键合较强,c14结构的金属间化合物具有较高的熔点和硬度。
这使得它们在高温条件下具有较好的热稳定性和耐磨性。
其次,c14结构的金属间化合物还具有良好的导电性和导热性。
这是因为金属原子之间形成的键能够提供电子在晶格中自由流动的通道。
因此,c14结构的金属间化合物常被用作导电材料和散热材料。
此外,c14结构的金属间化合物还具有一些其他的特殊性质。
例如,它们通常具有较高的弹性模量和抗蠕变性,使其在高温下具有较好的力学性能。
这种结构还使得金属间化合物具有较好的抗氧化性和耐腐蚀性。
另外,c14结构的金属间化合物还可以在特定条件下表现出超导性和磁性。
这是因为在c14结构中,金属原子之间的键合可以形成一个复杂的电子结构,使得其在低温或强磁场下表现出特殊的性质。
最后,c14结构的金属间化合物在科学研究和工业应用中有着广泛的应用。
例如,它们常被用作电子器件的金属导线、传感器、储能材料、合金增强剂等。
此外,c14结构的金属间化合物在材料科学领域也有重要的应用,例如用于制备超硬材料、高温合金以及磁性材料等。
综上所述,c14结构的金属间化合物具有特殊的结构和性质,包括高熔点、硬度、导电性和导热性等。
这种结构的金属间化合物具有广泛的应用潜力,对于材料科学和工业技术的发展具有重要的意义。

有机金属化学这一部分将在配位化学的基础上,介绍一类特殊的金属配合物, 即M←C配位的有机金属化合物的相关知识。
包括特殊的结构、化学键及应用。
主要分为三个部分:有机金属化学金属簇合物金属-金属多重键。
有机金属化学研究有机金属化合物的合成、结构、性质与应用的化学分支。
有机金属化合物:含有M←C配位键的化学物种一、概述二、金属羰基化合物三、金属不饱和烃化合物四、金属环多烯化合物一、概述1. 历史的回顾1825年Zeise盐的发现,第一个有机金属化合物K[PtCl3(C2H4)]·H2O此后,各类M←C化合物被合成2Zn + 2RI ⎯→R2Zn +ZnI2烷基锌1890年Ni(s) + 4CO(g) ⎯→Ni(CO)4(g)羰基镍Mg + CH3I ⎯→CH3MgI格氏试剂SCI 1.61211.70.4293.4711.335发展迅速,引人注目,成为一个独立的分支学科。
1963 Journal of Organometallic Chemistry 创刊1964Advances in Organometallic Chemistry 1966Organometallic Chemistry Review1971 Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry1982Organometallics1982 Polyhedron2.研究意义*结构和化学键的特殊性——理论*应用:①催化Ziegler-Natta烯烃均相聚合格氏试剂有机合成②其它应用Ni的提纯40°CNi(s) + 4CO(g) ⎯⎯→Ni(CO)4(g)制备半导体III-V族、II-VI族CVD的发展前体源→薄膜材料二、金属羰基化合物1.有效原子序数规则(EANR: effective atomic number rule)EAN=过渡金属原子的电子数+ 配原子授电子总数有效原子序数规则(EANR):如果:EAN等于同周期中稀有气体的原子序数则:该配位单元稳定简化之:十八电子规则(过渡金属):价层电子数VEN=过渡金属价层电子数+ 配原子授电子数=18则配合物稳定VEN=18,则配位单元稳定十八电子规则是很有用的经验规律,没有太多的理论假设,很直观,易掌握应用。
多重键(2012江苏(3))在结构化学中,对多重键的研究具有重要意义。
常见的多重键有双键和三键,2005年11月,美国Science杂志发表了Power等人的文章,报导了一种具有Cr Cr五重键的稳定化合物,这是目前发现的最短的铬—铬键。
结构见右图。
化学键的形成可以通过对称性形象地描述为:σ键是成键原子轨道头对头形成的;肩并肩形成的是π键,而面对面形成的是δ键。
那么,在上述具有Cr Cr五重键的化合物中,对其成键情况进行分析发现Cr原子的价层电子排布特点是其成键情况的决定因素,它利用其4s轨道去与相邻的C原子形成Cr-C σ键,5个d轨道形成五重键,其中两个铬原子的d z2轨道沿着z轴方向形成一个σ键。
则轨道d x2-r2和d xy面对面形成两个____键,轨道d xz和d yz肩并肩形成两个____键。
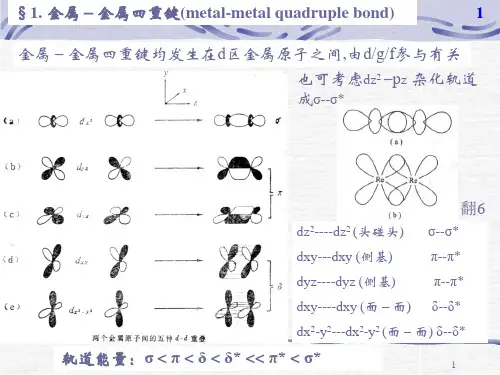
δ,π(2011江苏选拔赛第1题)(8分)1964年,美国的F.A.Cotton研究小组测定了K2[Re2Cl8] ·2H2OCl8]2-结构(如右图所的晶体结构,他们惊讶地发现在[Re示)中Re-Re间距离异常的短,仅为224pm(金属Re中Re-Re间的平均距离为275pm)。
此后,类似结构的化合物不断被发现,无机化学这个古老的学科因此开辟了一个新的研究领域。
关于[Re2Cl8]2- 的结构,请回答下列问题:1-1 Re原子的价电子组态是,[Re2Cl8]2-中Re的化合价为;1-2 [Re2Cl8]2-中Re-Re间距离特别短,是因为存在四重键,它们分别是1σ键、2π键、1δ键(请填键型和个数);1-3 Cl原子的范德华半径和为360pm,因此理应期望[Re2Cl8]2-为式构型,但实验结果如图所示却为重叠式构型,其原因是上下四个Cl重叠才能形成四重键。
(1),+3(2)1σ、2π、1δ(3)交叉式,上下四个Cl重叠才能形成四重键当两个Re3+沿z轴方向相互靠近时,两个Re3+的d z2轨道以“ 头碰头”重叠形成σ键;两个Re3+ 的d xz轨道d yz轨道以“ 肩并肩”重叠形成两个d—d π键;而两个Re3+ 的d xy轨道以“面对面”重叠形成δ键,说明Re和Re之间形成四重键。