第五章 金属金属多重键化学
- 格式:pdf
- 大小:439.81 KB
- 文档页数:38



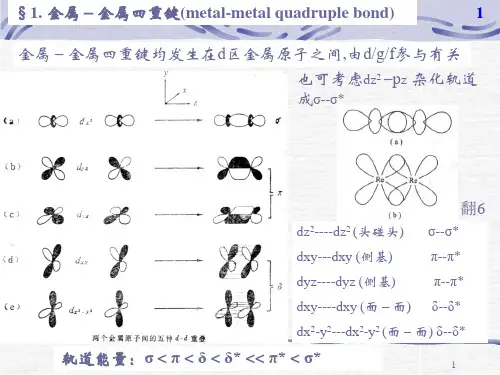

知识整合:金属的性质和利用一、金属的性质(一)金属的物理性质:(1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色)(3)有良好的导热性、导电性、延展性(金属通性)(二)金属的化学性质1.大多数金属可与氧气反应铜在空气中加热:2Cu + O2加热2CuO现象:铜丝表面变黑。
铝在空气中加热氧化:4Al + 3O2加热2Al2O3现象:悬而不落,表面变黯淡注意:在常温下,铝和氧气能发生反应,在铝表面生成一层致密的氧化铝膜,起到保护铝的作用。
4Al + 3O2 = 2Al2O3小结:在加热条件下,绝大多数金属都能与氧气反应,生成金属氧化物,只有个别金属如铂、金等难以被氧化。
2.大多数活泼金属可与酸反应锌粒和稀硫酸反应:Zn + H2SO4 = ZnSO4 + H2↑锌粒和稀盐酸反应:Zn + 2HCl= ZnCl2 + H2↑现象:有气泡产生,放热镁条和稀硫酸反应:Mg + H2SO4 = MgSO4 + H2↑镁条和稀盐酸反应:Mg+ 2HCl= MgCl2 + H2↑现象:迅速产生大量气泡,放出大量热铁丝和稀盐酸反应:Fe + 2HCl=FeCl2 + H2↑铁丝和稀硫酸反应:Fe + H2SO4 =FeSO4 + H2↑现象:缓慢产生气泡,溶液由无色变为浅绿色铝和稀硫酸反应:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑铝和稀盐酸反应:2Al + 6HCl = 2AlCl3 + 3H2↑现象:快速产生气泡,放出大量热注意:铁和酸反应时生成的化合物中铁都为+2价,+2价铁的化合物溶液为浅绿色。
小结:根据常见金属与盐酸或稀硫酸反应时的现象发现:镁反应最剧烈,铜、金等不与酸反应,镁、铁、锌、铝等金属与稀盐酸反应的剧烈程度不同。
常见金属活动性顺序:Mg Al Zn Fe Cu Au金属活动性由强逐渐减弱在金属活动性顺序里:金属活动性强的金属能把位于金属活动性弱的金属从它们的金属化合物溶液中置换出来。

第5章金属冶炼与利用(金属的性质)1、金属的物理性质:大多数金属呈色(除铜色、金色),常温下为体(除汞体),具有金属光泽,具有较好的性、性和延展性。
2、金属的化学性质:(1)与O2的反应(写化学方程式)镁和O2:;铝和O2:;铁和O2:、;铜和O2:。
(2)金属与酸反应(写化学方程式)镁和稀盐酸:;镁和稀硫酸:;铁和稀盐酸:;铁和稀硫酸:。
(3)湿法冶铜的原理(化学方程式):。
3、置换反应:由一种与一种反应,生成另一种和另一种的反应。
(金属活动性顺序):K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金(1)在金属活动性顺序中,金属的位置,它的活动性就;(2)排在的金属(除K、Ca、Na外)能与反应放出,而排在的金属不能与反应放出。
(3)排在的金属(除K、Ca、Na外)能将排在的金属从它们的盐溶液(化合物溶液)中置换出来。
(氢气的实验室制法)(1)药品:和(或)(2)原理:或(3)装置:(4)收集:、(合金及铁的冶炼)1、合金:由一种金属跟其他(或)熔合形成的有的物质。
2、合金的特性:硬度成分金属,熔点成分金属。
合金属于。
3、铁的合金有:生铁和钢。
生铁的含碳量在之间,钢的含碳量在之间。
4、极少数金属在自然界中主要以(游离态)存在,大多数金属以(化合态)存在。
金属化合物在自然界中以的形式存在。
含有矿物的岩石称为。
使金属矿物变成的过程叫做金属的冶炼。
铁矿石:赤铁矿(主要成分)、磁铁矿(主要成分)、黄铁矿(FeS2)。
5、实验室炼铁:实验开始时要先,再,原因是:排尽装置内的,防止发生爆炸;实验结束时要先,再,原因是:防止使玻璃管炸裂、防止。
处理尾气CO的方法有:、。
目的是:。
实验现象:红棕色粉末变为,澄清石灰水。
6、工业炼铁的主要设备是,主要原料是。
其中焦炭和热空气的作用是:提供热源、维持炉温,。
主要原理(化学方程式):;或。
另外还有(化学方程式):、。


第五章 金属的冶炼与利用第1节金属的性质和利用一、金属材料纯金属(90多种) 合金 (几千种)2、金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色) (3)有良好的导热性、导电性、延展性3、金属之最:(1)铝:地壳中含量最多的金属元素(2)钙:人体中含量最多的金属元素 (3)铁:目前世界年产量最多的金属(铁>铝>铜) (4)银:导电、导热性最好的金属(银>铜>金>铝)(5)铬:硬度最高的金属 (6)钨:熔点最高的金属 (7)汞:熔点最低的金属 (8)锇:密度最大的金属 (9)锂 :密度最小的金属4、合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
注:钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。
(1)熔点高、密度小优点 (2)可塑性好、易于加工、机械性能好(3)抗腐蚀性能好5. 生铁和钢(1)钢和生铁都是由铁、碳等元素形成的合金 (2)生铁特点:硬而脆,无韧性,只能铸造钢特点:硬度大、韧性好,有良好的延展性和弹性。
可铸、可锻、可轧 钢和生铁的本质差异:含碳量不同 二、金属的化学性质1、金属材料2锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑铁和稀盐酸Fe + 2HCl=== FeCl2 + H2↑镁和稀盐酸Mg+ 2HCl=== MgCl2 + H2↑铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑3、金属 + 盐→另一金属 + 另一盐(条件:“前换后,盐可溶”)铁与硫酸铜反应:Fe+CuSO4==Cu+FeSO4现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。


多重键的特性及其与单键的区别——化学键教案化学键是连接在一起形成分子的原子之间的相互作用力。
化学键的类型包括离子键、共价键和金属键。
共价键分为单键、双键、三键和四键等。
本文主要讨论多重键与单键的区别及其特性。
一、多重键的特性多重键是共价键的一种,特指两个原子间的共价键中含有两个或两个以上的等效化学键。
通常情况下,多重键由一个σ键和一个或多个π键组成。
σ键由两个原子的核心轨道叠加形成,而π键则由两个原子的非对称轨道叠加形成。
多重键在化学反应中的反应速度通常比单键快。
这是因为多重键中的π电子能够轻易地离开和返回原子核,从而使反应速率增加。
另外,多重键的强度比单键的强度高,这也使得它在化学反应中更为活跃和稳定。
二、与单键的区别1.性质不同多重键和单键在分子的性质上有很大不同。
多重键可以使分子更为稳定,因为它有更多的化学键能量来保持分子的形状和稳定性。
相比之下,单键不那么强劲,它们比多重键更容易产生断裂或改变形状。
2.共价键键长不同多重键和单键在分子的共价键键长上也有很大差别。
多重键的键长通常较短,而单键的键长相对较长。
这是因为多重键中的σ键相对较短和强壮,导致整个键的长度变短。
3.分子形状及能量不同多重键的存在也会影响分子的形状和能量。
多重键可以使分子更加紧密,形状更为对称。
相比之下,单键会使分子看上去更为扭曲,因为单键不能像多重键一样完全覆盖两个原子之间的距离。
多重键还能增加分子的能量,使其更加不稳定和活跃。
4.化学反应速率不同多重键和单键在化学反应中的反应速率也有所不同。
多重键中的高度离域π电子比单键中的离域π电子更易于进行反应,因此多重键的反应速率通常更快。
三、实例多重键在化学反应中的应用非常广泛。
下面以乙炔分解反应为例说明多重键的应用。
乙炔是一种含有三键的气体。
它可以通过加热来分解,并释放出氢气和碳。
这种反应是一个重要的工业反应,因为它可以用来制造工业用的氢气和合成气。
乙炔的分解反应速度非常快,这是因为它含有一个很强的三键。