2021年高考化学一轮复习课时作业26 难溶电解质的溶解平衡
- 格式:doc
- 大小:326.50 KB
- 文档页数:14


课时作业28 难溶电解质的溶解平衡时间:45分钟分值:100分一、选择题(共50分,每小题5分)1.纯净的NaCl并不潮解,但家庭所用的食盐因含有M g Cl2杂质而易于潮解。
为得到纯净的氯化钠,有人设计这样一个实验:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体。
对此有下列说法,其中正确的是( )A.食盐颗粒大一些有利于提纯B.设计实验的根据是M g Cl2比NaCl易溶于水C.设计实验的根据是NaCl的溶解平衡D.在整个过程中,NaCl的物质的量浓度会变大[答案]C[解析]饱和食盐水已不再溶解食盐,但对于M g Cl2并未达到饱和。
NaCl(S)Na+(aq)+Cl-(aq),当M g Cl2被溶解时,C(Cl-)增大,平衡左移,还可得到比原来更多的食盐。
2.有关CaCO3的溶解平衡的说法中,不正确的是( )A.CaCO3沉淀析出和沉淀溶解不断进行,但速率相等B.CaCO3难溶于水,其饱和溶液不导电,属于弱电解质溶液C.升高温度,CaCO3沉淀的溶解度增大D.向CaCO3沉淀中加入纯碱固体,CaCO3的溶解度降低[答案]B[解析]CaCO3固体在溶液中达到溶解平衡后,沉淀溶解与沉淀生成速率相等,但不为0;一般来说,升高温度,有利于固体物质的溶解;CaCO3难溶于水,但溶解的部分是完全电离的,电离出Ca2+和CO2-3,属于强电解质;向CaCO3溶解平衡体系中加入纯碱固体,增大了CO2-3浓度,使溶解平衡向左移动,降低了CaCO3的溶解度。
3.工业废水中常含有Cu2+、CD2+、PB2+等重金属离子,可以通过加入过量难溶电解质FeS、MNS等,使这些金属离子形成硫化物沉淀除去。
根据以上事实,可推知FeS、MNS具有的相关性质为( )A.在水中的溶解能力大于CuS、CDS、PBSB.在水中的溶解能力小于CuS、CDS、PBSC.在水中的溶解能力与CuS、CDS、PBS相同D.均具有较强的吸附性[答案]A[解析]根据题意,FeS、MNS的溶解能力大于CuS、CDS、PBS的溶解能力。
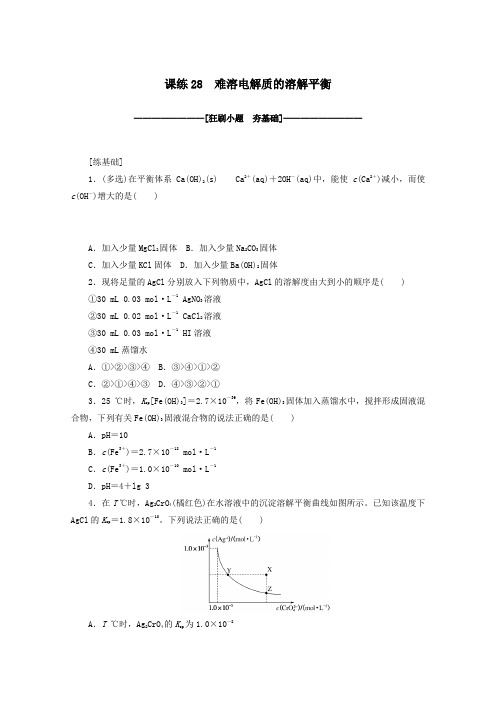
课练28 难溶电解质的溶解平衡————————[狂刷小题夯基础]—————————[练基础]1.(多选)在平衡体系Ca(OH)2(s)Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使c(OH-)增大的是( )A.加入少量MgCl2固体 B.加入少量Na2CO3固体C.加入少量KCl固体 D.加入少量Ba(OH)2固体2.现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是( )①30 mL 0.03 mol·L-1 AgNO3溶液②30mL 0.02 mol·L-1 CaCl2溶液③30 mL 0.03 mol·L-1 HI溶液④30 mL蒸馏水A.①>②>③>④ B.③>④>①>②C.②>①>④>③ D.④>③>②>①3.25 ℃时,K sp[Fe(OH)3]=2.7×10-39,将Fe(OH)3固体加入蒸馏水中,搅拌形成固液混合物,下列有关Fe(OH)3固液混合物的说法正确的是( )A.pH=10B.c(Fe3+)=2.7×10-18mol·L-1C.c(Fe3+)=1.0×10-10mol·L-1D.pH=4+lg 34.在T℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。
已知该温度下AgCl的K sp=1.8×10-10。
下列说法正确的是( )A.T℃时,Ag2CrO4的K sp为1.0×10-8B.T℃时,Y点和Z点时Ag2CrO4的K sp不相等C.向Ag2CrO4饱和溶液中加入K2CrO4,可使溶液由Y点最终变为X点D.T℃时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L -1 K2CrO4的混合溶液中,Cl-先沉淀5.下表是五种银盐的溶度积常数(25 ℃)。

2021年高考化学一轮复习专题9.4 难溶电解质的溶解平衡测案(含解析)一、选择题(本题包括10小题,每小题5分,共50分)1.下列说法正确的是 ( ) A.硫酸钡放入水中不导电,则硫酸钡是非电解质B.物质溶于水达到饱和时,溶解过程就停止了C.绝对不溶解的物质是不存在的D.某离子被沉淀完全是指该离子在溶液中的浓度为02.将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是 ( )①20 mL 0.01 mol/L KCl 溶液②30 mL 0.02 mol/L CaCl2溶液③40 mL 0.03 mol/L HCl溶液④10 mL蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液A.①>②>③>④>⑤ B.④>①>③>②>⑤C.⑤>④>②>①>③ D.④>③>⑤>②>①3.已知25℃时BaSO4饱和溶液中存在BaSO4(s)Ba2+(aq)+SO2-4(aq),K sp=1.1025×10-10,下列有关BaSO4 的溶度积和溶解平衡的叙述正确的是 ( )A.25℃时,向c(SO2-4)=1.05×10-5mol/L的BaSO4溶液中,加入BaSO4固体,c(SO2-4)增大B.向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大C.向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO2-4)D.向该饱和溶液中加入BaCl2固体,则该溶液中c(SO2-4)减小4.为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入(已知Fe(OH)3只要在pH>4的环境里就可以沉淀完全) ( )A.NaOH B.Na2CO3 C.氨水 D.MgO5.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq).下列说法正确的是 ( )A.恒温下向溶液中加CaO,溶液的pH升高B.给溶液加热,溶液的pH升高C.向溶液中加入Na2CO3溶液,其中固体质量增加D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变6.已知25℃时,电离常数K a(HF)=3.6×10-4mol/L,溶度积常数K sp(CaF2)=1.46×10-10.现向1 L 0.2 mol/L HF溶液中加入1 L 0.2 mol/L CaCl2溶液,则下列说法中,正确的是 ( ) A.25℃时,0.1 mol/L HF溶液中pH=1B.K sp(CaF2)随温度和浓度的变化而变化C.该体系中没有沉淀产生D.该体系中HF与CaCl2反应产生沉淀【答案】D【解析】A项,HF为弱酸,0.1 mol/L HF溶液pH>1;B项,K sp只与温度有关;C项,混合后成0.1 mol/LHF 溶液,设0.1 mol/L 的HF 溶液中c (F -)=c (H +)=x mol/L ,则x 20.1-x=3.6×10-4,x ≈6×10-3mol/L ,混合后c (Ca 2+)=0.1 mol/L,0.1 mol/L×(6×10-3 mol/L)2=3.6×10-6>1.46×10-10,应有CaF 2沉淀生成.7.已知K sp (AgCl)=1.8×10-10,K sp (AgI)=1.0×10-16.下列关于难溶物之间转化的说法中错误的是( )A .AgCl 不溶于水,不能转化为AgIB .两种难溶物的K sp 相差越大,难溶物就越容易转化为更难溶的物质C .AgI 比AgCl 更难溶于水,所以,AgCl 可以转化为AgID .常温下,AgCl 若要在NaI 溶液中开始转化为AgI ,则NaI 的浓度必须不低于11.8×10-11mol/L8.(xx 全国新课标I 卷)11.已知K sp (AgCl)=1.56×10-10,K sp (AgBr)=7.7×10-13,K sp (Ag 2CrO 4)=9.0×10-12。

课时作业26难溶电解质的溶解平衡时间:45分钟一、选择题1. 已知Ca(OH) 2的饱和溶液中存在平衡:Ca(OH) 2(s) Ca2,aq)+ 2OH,aq) A H<0,下列有关该平衡体系的说法正确的是(A )①升高温度,平衡逆向移动②向溶液中加入少量碳酸钠粉末能增大钙离子浓度③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液④恒温下向溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH升高⑥向溶液中加入Na2CO3 溶液,其中固体质量增加⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变A .①⑥B .①⑥⑦C .②③④⑥ D.①②⑥⑦解析:A HV0,正反应为放热反应,升高温度,平衡向逆反应方向移动,①正确;②会生成CaCO3,使Ca2+浓度减小,错误;加入NaOH 溶液会使平衡向左移动,有Ca(OH) 2沉淀生成,但Ca(OH) 2的溶度积较大,要除去Ca2 +,应把Ca2+转化为更难溶的CaCO3,③错误;恒温下K sp不变,加入CaO后,溶液仍为Ca(OH) 2的饱和溶液,pH不变,④错误;加热,Ca(OH) 2的溶解度减小,溶液的pH降低,⑤错误;加入Na2CO3溶液,沉淀溶解平衡向右移动,Ca(OH) 2固体转化为CaCO3固体,固体质量增加,⑥正确;加入NaOH固体平衡向左移动,Ca(OH) 2固体质量增加,⑦错误。
2. 对于难溶盐MX ,其饱和溶液中M +和X「的物质的量浓度之间存在等式c(Mjc(X_)= K sp。
一定温度下,将足量的AgCI分别放入下列物质中,AgCl溶解的量由大到小的排列顺序是(B )① 20 mL 0.01 mol「KCl 溶液②30 mL 0.02 mol L: 1 CaCl2溶液 ③40 mL 0.03 mol •「盐酸 ④10 mL 蒸馏水 ⑤50 mL 0.05mol L 1 AgN0 3溶液解析:①中 c(CI -)= 0.01 mol L •—1,②中 c(CI -)= 0.04 mol 1_-~1, ③中 c(CI -)= 0.03 mol 1_-1,④中 c(CI -) = 0,⑤中 c(Ag +) = 0.05 mol L- -1, Ag +或CI -的浓度越大,越能抑制 AgCI 的溶解,AgCI 溶解的量 就越小。

2021届一轮复习训练二十八难溶电解质的溶解平衡1.[2019·河南三门峡模拟]实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L -1 KI溶液,沉淀变为黄色。
下列分析不正确的是()A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶答案:B解析:AgNO3溶液与NaCl溶液发生反应,生成AgCl沉淀和NaNO3,生成的AgCl沉淀存在溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),A正确;因存在AgCl(s)的沉淀溶解平衡,故滤液中一定含有Ag+,B错误;③中发生反应:AgCl(s)+I-(aq)AgI(s)+Cl-(aq),由于K sp(AgI)<K sp(AgCl),故在滤液中加入KI会出现黄色沉淀,C正确;AgCl沉淀能转化为AgI沉淀,说明AgCl的溶解度大于AgI的溶解度,D正确。
2.[2019·上海虹口区模拟]室温下,氢氧化钙固体在水溶液中达到溶解平衡:Ca(OH)2(s)Ca2+(aq)+2OH -(aq),向其中加入以下物质,恢复到室温,Ca(OH)2固体减少的是()A.CH3COONa B.AlCl3 C.NaOH D.CaCl2答案:B解析:加入CH3COONa,由于CH3COO-发生水解而使溶液的碱性增强,溶解平衡逆向移动,Ca(OH)2固体增多,A错误;加入AlCl3,由于Al3+与OH-反应生成Al(OH)3沉淀,溶解平衡正向移动,Ca(OH)2固体减少,B正确;加入NaOH,溶液中c(OH-)增大,溶解平衡逆向移动,Ca(OH)2固体增多,C错误;加入CaCl2,溶液中c(Ca2+)增大,溶解平衡逆向移动,Ca(OH)2固体增多,D错误。
课时作业(二十六) [第26讲难溶电解质的溶解平衡]基础热身1.下列对沉淀溶解平衡的描述正确的是( )A.开始时,溶液中各离子浓度相等B.沉淀溶解达到平衡时,沉淀的速度和溶解的速度相等C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且维持不变D.沉淀溶解达到平衡时,若是再加入难溶性的该沉淀物,将增进溶解2.在BaSO4饱和溶液中,加入Na2SO4(s),达平衡时( )A.c(Ba2+)=c(SO2-4)B.c(Ba2+)=c(SO2-4)=[K sp(BaSO4)]1/2C.c(Ba2+)≠c(SO2-4),c(Ba2+)·c(SO2-4)=K sp(BaSO4)D.c(Ba2+)≠c(SO2-4),c(Ba2+)·c(SO2-4)≠K sp(BaSO4)3.[2012·扬州三模] 下列说法不正确的是( )A.常温下反映2Na2SO3(s)+O2(g)===2Na2SO4(s)能自发进行,则ΔH<0B.Al2(SO4)3溶液蒸干所得固体产物为Al(OH)3C.电解NH4Cl和HCl混合溶液在阴极可生成H2D.用碳酸钠溶液浸泡锅炉水垢:CO2-3+CaSO4===CaCO3+SO2-44.[2012·江西六校第一次联考] 在溶液中有浓度均为 mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:K sp[Fe(OH)3]=×10-39;K sp[Cr(OH)3]=×10-31;K sp[Zn(OH)2]=×10-17;K sp[Mg(OH)2]=×10-11。
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小( )A.Fe3+B.Cr3+C.Zn2+ D.Mg2+5.溶液中含有Cl-、Br-和I-三种离子,其浓度均为 mol·L-1,现向溶液中逐滴加入AgNO3溶液时,最先和最后沉淀的是( )已知:K sp(AgCl)=×10-10(mol·L-1)2,K sp(AgBr)=×10-13(mol·L-1)2,K sp(AgI)=×10-17(mol·L-1)2。
课时达标作业27 难溶电解质的溶解平衡基础题1.有关CaCO3的沉淀溶解平衡的说法中,不正确的是( )A.CaCO3沉淀析出和沉淀溶解不断进行,但速率相等B.CaCO3难溶于水,其饱和溶液不导电,属于弱电解质C.升高温度,CaCO3沉淀的溶解度增大D.向CaCO3溶解平衡体系中加入纯碱固体,会有CaCO3析出2.已知一定量Ca(OH)2固体溶于水后,存在以下平衡状态:Ca(OH)2(s)Ca2+(aq)+2OH-(aq),K sp=4.7×10-6,下列措施可使K sp增大的是( )A.升高温度B.降低温度C.加入适量CaO固体D.加入适量Na2CO3固体3.向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是( )A.AgCl的溶解度增大B.AgCl的溶解度、K sp均不变C.K sp(AgCl)增大D.AgCl的溶解度、K sp均增大4.向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )A.c(CO2-3) B.c(Mg2+) C.c(H+) D.K sp(MgCO3)5.已知K sp(AgCl)=1.8×10-10,K sp(AgI)=1.5×10-16,K sp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )A.AgCl>AgI>Ag2CrO4B.AgCl>Ag2CrO4>AgIC.Ag2CrO4>AgCl>AgID.Ag2CrO4>AgI>AgCl6.已知lg 2=0.301 0,K sp[Mn(OH)2]=2.0×10-13。
实验室制氯气的废液中含c(Mn2+)=0.1 mol·L-1,向该溶液中滴加稀氢氧化钠溶液至Mn2+完全沉淀的最小pH等于( ) A.8.15 B.9.3 C.10.15 D.11.67.下表是Fe2+、Fe3+、Zn2+被OH-完全沉淀时溶液的pH。
课时作业26难溶电解质的溶解平衡时间:45分钟一、选择题1.已知Ca(OH)2的饱和溶液中存在平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)ΔH<0,下列有关该平衡体系的说法正确的是(A)①升高温度,平衡逆向移动②向溶液中加入少量碳酸钠粉末能增大钙离子浓度③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液④恒温下向溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH升高⑥向溶液中加入Na2CO3溶液,其中固体质量增加⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变A.①⑥B.①⑥⑦C.②③④⑥D.①②⑥⑦解析:ΔH<0,正反应为放热反应,升高温度,平衡向逆反应方向移动,①正确;②会生成CaCO3,使Ca2+浓度减小,错误;加入NaOH 溶液会使平衡向左移动,有Ca(OH)2沉淀生成,但Ca(OH)2的溶度积较大,要除去Ca2+,应把Ca2+转化为更难溶的CaCO3,③错误;恒温下K sp不变,加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH不变,④错误;加热,Ca(OH)2的溶解度减小,溶液的pH降低,⑤错误;加入Na2CO3溶液,沉淀溶解平衡向右移动,Ca(OH)2固体转化为CaCO3固体,固体质量增加,⑥正确;加入NaOH固体平衡向左移动,Ca(OH)2固体质量增加,⑦错误。
2.对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间存在等式c(M+)·c(X-)=K sp。
一定温度下,将足量的AgCl分别放入下列物质中,AgCl溶解的量由大到小的排列顺序是(B)①20 mL 0.01 mol·L-1 KCl溶液②30 mL 0.02 mol·L-1 CaCl2溶液③40 mL 0.03 mol·L-1盐酸④10 mL蒸馏水⑤50 mL 0.05 mol·L-1 AgNO3溶液A.①>②>③>④>⑤B.④>①>③>②>⑤C.⑤>④>②>①>③D.④>③>⑤>②>①解析:①中c(Cl-)=0.01 mol·L-1,②中c(Cl-)=0.04 mol·L-1,③中c(Cl-)=0.03 mol·L-1,④中c(Cl-)=0,⑤中c(Ag+)=0.05 mol·L -1,Ag+或Cl-的浓度越大,越能抑制AgCl的溶解,AgCl溶解的量就越小。
3.温度不变时,向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是(B)A.AgCl的溶解度增大B.AgCl的溶解度、K sp均不变C.K sp(AgCl)增大D.AgCl的溶解度、K sp均增大解析:温度不变,向含有AgCl(s)的饱和AgCl溶液中加水时,AgCl 的溶解度、K sp均不变。
4.(2019·湖南衡阳一模)有关难溶电解质的溶度积如下:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),K sp=5.6×10-12;Cu(OH)2(s)Cu2+(aq)+2OH-(aq),K sp=2.2×10-20。
向温度一定、有固态Mg(OH)2存在的饱和溶液中加入某物质或溶液,能使Mg(OH)2固体的质量增加的是(A)A.CH3COONa的饱和溶液B.NH4Cl的饱和溶液C.CuCl2的饱和溶液D.蒸馏水解析:CH3COONa水解显碱性,OH-的浓度增大,Mg(OH)2的沉淀溶解平衡向左移动,Mg(OH)2固体的质量增加;NH4Cl水解显酸性,H+的浓度增大,Mg(OH)2的沉淀溶解平衡向右移动,Mg(OH)2固体的质量减少;K sp[Cu(OH)2]<K sp[Mg(OH)2],加CuCl2饱和溶液使Mg(OH)2沉淀转化为Cu(OH)2沉淀,Mg(OH)2固体的质量减少;加蒸馏水降低了Mg2+和OH-的浓度,使Mg(OH)2的沉淀溶解平衡向右移动,Mg(OH)2固体的质量减少。
5.已知CuS、PbS、HgS的溶度积分别为1.3×10-36、9.0×10-29、6.4×10-53。
下列推断不正确的是(A)A.向含Pb2+、Cu2+、Hg2+的浓度均为0.010 mol·L-1的溶液中通入硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgSB.在硫化铅悬浊液中滴几滴硝酸铜溶液,会生成硫化铜C.在含Hg2+、Cu2+、Pb2+的溶液中滴加硫化钠溶液,当c(S2-)=0.001 mol·L-1时三种金属离子都完全沉淀D.硫化钠是处理废水中含上述金属离子的沉淀剂解析:相同条件下,组成相似的物质,溶度积越小,越易生成沉淀,根据溶度积:PbS>CuS>HgS可知,向含Pb2+、Cu2+、Hg2+的浓度均为0.010 mol·L-1的溶液中通入H2S气体,产生沉淀的顺序为HgS、CuS、PbS,A错;由于K sp(PbS)>K sp(CuS),故B正确;溶液中被沉淀离子的物质的量浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全,当c(S2-)=0.001 mol·L-1时,c(Hg2+)=6.4×10-50 mol·L-1,c(Cu2+)=1.3×10-33 mol·L-1,c(Pb2+)=9.0×10-26 mol·L-1,均小于1×10-5 mol·L-1,故C正确;Na2S提供的S2-可以使三种金属离子沉淀完全,故D正确。
6.25 ℃时,三种难溶银盐的K sp与颜色如表所示,下列说法正确的是(C)K sp 1.8×10-10 1.0×10-128.5×10-1724B.Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6 mol·L-1C.向AgCl悬浊液中加入足量KI溶液,沉淀将由白色转化为黄色D.向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成红色沉淀解析:由表中数据可知AgCl饱和溶液中c(Ag+)= 1.8×10-10=1.8×10-5 mol·L-1,Ag2CrO4饱和溶液中:c(Ag+)=32×1.0×10-12=32×10-4 mol·L-1,A、B均错误;AgI溶度积小于AgCl,所以向AgCl悬浊液中加入足量KI溶液,可能有黄色沉淀产生,C正确;由A项可知,饱和溶液中c(Ag+):AgCl<Ag2CrO4,向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成白色沉淀AgCl,D 错误。
7.某硫酸锰溶液中含有CuSO4、Fe2(SO4)3杂质,向溶液中加入MnCO3,过滤;再加入MnS,过滤,得到MnSO4溶液。
已知:常温下,K sp[Fe(OH)3]=2.6×10-39,K sp(CuS)=1.3×10-36,K sp(MnS)=4.7×10-14,K sp(MnCO3)=6.8×10-6,K sp[Cu(OH)2]=2.2×10-20。
当溶液中某种金属离子的浓度小于10-5 mol·L-1时,可认为该离子已沉淀完全。
下列推断不正确的是(C)A.加入MnCO3的目的是除去Fe3+B.常温下溶液pH=4时,Fe3+已除尽C.Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)的平衡常数K=2.8×10-23D.K sp(CuS)<K sp(MnS),故加入MnS可以除去溶液中的Cu2+解析:加入MnCO 3,消耗Fe 3+、Cu 2+水解生成的H +,提高溶液pH ,促使Fe 3+转化成Fe(OH)3沉淀,A 正确;常温下溶液pH =4时,c (OH -)=1×10-10 mol·L -1,K sp [Fe(OH)3]=c (Fe 3+)·c 3(OH -),则c (Fe 3+)=2.6×10-9 mol·L -1<1.0×10-5 mol·L -1,Fe 3+已除尽,B 正确;Cu 2+(aq)+MnS(s)CuS(s)+Mn 2+(aq)的平衡常数K =c (Mn 2+)c (Cu 2+)=c (Mn 2+)·c (S 2-)c (Cu 2+)·c (S 2-)=K sp (MnS )K sp (CuS )=3.6×1022,C 错误;一般来说,溶解度小的沉淀容易转化为溶解度更小的沉淀,D 正确。
8.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH ,金属阳离子浓度的变化如图所示。
据图分析,下列判断错误的是( B )A .K sp [Fe(OH)3]<K sp [Cu(OH)2]B .加适量NH 4Cl 固体可使溶液由a 点变到b 点C .c 、d 两点代表的溶液中c (H +)与c (OH -)乘积相等D .Fe(OH)3、Cu(OH)2分别在b 、c 两点代表的溶液中达到饱和 解析:K sp [Fe(OH)3]=c (Fe 3+)·c 3(OH -),K sp [Cu(OH)2]=c (Cu 2+)·c 2(OH -),Fe 3+、Cu 2+浓度相等(b 、c 点)时,Fe 3+对应的pH 小,c(H+)较大,则c(OH-)较小,又知K sp仅与温度有关,则K sp[Fe(OH)3]<K sp[Cu(OH)2],A选项正确;存在沉淀溶解平衡:Fe(OH)3(s)Fe3+(aq)+3OH-(aq),加入NH4Cl固体,因为NH+4水解产生H+,H+与OH-反应使平衡正向移动,c(Fe3+)增大,B选项错误;c(H+)和c(OH-)的乘积为K w,K w仅与温度有关,则C选项正确;由题意和题图知D选项正确。
9.(2019·湖南怀化模拟)25 ℃时,K sp(BaSO4)=1×10-10,K sp(BaCO3)=2.6×10-9。
该温度下,下列说法不正确的是(D)A.向同浓度的Na2SO4和Na2CO3的混合溶液中滴加BaCl2溶液,BaSO4先析出B.向BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大C.BaSO4和BaCO3共存的悬浊液中,c(SO2-4)c(CO2-3)=126D.向BaSO4的悬浊液中加入Na2CO3的浓溶液,BaSO4不可能转化为BaCO3解析:从BaSO4和BaCO3沉淀的K sp看,BaSO4比BaCO3更难溶,故BaSO4先析出,A项正确;新制氯水中存在反应Cl2+H2O H++Cl-+HClO,能够溶解BaCO3,B项正确;两沉淀共存的溶液中c(SO2-4) c(CO2-3)=K sp(BaSO4)K sp(BaCO3)=126,C项正确;增大CO2-3的浓度,c(Ba2+)·c(CO2-3)大于BaCO3的溶度积,BaSO4可能向BaCO3转化,D项错误。