Al(OH)3图象专题 一、向AlCl3溶液中滴加NaOH溶液至过量 1、实验
- 格式:ppt
- 大小:346.00 KB
- 文档页数:9

与铝有关的图像分析一、向AICI 3溶液中滴加 NaOH 溶液 O 〜A 段:Al 3 3OH > Al OH 3 .A 〜B 段:Al OH 3 OH 一 二 AIO 2一 2H 2O从图1不难看出,向氯化铝溶液中滴加氢氧化钠溶液, 若达不到最大沉淀量时, 对应的 氢氧化钠溶液的体积有两种情况: 一是氯化铝过量即加入的氢氧化钠不足; 二是加入的氢氧 化钠将生成的氢氧化铝溶解了一部分。
NaOII 熔液的休积/L图1向强碱溶液中滴入铝盐溶液 :先无沉淀,当 Al 3全部转化为 AlOf 时,再加入铝盐溶液,则偏铝酸盐与铝盐溶液发生了相互促进水解的反应,产物都是AI (OHL 。
女口图 3 所示:w.w.w.k.s.5.u.c.o.mBC* AiajtfcgvT图3发生反应的离子方程式为:8A 段:Al 3 4OH 一 二 AlOf 2H 2OA 〜B 段:Al 3 3AIO 2— 6H 2O =4AI OH 3、•三、向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液(I )向铝盐中滴加氨水时,当氨水增加到 n Al 3' : n NH 3 • H 2O 1=1: 3时,产生最大沉淀量如图4所示。
沉淀的物借&图4(II )向氨水中滴加铝盐溶液时,开始时氨水过量,如图5所示,离子反应方程式为:3NH 3 • H 2O Al 3 二 Al OH 3「:;3NH 4mo)AH鼠水的体积/L图5由图4与图5不难看出,氢氧化铝沉淀是不溶于弱碱氨水中的。
四、向偏铝酸盐溶液中滴入强酸w.w.w.k.s.5.u.c.o.m当n AlO/ : n H 川i ;=1: 1时,产生最大沉淀量,继续滴入强酸,沉淀逐渐溶解。
如 图6所示。
图6五、向盐酸中滴加偏铝酸盐溶液w.w.w.k.s.5.u.c.o.m滴入的偏铝酸钠先与盐酸反应生成 AI(OH \沉淀,继而马上被盐酸溶解,反应方程式为:4H AIO/ = AI 3 2H 2O继续滴加的NaAIO 2则与AP 发生水解反应,离子方程式为:mol沉淀的物质的S/JAl 3 3AIO 2- 6H 2O =4AI OH 3 .沉淀量的变化可用图 7表示。


往AlCl
溶液中逐滴滴入NaOH溶液至过量,可观察到的现象是()
3
A、有白色絮状沉淀产生,且不溶解
B、先无现象,后有白色絮状沉淀
C、一直无明显现象
D、先有白色絮状沉淀,后又溶解
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:向氯化铝溶液中逐滴加入氢氧化钠溶液至过量,发生的反应方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,根据物质的溶解性分析解答.解答:解:向氯化铝溶液中逐滴加入氢氧化钠溶液至过量,发生的反应方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,氢氧化铝是难溶性白色物质,偏铝酸钠是可溶性物质,所以看到的现象是:先有白色絮状沉淀,后又溶解.故选D.
点评:本题考查了氯化铝的性质,氯化铝和氢氧化钠溶液反应现象与滴加顺序有关,滴加顺序不同,发生反应现象不同.。

铝盐与偏铝酸盐相关反应图像1、氯化铝溶液中滴加氨水至过量现象:离子方程式:作图:氢氧化铝的物质的量随NH3·H2O 的物质的量变化图像。
2、氯化铝溶液中滴加氢氧化钠溶液至过量现象:离子方程式:作图:氢氧化铝的物质的量随NaOH的物质的量变化图像。
3、氢氧化钠溶液中滴加氯化铝溶液至过量现象:离子方程式:作图:氢氧化铝的物质的量随AlCl3的物质的量变化图像。
4、偏铝酸钠溶液中滴加盐酸至过量现象:离子方程式:作图:氢氧化铝的物质的量随HCl的物质的量变化图像。
5、盐酸中滴加偏铝酸钠溶液至过量现象:离子方程式:作图:氢氧化铝的物质的量随NaAlO2的物质的量变化图像。
6、偏铝酸钠溶液中通入CO2至过量现象:离子方程式:作图:氢氧化铝的物质的量随CO2的物质的量变化图像。
典例尝试【例1】下列各组反应中能得到Al(OH)3的是()A.Al2O3加到热水中B.向NaAlO2溶液中加入过量盐酸C. 将钠投入到NaAlO2溶液中D.向AlCl3溶液中滴几滴NaOH溶液【例2】向50ml 1mol/L 的硫酸铝溶液中加入100ml KOH溶液,充分反应后得到3.9g沉淀,则KOH的物质的量浓度可能是()A. 1 mol/LB. 3 mol/LC. 1.5 mol/LD. 3.5 mol/L优化训练【练习1】有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种。
现加入Na2O2粉末只有无色无味的气体放出,同时析出白色沉淀。
加入Na2O2粉末的量与生成沉淀的量之间的关系可用如右图表示。
试推断:(1)原溶液中一定含有。
(2)一定不含有。
(3)可能含有。
(4)为了进一步确定原溶液中可能有的离子,应增加的实验操作为。
【练习2】向20ml某物质的量浓度AlCl3溶液中滴入2 mol/L NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液体积的关系如右图所示,试回答下列问题:(1)图中A点表示的意义是。
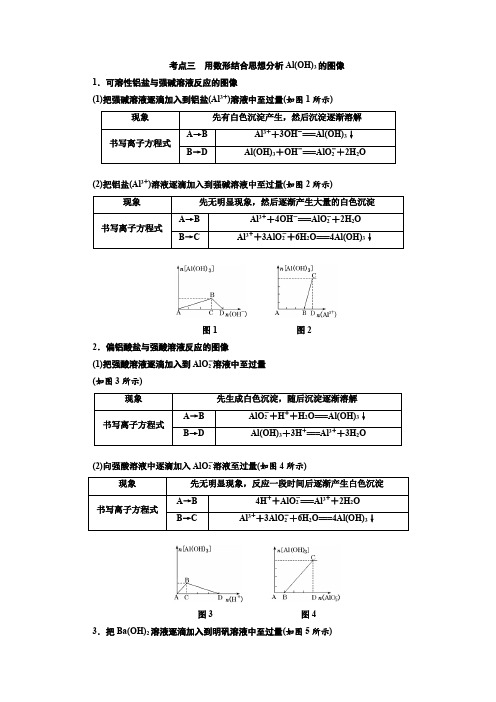
考点三用数形结合思想分析Al(OH)3的图像1.可溶性铝盐与强碱溶液反应的图像(1)把强碱溶液逐滴加入到铝盐(Al3+)溶液中至过量(如图1所示)(2)把铝盐(Al3+)溶液逐滴加入到强碱溶液中至过量(如图2所示)图1图22.偏铝酸盐与强酸溶液反应的图像(1)把强酸溶液逐滴加入到AlO-2溶液中至过量(如图3所示)(2)向强酸溶液中逐滴加入AlO-2溶液至过量(如图4所示)图3图43.把Ba(OH)2溶液逐滴加入到明矾溶液中至过量(如图5所示)4.向等物质的量的AlCl3、MgCl2混合溶液中逐滴加入NaOH溶液至过量(如图6所示)图5图6[题点全练]题点(一)有关Al(OH)3沉淀的图像分析1.如图表示AlCl溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是()A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.③线表示Al(OH)3的物质的量的变化D.④线表示AlO-2的物质的量的变化解析:选B AlCl3溶液与NaOH溶液混合有两种方式:向AlCl3溶液中缓慢滴加NaOH 溶液,开始有沉淀生成,后沉淀溶解,且生成沉淀与沉淀溶解消耗的NaOH的物质的量之比为3∶1,则x表示NaOH的物质的量,B项符合题意;另一种方式是向NaOH溶液中缓慢滴加AlCl3溶液,开始没有沉淀,后有沉淀生成,与本题图示情况不符。
2.(2018·湖南五市十校联考)向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。
则下列离子组在对应的溶液中一定能大量共存的是()A.a点对应的溶液中:Na+、Fe3+、SO2-4、HCO-3B.b点对应的溶液中:Na+、S2-、SO2-4、Cl-C.c点对应的溶液中:Ag+、Ca2+、NO-3、Na+D.d点对应的溶液中:K+、NH+4、I-、HCO-3解析:选B向一定量的NaOH溶液中逐滴加入AlCl3溶液,先发生反应:Al3++4OH -===AlO-+2H2O,无沉淀生成,当溶液中的OH-反应完全后,发生反应:Al3++3AlO-2+26H2O===4Al(OH)3↓,生成Al(OH)3沉淀的量随AlCl3加入量的增大而增大,当溶液中的AlO -2反应完全后,再继续滴加AlCl 3溶液,Al(OH)3沉淀的量保持不变。

向氢氧化钠溶液中滴加氯化铝溶液至过量反应的方程式和离子方程式向氢氧化钠溶液中滴加氯化铝溶液至过量反应的方程式和离子方程式4NaOH+AlCl3=Na[Al(OH)4]+3NaCl4OH- +Al3+ =[Al(OH)4]-过量3NaOH+AlCl3=Al(OH)3+3NaCl3OH- + Al 3+ =Al(OH)3(沉淀符号)氯化铝溶液中滴加过量氢氧化钠溶液的离子方程式Al3+ +4OH- ==AlO2- +2H2O向氯化铝溶液中滴加氢氧化钠溶液至过量,反应方程式化学方程式AlCl3 + 3 NaOH = Al(OH)3↓ + 3 NaClAl(OH)3 + NaOH = NaAlO2 + 2 H2O总反应AlCl3 + 4 NaOH = NaAlO2 + 2 H2O离子方程式Al3+ + 3 OH- = Al(OH)3↓ + 3 NaClAl(OH)3 + OH- = AlO2- + 2 H2O总反应Al3+ + 4 OH- = AlO2- + 2 H2O在氯化铝溶液中滴加过量氢氧化钠溶液的方程式楼主应注意题干中的“滴加”二字。
NaOH少量时:3NaOH(少量)+AlCl3=Al(OH)3(沉淀符号)+3NaCl离子方程式:3OH-+Al3+=Al(OH)3(沉淀符号)NaOH过量时:4NaOH(过量)+AlCl3=NaAlO2+3NaCl+2H2O离子方程式:4OH-+Al3+=AlO2-+2H2O把氯化铝溶液逐滴加入氢氧化钠溶液的离子方程式(解析过程) 氯化铝溶液中加入氢氧化钠.反应如下:ALCL3+3NaOH==AL(OH)3↓+3NaCL继续加入至过量.又于AL(OH)3两性会溶解于NaOH.反应如下:AL(OH)3+NaOH==NaALO2+2H2O最终溶液里是有AlO2-沉淀时物质的量的比是AlCl3:NaOH=1:3;溶解时物质的量的比是Al(OH)3:NaOH=1:1。
知道了物质的量,又知道了浓度,就可以计算出体积了。
化学方程式中,“过量”“少量”问题大总结!赶紧收藏高中化学有多个涉及“过量”与“少量”的化学方程式,各反应物的量的多少对比决定了会得到什么样的生成物,相信这些一定困扰了很大一部分同学。
所以今就来给大家整理了高中所有这些“过量”和“少量”问题的化学方程式,赶紧收藏分享起来吧!NaOH1、向AlCl3溶液中滴入NaOH溶液至过量,先出现白色沉淀,后沉淀消失。
其离子反应分步写:(1)Al3++3OH-==Al(OH)3↓(2)Al(OH)3+OH-==AlO2-+2H2O若向NaOH溶液中滴入AlCl3溶液至过量,边滴边振荡,开始时无明显现象,后出现白色沉淀。
其离子反应分步写:(1)Al3++4OH-==AlO2-+2H2O(2)3AlO2-+Al3++6H2O==4Al(OH)3↓若向AlCl3溶液中加入过量NaOH溶液,其离子反应一步完成:Al3++4OH-==AlO2-+2H2O若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为:Al3++3OH-==Al(OH)3↓2、向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液化学方程式:NaOH+Ca(HCO3)2==H2O+CaCO3↓+NaHCO3离子方程式:OH-+Ca2++HCO3-==H2O+CaCO3↓若向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液化学方程式:Ca(HCO3)2+2NaOH==2H2O+CaCO3↓+Na2CO3离子方程式:Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32-3、向足量的NH4HCO3溶液中逐渐滴入NaOH溶液化学方程式:NH4HCO3+2NaOH==NH3.H2O+H2O+Na2CO3离子方程式:NH4++HCO3-+2OH-==NH3.H2O+H2O+CO32-若向NH4HCO3溶液中加入过量NaOH溶液并加热化学方程式:NH4HCO3+2NaOH==NH3↑+2H2O+Na2CO3离子方程式:NH4++HCO3-+2OH-==NH3↑+2H2O+CO32-4、向NaOH溶液中逐渐滴入Mg(HCO3)2溶液至沉淀完全化学方程式:Mg(HCO3)2+4NaOH==2H2O+Mg(OH)2↓+2Na2CO3离子方程式:Mg2++2HCO3-+4OH-==2H2O+Mg(OH)2↓+2CO32-若向Mg(HCO3)2溶液中逐渐滴入NaOH溶液至沉淀完全化学方程式:2NaOH+Mg(HCO3)2==Mg(OH)2↓+2NaHCO3离子方程式:2OH-+Mg2+==Mg(OH)2↓5、碳酸氢钙与烧碱在碳酸氢钙溶液中滴入少量烧碱溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O反滴时则为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O6、氢氧化钠与氢硫酸NaOH溶液滴入足量氢硫酸中与氢硫酸滴入NaOH溶液中均无明显现象,发生的离子反应方程式分别为:(1)OH-+H2S=HS-+H2O(2)2OH-+H2S=S2-+2H2O若将氢硫酸换成亚硫酸、碳酸或磷酸,则原理类似。
【化学】化学专题汇编化学化学图像题汇编(一)含解析一、中考化学图像题汇编1.在AlCl3溶液中逐滴加入NaOH溶液至过量,发生如下反应:3NaOH+AlCl3=Al(OH)3↓+3NaCl, Al(OH)3+NaOH=NaAlO2+2H2O。
已知NaAlO2易溶于水,则下列图像不正确的是( )A.B.C.D.【来源】2017-2018学年沪教版九年级化学第7章应用广泛的酸、碱、盐单元测试卷【答案】A【解析】【分析】【详解】A、图中所示,随着氢氧化钠溶液的滴加,溶液中水的质量逐渐增大,当加入一定量时会出现滴加氢氧化钠溶液,而水的质量不增加的阶段而后继续增加;而反应的事实却是溶液中水会随着氢氧化钠溶液的滴加而不断增加,选项A错误;B、图中所示,随着氢氧化钠的滴加,溶液中的氯化铝不断形成氢氧化铝沉淀,沉淀质量逐渐增加。
至完全反应后,随着氢氧化钠的滴加沉淀逐渐减少。
符合氯化铝先与氢氧化钠生成氢氧化铝沉淀,然后沉淀氢氧化铝又和滴加的氢氧化钠生成可溶的NaAlO2的反应事实,选项B正确;C、图中所示,溶液的pH逐渐变大,符合氯化铝先与氢氧化钠生成氢氧化铝沉淀,溶液渐呈中性,然后沉淀氢氧化铝又和滴加的氢氧化钠生成可溶的NaAlO2而使溶液逐渐呈碱性的反应事实,选项C正确;D、图中所示,随着氢氧化钠溶液的滴加,溶液中铝元素质量减少至完全消失,之后随着氢氧化钠溶液滴加溶液中铝元素质量又逐渐增加,符合氯化铝先与氢氧化钠生成氢氧化铝沉淀,然后沉淀氢氧化铝又和滴加的氢氧化钠生成可溶的NaAlO2的反应事实,选项D正确。
故选A。
【点睛】根据反应进程,分析反应对溶液组成的影响,结合图示该因素变化的曲线,判断曲线与反应事实是否相符。
2.下列四个图象分别对应四个变化过程,其中正确的是()A.一定量的饱和石灰水中加入氧化钙B.常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应C.向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液D.向氢氧化钾溶液中不断加水,溶液的pH与加入水的质量关系【答案】B【解析】【分析】【详解】A 、一定量的饱和石灰水中加入氧化钙,氧化钙和水反应生成氢氧化钙,溶剂质量减小,且反应放热,氢氧化钙的溶解度随温度的升高而减小,故导致部分氢氧化钙析出,溶质质量减小,完全反应后温度降低,部分氢氧化钙溶解,溶质质量增大,最终溶质质量小于反应前溶质质量,不符合题意;B 、常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应,锌与稀硫酸反应:2442=Z Zn+H SO SO +H n ↑,铁与稀硫酸反应:2442=F Fe+H SO SO +H e ↑,反应的硫酸质量相等时生成氢气质量相等,最终铁和稀硫酸反应生成氢气多,符合题意;C 、向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液,氢氧化钠先和硫酸反应生成硫酸钠和水,后和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,故一开始无沉淀产生,后沉淀质量逐渐增加,待完全反应后,不再变化,不符合题意;D 、向氢氧化钾溶液中不断加水,溶液碱性减弱,pH 减小,但是不能减小到7,更不能小于7,不符合题意。
2021-2022学年中考化学模似试卷考生请注意:1.答题前请将考场、试室号、座位号、考生号、姓名写在试卷密封线内,不得在试卷上作任何标记。
2.第一部分选择题每小题选出答案后,需将答案写在试卷指定的括号内,第二部分非选择题答案写在试卷题目指定的位置上。
3.考生必须保证答题卡的整洁。
考试结束后,请将本试卷和答题卡一并交回。
一、单选题(本大题共15小题,共30分)1.在AlCl3溶液中逐滴加入NaOH溶液至过量,发生如下反应:3NaOH+AlCl3=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O。
已知NaAlO2易溶于水,则下列图像不正确的是( )A.B.C.D.2.人体健康离不开化学,下列叙述正确的是()A.氧、碳、氢、氮、钠、铁是人体所需的常量元素B.氨基酸在人体内和酶反应可以转化为尿素,水,二氧化碳,同时为人体提供能量C.维生素有20多种,多数不能在人体内合成,其中纤维素对人体的消化有特殊作用D.农药可以通过多种途径进入人体,如呼吸,饮水,食物等3.黄曲霉素(化学式为C17H12O6)广泛存在于腐败、变质的花生、玉米和谷物等农产品中,是一种有毒物质,容易致癌。
下列有关黄曲霉素说法正确的是()A.黄曲霉素是有机高分子化合物B.黄曲霉索的相对分子质量为312gC.黄曲霉素中氢元素的质量分数最小D.黄曲霉素中碳、氢、氧三种元素的质量比为17:12:64.下列实验过程与图象描述相符合的一组是()A.向一定温度下某饱和氯化钠溶液中加入氯化钾固体B.向等质量的镁、锌中加入稀硫酸C.向稀盐酸中加入氢氧化钠溶液D.向盐酸和FeCl3的混合液中加入NaOH溶液5.下列除去杂质的方法中,不正确的是选项物质(括号内为杂质) 除去杂质的方法A 铜粉(铁粉) 加入足量稀硫酸,过滤、洗涤、干燥B CO(CO2) 通过足量的NaOH溶液,干燥C CaCl2溶液(HCl) 加过量的碳酸钙,过滤D NaNO3溶液(Na2CO3) 加入过量的Ba(NO3)2溶液,过滤A.A B.B C.C D.D6.推理是化学学习中常用的思维方式,下列推理正确的是()A.向某固体中滴加稀盐酸有气泡冒出,则该固体中一定含有碳酸根离子B.碱溶液的pH大于7,则pH大于7的溶液都是碱溶液C.单质中含有一种元素,则含有一种元素的物质都是单质D.燃烧需要同时满足三个条件,则只需破坏其中一个条件就可以灭火7.下列物质含有氢分子的是()A.H2B.H2O2C.H2CO3D.H2O8.氮元素与氧元素的本质区别是A.质子数不同B.中子数不同C.核外电子数不同D.最外层电子数不同9.能除去铁锈的试剂是()A.氯化钠溶液B.稀盐酸C.氢氧化钠溶液D.水10.亚硒酸钠(Na2SeO3)可用于提升人体免疫力,硒元素在元素周期表中的部分信息及原子结构示意图如图所示,下列说法正确的是()A.Na2SeO3中Se的化合价为+3 B.Se是一种金属元素C.n的值为6 D.Se相对原子质量为78.96g11.下列关于实验现象的描述正确的是()A.铁丝在空气中剧烈燃烧,火星四射B.碳在氧气中燃烧生成黑色固体C.氢氧化钠固体溶于水时,溶液温度降低D.铁丝伸入硫酸铜溶液中,有红色物质析出12.下列物质的应用不正确的是()A.用发酵粉制作面包B.用洗涤剂去油污C.聚氯乙烯用于电线外皮D.不锈钢用来制钢轨13.下列资源的利用过程中发生了化学变化的是A.太阳能光伏路灯照明B.活性炭用作净水剂C.海水晒盐D.黄豆酿酱油14.在毕业联欢晚会上,某同学表演了精彩魔术——“烧不坏的布手帕”。