苏教版高中化学选修三《专题3》测试题
- 格式:docx
- 大小:70.50 KB
- 文档页数:15
专题3专题综合检测(时间:90分钟,满分:100分)一、选择题(本题共包括15个小题,每小题3分,共45分,每小题只有一个选项符合题意) 1.下列操作达不.到预期目的的是( ) ①石油分馏时把温度计插入受热的液体中 ②用高锰酸钾酸性溶液除去乙炔中含有的H 2S ③用乙醇和3%的硫酸共热到170 ℃制取乙烯 ④将苯和溴水混合后加入铁粉制取溴苯 ⑤将敞口久置的电石与蒸馏水混合制乙炔 A .只有①⑤ B .只有③④⑤ C .只有①②③⑤ D .①②③④⑤2.将下列液体分别与溴水充分混合并振荡,静置后上层液体呈现橙色,下层液体是无色的是( ) A .CCl 4 B .苯 C .戊烯 D .乙醇3.下列物质中一定属于同系物的是()④C 2H 4 ⑤CH 2===CH —CH ===CH 2 ⑥C 3H 6A .④和⑧B .①②和③C .⑤和⑦D .④⑥和⑧4.下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是( ) A .甲苯与硝酸发生取代反应生成三硝基甲苯 B .甲苯能使热的KMnO 4酸性溶液褪色 C .甲苯燃烧时产生带浓烈黑烟的火焰D .1 mol 甲苯最多能与3 mol 氢气发生加成反应 5.蒽()和菲()都是比较简单的稠环芳香烃,有关它们的说法正确的是( )A .蒽和菲属于同系物B .蒽和菲属于同分异构体C .蒽的一氯代物有3种,而菲的一氯代物有4种D .蒽和菲均可以看成是苯的同系物6.美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛。
因而称为释迦牟尼分子(所有原子在同一平面)。
有关该有机物分子的说法不.正确的是( ) A .属于芳香烃B .不属于苯的同系物C .其分子式为C 22H 12D .它和C 22H 14可能为同系物7.煤的气化是煤高效、洁净利用的方向之一。
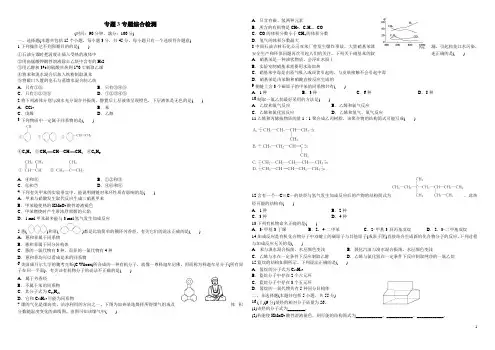
下图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图。
由图可知该煤气中( )A .只含有碳、氢两种元素B .所含的有机物是CH 4、C n H m 、CO C .CO 的体积分数小于CH 4的体积分数D .氢气的体积分数最大8.中国石油吉林石化公司双苯厂曾发生爆炸事故,大量硝基苯泄漏,引起松花江水污染,安全生产和环保问题再次引起人们的关注。

苏教版高中化学选修三测试题及答案全套苏教版高中化学选修3第一章《揭示物质结构的奥秘》测试卷一、单选题(共15小题)1.2013年6月《自然》刊波尔原子结构模型100周年.波尔在人类对原子结构的认识的历程上是非常重要的.以下关于人类对原子结构的认识错误的是()A.伦琴发现X射线将人类对原子结构的认识引入了新的历程B.道尔顿认为“不同元素化合时,这些元素的原子按简单整数比结合成化合物”C.汤姆生通过α粒子散射实验总结出原子结构行星模型D.法国物理学家贝克勒尔发现铀的放射性2.最早提出科学的原子概念的科学家是()A.道尔顿B.阿伏加德罗C.门捷列夫D.卢瑟福3.20世纪初,通过α粒子散射实验提出带核的原子结构模型的科学家是()A.卢瑟福B.舍勒C.汤姆生D.玻尔4.几种微粒具有相同的核电荷数,则这几种微粒()A.一定是同一种元素B.互为同位素C.可能属于同一种元素D.核外电子数一定相等5.下列由事实得出的结论错误的是()A.维勒用无机物合成了尿素,突破了无机物与有机物的界限B.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新C.美国的赫克、日本的根岸英一和铃木章,发明了“钯催化交叉偶联反应”技术,大大提升合成复杂化学物质的可能性,三位科学家从而获得了2010年诺贝尔化学奖,这体现了国际科技合作的重要性D.科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的学科6.随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+等已被发现.下列有关说法中,正确的是()A.H2与H3属于同素异形体B.O2与O4属于同位素C.C60的质量数为720g/molD.N5+中含有36个电子7.化学在古代与现代的科技发展中起了十分重要的作用,下列说法中正确的是()A.选项AB.选项BC.选项CD.选项D8.溴被称为“海洋元素”.溴的元素符号是()A.BB.BeC.BrD.Bi9.首先提出原子结构模型并开始涉及原子内部结构的科学家是()A.卢瑟福B.玻尔C.汤姆生D.道尔顿10.分类是化学研究的重要方法,下列各组物质的分类正确的是()A.同位素:D2、H2、T2B.同系物:、、C.非电解质:NH3、C2H5OH、Cl2D.含极性键的分子晶体:CO2、CCl4、NH311.科学家根据自然界存在的N2制取N3,其后又陆续制取出N5、含N5+的化合物及N60.N5+极不稳定,需保存在﹣80℃的干冰中;N5+由于其极强的爆炸性,又称为“盐粒炸弹”;N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来.分析上述材料,下列说法中不正确的是()A.N5+常温下会剧烈爆炸,体积急剧膨胀,放出大量的热B.N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料C.N2、N3、N5、N5+、N60互为同素异形体D.含N5+的化合物中既有离子键又有共价键12.下列各组指定原子序数的元素,不能形成AB2型化合物的是()A.6和8B.16和8C.12和9D.11和613.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wüthrich等人为此获得了2002年诺贝尔化学奖。
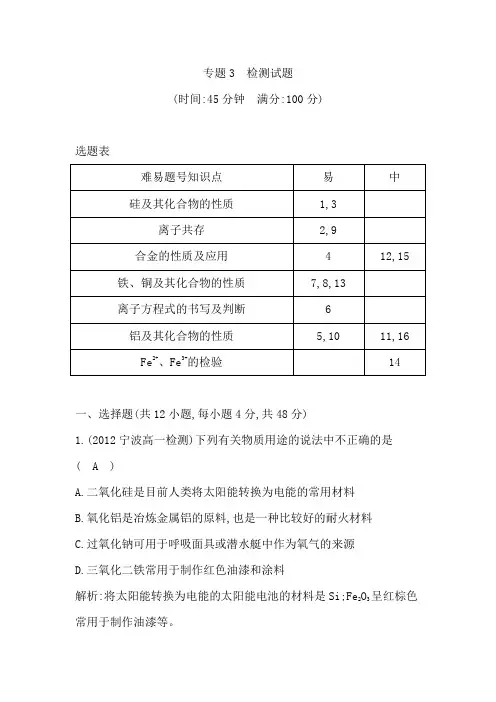
专题3 检测试题(时间:45分钟满分:100分)选题表难易题号知识点易中硅及其化合物的性质1,3离子共存2,9合金的性质及应用 4 12,15 铁、铜及其化合物的性质7,8,13离子方程式的书写及判断 6铝及其化合物的性质5,10 11,16Fe2+、Fe3+的检验14一、选择题(共12小题,每小题4分,共48分)1.(2012宁波高一检测)下列有关物质用途的说法中不正确的是( A )A.二氧化硅是目前人类将太阳能转换为电能的常用材料B.氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料C.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源D.三氧化二铁常用于制作红色油漆和涂料解析:将太阳能转换为电能的太阳能电池的材料是Si;Fe2O3呈红棕色常用于制作油漆等。
2.(2012南安高一检测)某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( B )A.K+、Na+、HC、NB.Na+、S、Cl-、K+C.H+、Mg2+、S、ND.Fe3+、N、SCN-、Na+解析:能溶解Al(OH)3和H2SiO3的溶液呈碱性,A项中的HC、C项中的H+、Mg2+、D项中的Fe3+都不能大量存在,且D项中的Fe3+与SCN-不共存。
3.以下转化不能通过一步反应实现的是( A )A.Al2O3→Al(OH)3B.SiO2→SiF4C.Fe→FeCl2D.Na→NaOH解析:SiO2与HF反应可得SiF4;Fe与盐酸反应可得FeCl2;Na与水反应可得NaOH;Al2O3不能与水反应制得Al(OH)3。
故应选A。
4.(2012安徽“江南十校”联考)潜艇上的核反应堆使用液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,下列有关说法中正确的是( D )A.该合金的熔点介于钠、铝之间B.钠或铝形成的氧化物均为碱性氧化物C.钠和铝分别与不足量的盐酸反应所得溶液均呈中性D.若合金中n(Na)>n(Al),将其投入到足量的水中可得无色透明溶液解析:合金的熔点一般都低于各成分金属,A错;Na2O2、Al2O3不属于碱性氧化物,B错;钠与不足量的盐酸反应后因有NaOH生成,使所得溶液呈碱性,C错;合金中n(Na)>n(Al),投入到足量的水中,铝最终能全部溶解,D正确。

专题3《常见的烃》测试卷一、单选题(共15小题)1.现有下列各组物质:①甲烷和乙烯;①乙烯和乙醇;①苯和乙炔;①甲苯和邻二甲苯;①丙烯和2丁烯,只要总质量一定,各组中的两种物质不论以何种比例混合,完全燃烧时生成水的质量也总是定值的是()A. ①①B. ①①①①C. ①①D.都不是2.C5H12有3种不同结构:甲CH3(CH2)3CH3,乙CH3CH(CH3)CH2CH3,丙C(CH3)4。
下列相关叙述正确的是 ()A.甲、乙、丙属同系物,均可与氯气、溴蒸气发生取代反应B. C5H12表示一种纯净物C.甲、乙、丙中,丙的沸点最低D.丙有3种不同沸点的二氯取代物3.在洗衣粉配方中,应用最广的阴离子表面活性剂是()A.脂肪聚氧乙烯醚B.皂片C.十二烷基苯磺酸钠D.脂肪醇硫酸钠4.乙烯和乙炔都能使溴的水溶液褪色,是由于乙烯和乙炔()A.是同系物B.都属于烃C.都易被氧化D.都含有价键不饱和的碳原子5.有关油脂的说法错误的是()A.植物油兼有酯类和烯烃的性质B.油脂的水解叫皂化反应C.液态油催化加氢后可以生成固态脂肪D.脂肪里的饱和烃基的相对含量较大,熔点较高6.工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:,下列关于该有机物的说法不正确的是()A.苯乙烯的分子式为C8H8B.苯乙烯通过加聚反应可制备高分子化合物C.苯乙烯与溴的四氯化碳溶液反应:D.苯乙烯能发生加成反应,但不能发生取代反应7.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是()A.异戊二烯()与等物质的量的Br2发生加成反应B. 2氯丁烷与乙醇溶液共热发生消去分子的反应C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应D.邻羟基苯甲酸与溶液反应8.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)()A. 5种B. 6种C. 7种D. 8种9.随着碳原子数的增多,碳元素的质量百分含量却增大的是()A.烷烃同系物B.烯烃同系物C.炔烃同系物D.苯的同系物10.过量的下列溶液与水杨酸()反应能得到化学式为C7H5O3Na的是()A. NaHCO3溶液B. Na2CO3溶液C. NaOH溶液D. NaCl溶液11.某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子上的氢原子又可被3 mol Cl2完全取代,则此气态烃可能是()A. HC≡CHB.C.D.12.下列关于这种燃料说法正确的是()A.常温常压下为液体B.与1-丁烯互为同分异构体C.分子中所有原子共平面,一氯代物有5种D. 1 mol这种燃料完全燃烧需5 mol氧气13.通常情况下,苯的化学性质比较稳定,这是因为()A.苯不能使高锰酸钾酸性溶液褪色B.苯不与溴水发生加成反应C.苯的分子结构决定的D.苯是芳香烃14.某烯烃与氢气加成后得到2.2-二甲基戊烷,烯烃的名称是()A. 2.2-二甲基-3-戊烯B. 2.2-二甲基-4-戊烯C. 4.4-二甲基-2-戊烯D. 2.2-二甲基-2-戊烯15.下列各组物质中,可用溴水溶液来鉴别的是()A.甲烷与乙烷B.乙烯与丙烯C.苯与己烷D.苯与溴苯二、实验题(共3小题)16.用下图中的实验装置制取乙炔。

2018-2019苏教版高中化学选修三专题3测试题及答案解析(时间:90分钟分值:100分)可能用到的相对原子质量:He 4 O 16 S 32 Si 28 Ca 40一、选择题(本题包括15小题,每题只有一个选项符合题意,每题3分,共45分)1.只需克服范德华力就能汽化的是( )A.液态二氧化碳B.液态氨C.醋酸D.乙醇解析B、C、D项还要克服分子间氢键。
答案 A2.下列物质的熔、沸点高低顺序正确的是( )A.金刚石>晶体硅>二氧化硅>碳化硅B.CI4>CBr4>CCl4>CH4C.MgO>Na2O>N2>O2D.金刚石>生铁>纯铁>钠解析A项中物质均为原子晶体,共价键键能越大,熔沸点越高,因为键长Si—Si>Si—C>Si—O>C—C,所以键能C—C>Si—O>Si—C>Si—Si,即熔、沸点顺序为:金刚石>二氧化硅>碳化硅>晶体硅;CH4为气体,其余为液体,且相对分子质量越大,分子间作用力越大,熔、沸点越高,B正确;C项应为MgO>Na2O>O2>N2;合金的熔、沸点比其各成分金属的熔、沸点要低,故D项应为金刚石>纯铁>生铁>钠。
答案 B3.按下列四种有关性质的叙述,可能属于金属晶体的是( )A.由分子间作用力结合而成,熔点低B.固体或熔融后能导电,熔点在1000℃左右C.由共价键结合成网状结构,熔点高D.固体不导电,但溶于水或熔融后能导电解析A为分子晶体,C为原子晶体,D为离子晶体。
答案 B4.下列微粒中,同时具有离子键、共价键和配位键的是( )A.NaOH B.H3O+C.MgCl2D.NH4Cl解析NaOH中含有离子键和共价键;H3O+中含有共价键和配位键;MgCl2中只含有离子键;NH4Cl中NH+4和Cl-以离子键结合,NH+4中N和H形成的化学键既有共价键又有配位键。

(时间:90分钟,满分:100分)一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)1.将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。
将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型的耐高温、耐磨材料,在工业上有广泛的应用。
则氮化硅所属的晶体类型是()A.原子晶体 B.分子晶体C.离子晶体D.金属晶体解析:选A。
该物质是一种耐高温、耐磨材料,由此可以推出其固体硬度高,因此该物质为原子晶体。
2.下列各组均有两种物质的式子中,都能真实表示分子组成的是()A.CO2和SiO2 B.S和NaC.Na2O2和H2O2D.C6H6和C6H5Br解析:选D。
只有分子晶体才存在分子,A项SiO2为原子晶体,B项Na为金属晶体,C项Na2O2为离子晶体。
3.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。
在变化的各阶段被破坏的粒子间的主要相互作用依次是()A.氢键;分子间作用力;非极性键B.氢键;氢键;极性键C.氢键;极性键;分子间作用力D.分子间作用力;氢键;非极性键解析:选B。
雪花和液态水中均存在氢键,而水蒸气不存在氢键,前面属于物理变化。
而水生成H2和O2,属于化学变化,破化了H—O极性键。
4.AB、CD、EF均为1∶1型离子化合物,其中A、C、E为+2价,B、D、F为-2价,根据下表数据判断它们的熔点由高到低的顺序是()A.CD>AB>EF B.AB>EF>CDC.AB>CD>EF D.EF>AB>CD解析:选D。
对于组成和结构相似的离子化合物,键长越小,键能越大,其晶格能越大,熔、沸点越高。
5.下列说法中不.正确的是()A.σ键比π键重叠程度大,形成的共价键强B.两个原子之间形成共价键时,最多有一个σ键C.气体单质中,一定有σ键,可能有π键D.N2分子中有1个σ键,2个π键解析:选C。

高中化学学习材料专题质量评估(三)专题4、5(90分钟100分)一、选择题(本题包括15小题,每小题3分,共45分)1.(2015·郑州高二检测)当航天飞机返回地球进入大气层时,由于与空气剧烈摩擦,航天飞机尖端温度可达1 000℃以上,为了防止极高的温度将其烧毁,科学家给航天飞机安装了可靠的保护层,作为保护层的材料可能是( )A.合成塑料B.合成纤维C.镁铝合金D.新型陶瓷【解析】选D。
新型结构陶瓷即高温结构陶瓷,在高温时不易氧化和熔化,能弥补一些传统材料、金属材料的弱点。
2.(2015·南平高二检测)已知Zn2+的4s和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为( )A.直线形B.平面正方形C.正四面体D.正八面体【解析】选C。
由于配合物中心原子形成sp3型杂化轨道,形成的4个空的sp3型杂化轨道分别接受一个氯离子提供的孤电子对形成4个配位键,所以形成的配合物是正四面体。
【补偿训练】下列分子或晶体均不属于正四面体结构的是( )①二氧化碳②晶体硅③CH3Cl ④CH4⑤白磷⑥氨气A.①③B.①⑥C.①③⑥D.②⑤⑥【解析】选C。
CO2为直线形分子,CH3Cl是四面体分子但不是正四面体分子,NH3为三角锥型分子。
3.关于原子轨道的说法不正确的是( )A.中心原子采取相同类型的杂化轨道成键的分子,其几何构型不一定相同B.sp杂化轨道是由同一个原子中能量相近的一个s轨道和一个p轨道混合起来形成的一组能量相同的新轨道C.凡AB3型的共价化合物,其中心原子A均采用sp2杂化轨道成键D.乙烯与氢气反应会变成乙烷,碳原子的杂化类型由sp2杂化变为sp3杂化【解析】选C。
NH3属于AB3型,但氮原子属于sp3杂化轨道成键。
4.氢叠氮酸(HN3)与醋酸性质相近,其盐稳定,但受撞击时易迅速发生反应,生成氮气。
关于氢叠氮酸有以下说法:①NaN3的水溶液呈碱性②固体HN3属分子晶体③固体NaN3属离子化合物④NaN3可用于小汽车防撞保护气囊其中正确的是( )A.①②③B.①②③④C.②③④D.①③④【解析】选B。

专题综合测评(三)分子空间结构与物质性质(时间45分钟,满分100分)一、选择题(本题包括12小题,每小题4分,共48分)1.形成下列分子时,一个原子用sp3杂化轨道和另一个原子的p轨道成键的是()A.BF3l4C.NH3 .D.H2O【解析】NH3、H2O为中心原子的sp3杂化轨道和H的s轨道成键。
【答案】 B2.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X 可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。
下列叙述中不正确的是()A.WX2分子中全部原子最外层都为8电子结构B.WX2、ZX2的化学键类型和晶体类型都相同C.WX2是以极性键结合成的非极性分子D.原子半径大小挨次为:X<W<Y<Z【解析】依据题设条件可推知,W为C,X为O,Y为Si,Z为S。
选项A中,CO2的结构式为O===C===O,C和O原子最外层均达到8电子稳定结构。
选项B,CO2和SO2均是只含有极性键的分子晶体。
选项C,CO2分子中C和O之间为极性键,其结构为直线形,为非极性分子。
选项D,原子半径大小挨次为:Y>Z>W>X。
【答案】 D3.(双选)氯化硼的熔点为-107 ℃,沸点为12.5 ℃,在其分子中键与键之间的夹角为120°,它能水解。
下列有关叙述正确的是()A.氯化硼分子间含有氢键B.氯化硼中心原子接受sp杂化C.氯化硼分子呈正三角形,属非极性分子D.其分子空间结构类似于CH2O【解析】依据氢键含义知氯化硼分子间不含氢键,由于氯化硼分子中键与键之间的夹角为120°,说明氯化硼分子是平面正三角形,中心原子接受sp2杂化,为极性键形成的非极性分子。
【答案】CD4.用价层电子对互斥模型猜测下列分子或离子的空间构型,其中不正确的是()A.NH+4为正四周体型.B.CS2为直线形C.HCN为折线形(V形) .D.PCl3为三角锥型【解析】NH+4、CS2、HCN、PCl3结构中中心原子外围电子对数分别为4对、2对、2对、4对,外围电子对互斥模型为正四周体型、直线形、直线形、空间四周体型,其中前三者中心原子没有孤电子对,微粒的空间构型就是外围电子对互斥模型,PCl3分子中有1对孤电子对,所以为三角锥型。

苏教版高中化学选修3综合测试卷一、单选题(共15小题)1.下列关于杂化轨道的叙述正确的是 ()A.杂化轨道可用于形成σ键,也可用于形成π键B.杂化轨道可用来容纳未参与成键的孤电子对C. NH3中N原子的sp3杂化轨道是由N原子的3个p轨道与H原子的s轨道杂化而成的D.在乙烯分子中1个碳原子的3个sp2杂化轨道与3个氢原子的s轨道重叠形成3个C—H σ键2.下列分子中所有原子都满足最外层8电子结构的是()A.光气(COCl2)B.六氟化硫C.二氟化氙D.三氟化硼3.已知CsCl晶体的密度为ρg·cm-3,N A为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为()A.N A·a3·ρB.C.D.4.下列有机化合物中含有手性碳原子的是()A. CH3CH(CH3)2B. CH3CH2OHC. CH3CH2CHOD. CH3CHClCH2CH35.关于离子晶体的下列说法正确的是()①离子晶体中的组成微粒是阴、阳离子①离子晶体中微粒间的作用是离子键①离子晶体中微粒间只存在异性电荷的互相吸引①离子晶体中只存在离子键A. ①①B. ①①C. ①①D. ①①6.依据价层电子对互斥理论判断SO2的分子构型()A.正四面体形B.平面三角形C.三角锥形D. V形7.水的沸点为100 ①,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7①,引起这种差异的主要原因是()A.范德华力B.共价键C.氢键D.相对分子质量8.如图所示是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是()A. (1)和(3)B. (2)和(3)C. (1)和(4)D.只有(4)9.金属的下列性质中和金属晶体结构无关的是()A.良好的导电性B.反应中易失去电子C.良好的延展性D.良好的导热性10.下列物质中,既有共价键又有分子间作用力的是()A.氧化镁B.氦C.铜D.液氨11.在元素周期表里,金属与非金属元素附近能找到()A.制半导体的元素B.制农药的元素C.制催化剂的元素D.制耐高温合金的元素12.高温下,超氧化钾晶体(KO2)呈立方体结构。

专题综合检测(三)(时间:60分钟,满分:100分)一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)1.将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。
将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型的耐高温、耐磨材料,在工业上有广泛的应用。
则氮化硅所属的晶体类型是()A.原子晶体B.分子晶体C.离子晶体D.金属晶体解析:选A。
该物质是一种耐高温、耐磨材料,由此可以推出其固体熔点高、硬度大,因此该物质为原子晶体。
2.下列各组物质的式子中,都能真实表示分子组成的是()A.CO2和SiO2B.S和NaC.Na2O2和H2O2D.C6H6和C6H5Br解析:选D。
只有分子晶体才存在分子,A项SiO2为原子晶体,B项Na为金属晶体,C项Na2O2为离子晶体。
3.若不断地升高温度,实现“雪花→液态水→水蒸气→氧气和氢气”的变化。
在变化的各阶段被破坏的粒子间的主要相互作用依次是()A.氢键;分子间作用力;非极性键B.氢键;氢键;极性键C.氢键;极性键;分子间作用力D.分子间作用力;氢键;非极性键解析:选B。
雪花和液态水中均存在氢键,水的三态变化属于物理变化,而水生成H2和O2,属于化学变化,破坏了H—O极性键。
4.AB、CD、EF均为1∶1型离子化合物,其中A、C、E均为+2价,B、D、F均为-2价,根据下表数据判断它们的熔点由高到低的顺序是()C.AB>CD>EF D.EF>AB>CD解析:选D。
对于组成和结构相似的离子化合物,键长越短,键能越大,其晶格能越大,熔、沸点越高。
5.下列说法中不正确的是( )A .σ键比π键重叠程度大,形成的共价键强B .两个原子之间形成共价键时,最多有一个σ键C .气体单质中,一定有σ键,可能有π键D .N 2分子中有1个σ键和2个π键解析:选C 。
从原子轨道的重叠程度看,π键轨道重叠程度比σ键重叠程度小,故π键稳定性低于σ键,A 项正确;根据电子云的形状和成键时的重叠原则,两个原子形成的共价键最多只有一个σ键,可能没有π键,也可能有1个或2个π键,B 项正确;稀有气体为单原子分子,不存在化学键,C 项不正确。

选修3 物质结构与性质综合练习一、单项选择题1.1919年,科学家第一次实现了人类多年的梦想——人工转变元素。
这个核反应如下:147N +42He→178O+11H下列叙述正确的是()A.178O原子核内有9个质子 B.11H原子核内有1个中子C.O2和O3互为同位素 D.通常情况下,He和N2化学性质都很稳定2.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。
若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是()A.是一种新的氧化物B.不可能含有极性键C.是氧元素的一种同位素 D.是臭氧的同分异构体3.下列化合物中,既有离子键,又有共价键的是 ( )A.CaO B.SiO2 C.H2O D.Na2O24.下列物质的电子式书写正确的是( )A.NaCl B.H2SC.-CH3 D.NH4I5.已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )A. A、B、D不可能在同周期B.D一定在第二周期C.A、D可能在同一主族D.C和D的单质可能化合为离子化合物6. X、Y、Z均为短周期元素。
已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。
有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是 ( )A.② D.②④ C②⑤⑥ D.①②③④7 下列分子中,所有原子都满足最外层为8电子结构的是( )A.BF3 B.PCl5 C.HCl D.CF2Cl28.下列说法中正确的是()A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构;B.P4和CH4都是正四面体分子且键角都为109o28ˊ;C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个;D.由原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度。
高中化学学习材料(精心收集**整理制作)综合检测(三)专题4分子空间结构与物质性质(时间:60分钟分值:100分)一、选择题(本题包括12小题,每小题5分,共60分,每小题只有一个选项符合题意。
)1.形成下列分子时,一个原子用sp3杂化轨道和另一个原子的p轨道成键的是()A.BF3B.CCl4C.NH3D.H2O【解析】NH3、H2O为中心原子的sp3杂化轨道和H的s轨道成键。
【答案】 B2.下列现象不能用“相似相溶规则”原理解释的是()A.氯化氢易溶于水B.氯气易溶于氢氧化钠溶液C.碘易溶于四氯化碳D.碘难溶于水【解析】氯气易溶于氢氧化钠溶液,是因为氯气可以与氢氧化钠溶液反应生成氯化钠和次氯酸钠两种盐,这两种盐是离子化合物,易溶于水。
相似相溶规则利用的是物理性质,所以B 项的现象不能用相似相溶规则解释。
【答案】 B3.下列关于配合物的叙述中,不正确的是()A.配合物中必定存在配位键B.配合物中只有配位键C.[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键D.配合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用【解析】配合物中一定含有配位键,但也可能含有其他化学键。
Cu2+有空轨道,H2O中的氧原子有孤电子对,可以形成配位键。
配合物应用领域特别广泛,D选项中提到的几个领域都在其中。
【答案】 B4.下列分子中含有“手性碳原子”的是()A.CBr2F2B.CH3CH2CH2OHC.CH3CH2CH3D.CH3CH(NO2)COOH【解析】有机物分子中连接四个不同原子或基团的碳原子称为手性碳原子。
A、B、C选项的分子中任何一个碳连接的原子或基团都有重复,不符合题意;D项中碳链上中间的碳原子上有—H、—COOH、—CH3、—NO2四个不同的原子或基团,符合题意。
【答案】 D5.根据等电子原理判断,下列说法中错误的是()A.B3N3H6分子中所有原子均在同一平面上B.B3N3H6分子中存在双键,可发生加成反应C.H3O+和NH3是等电子体,均为三角锥型D.CH4和NH+4是等电子体,均为正四面体结构【解析】等电子原理是指具有相同价电子数和相同原子数的分子或离子具有相同的结构特征。
专题检测卷(二)(时间:90分钟满分:100分)一、选择题(本题包括15个小题,每小题3分,共45分)1.下列式子中,真实表示物质分子组成的是( )A.H2SO4B.NH4ClC.SiO2D.C答案 A解析只有分子晶体的化学式才表示真实的分子组成。
2.下列叙述不正确的是( )A.O2在水中的溶解度比N2大,因为O2与水分子之间的作用力比N2与水分子之间的作用力大B.稀有气体原子序数越大,沸点越高C.分子间作用力越弱,分子晶体的熔点越低D.原子晶体的熔点一定比金属晶体高答案 D解析金属晶体有的熔点低,如汞、钾、钠等;有的很高,如钨高达3430℃,比晶体硅和SiO2的熔点还要高。
3.下列说法正确的是( )A.一种金属元素和一种非金属元素一定能形成离子化合物B.离子键只存在于离子化合物中C.共价键只存在于共价化合物中D.离子化合物中必定含有金属元素答案 B解析AlCl3是共价化合物,A错;凡含有离子键的化合物就是离子化合物,B正确;共价键除存在于共价化合物中,非金属单质及离子化合物中也可含有共价键,C错;铵盐属于离子化合物,但其中没有金属元素,D错。
4.离子晶体不可能具有的性质是( )A.较高的熔、沸点B.良好的导电性C.溶于极性溶剂D.坚硬而易粉碎答案 B解析离子晶体是阴、阳离子通过离子键结合而成的,在固态时,阴、阳离子受到彼此的束缚不能自由移动,因而不导电。
只有在离子晶体溶于水或熔融后,电离成可以自由移动的阴、阳离子,才可以导电。
5.下列叙述的各项性质中,不属于金属的通性的是( )A.导电、导热性B.延展性C.具有金属光泽D.熔点都很高答案 D解析金属晶体熔点范围很广,有些比原子晶体还高,有些比分子晶体还低。
6.X元素的1个原子失去2个电子,被Y元素的2个原子各获得1个电子,形成离子化合物Z,下列说法中不正确的是( )A.固态Z可能是离子晶体B.Z可以表示为X2YC.固态Z熔化后能导电D.X可形成+2价阳离子答案 B7.有关晶体的下列说法中正确的是( )A.晶体中分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.冰融化时水分子中共价键发生断裂D.氯化钠熔化时离子键未被破坏答案 B解析分子稳定是由于分子内所含的共价键稳定,而与分子间作用力大小无关;原子晶体内部只存在共价键,共价键越强,破坏共价键所需的能量越多,熔点越高,B正确;冰在融化时克服的是氢键和范德华力,水分子内部并没有变化;氯化钠熔化时,由于离子间的距离变大,则离子键被破坏。
《专题3》测试题(时间:90分钟分值:100分)可能用到的相对原子质量:He 4O 16S 32Si 28Ca 40一、选择题(本题包括15小题,每题只有一个选项符合题意,每题3分,共45分)1.只需克服范德华力就能汽化的是()A.液态二氧化碳B.液态氨C.醋酸D.乙醇解析B、C、D项还要克服分子间氢键。
答案 A2.下列物质的熔、沸点高低顺序正确的是()A.金刚石>晶体硅>二氧化硅>碳化硅B.CI4>CBr4>CCl4>CH4C.MgO>Na2O>N2>O2D.金刚石>生铁>纯铁>钠解析A项中物质均为原子晶体,共价键键能越大,熔沸点越高,因为键长Si—Si>Si—C>Si—O>C—C,所以键能C—C>Si—O> Si—C>Si—Si,即熔、沸点顺序为:金刚石>二氧化硅>碳化硅>晶体硅;CH4为气体,其余为液体,且相对分子质量越大,分子间作用力越大,熔、沸点越高,B正确;C项应为MgO>Na2O>O2>N2;合金的熔、沸点比其各成分金属的熔、沸点要低,故D项应为金刚石>纯铁>生铁>钠。
答案 B3.按下列四种有关性质的叙述,可能属于金属晶体的是() A.由分子间作用力结合而成,熔点低B.固体或熔融后能导电,熔点在1000℃左右C.由共价键结合成网状结构,熔点高D.固体不导电,但溶于水或熔融后能导电解析A为分子晶体,C为原子晶体,D为离子晶体。
答案 B4.下列微粒中,同时具有离子键、共价键和配位键的是() A.NaOH B.H3O+C.MgCl2D.NH4Cl解析NaOH中含有离子键和共价键;H3O+中含有共价键和配位键;MgCl2中只含有离子键;NH4Cl中NH+4和Cl-以离子键结合,NH+4中N和H形成的化学键既有共价键又有配位键。
答案 D5.下列各组物质的晶体中,化学键类型相同,晶体类型、物质发生状态变化所克服的粒子间的相互作用也相同的是() A.SO3和HCl B.KCl和MgC.CCl4和SiO2D.NaCl和H2O解析SO3和HCl的晶体是分子晶体,分子内原子间的化学键均为极性键,它们发生状态变化时需要克服分子间作用力,A项符合题意;KCl是离子晶体,而Mg是金属晶体,B项不符合题意;CCl4是分子晶体,SiO2是原子晶体,C项不符合题意;NaCl是离子晶体,H2O是分子晶体,D项不符合题意。
答案 A6.根据下表给出的几种物质的熔、沸点数据判断下列说法中错误的是()晶体NaCl MgO AlBr3SiCl4共价化合物R熔点(℃) 801 2852 97.5 -70 1723沸点(℃) 1413 3600 263.3 57 2230A.SiCl4是分子晶体B.MgO比NaCl的晶格能大C.R是原子晶体D.AlBr3为离子晶体解析AlBr3、SiCl4的熔、沸点较低,是分子晶体;MgO比NaCl 的熔、沸点高,MgO比NaCl的晶格能大;共价化合物R的熔、沸点高,是原子晶体。
答案 D7.根据键能数据:H—Cl 431 kJ/mol,H—I 299 kJ/mol,由此可得出的结论是()A.溶于水时,HI分子比HCl分子更容易电离B.HI比HCl熔、沸点都高C.HI比HCl更稳定D.拆开相同物质的量的HI分子比HCl消耗的能量小,HI是离子化合物解析由于H—I键比H—Cl键键能小,故HI比HCl更容易电离。
答案 A8.下列叙述正确的是()A.非金属元素的原子不能构成离子晶体B.非极性键只存在于双原子分子的单质中C.不同元素组成的多原子分子中化学键一定都是极性键D.在金属晶体、离子晶体、原子晶体、分子晶体中,只有离子晶体中存在离子键,其他晶体中不存在离子键解析铵盐是由非金属元素组成,是离子晶体;H2O2是多原子分子,既含有非极性键也含有极性键。
答案 D9.已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。
下列关于C3N4晶体的说法中正确的是() A.C3N4晶体是分子晶体B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长要长C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子D.C3N4晶体中微粒间通过离子键结合解析C3N4是原子晶体;C—N键比C—C键的键长短;C3N4晶体中微粒间通过共价键结合。
答案 C10.下列说法中正确的是()A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动C.分子晶体的熔沸点很低,常温下都呈液态或气态D.原子晶体中的各相邻原子都以共价键相结合解析不同的离子晶体有不同的结构,例如CsCl晶体,每个Cl -周围吸引着8个Cs+,每个Cs+周围有8个Cl-,故A项不正确。
金属晶体本身就是由金属阳离子和自由电子组成,B项不正确。
分子晶体中有很多在常温下呈固态,例如I2、S、P4等,故C项不正确。
原子晶体都以共价键相结合,综上所述,只有D项正确。
答案 D11.已知以下化学键的键能:H—H 436 kJ/mol,Cl—Cl 243 kJ/mol,H—Cl 431 kJ/mol。
下列叙述正确的是()A.Cl—Cl键比H—H键的键能小,是因为Cl原子比H原子的非金属性强B.H2(g)与Cl2(g)反应生成2 molHCl(g),反应的ΔH=183 kJ/mol C.H2(g)与Cl2(g)反应生成2 molHCl(g),反应的ΔH=-183 kJ/molD.H2(g)与Cl2(g)反应生成1 molHCl(g),反应的ΔH=-183 kJ/mol解析A项:因为Cl—Cl键比H—H键的键长长;B项:该反应是放热反应,ΔH应为负值;D项:反应的ΔH=-91.5 kJ/mol。
答案 C 12.某离子晶体的晶胞如图所示,M 为阳离子,分别在顶点和面心,N 为阴离子,在正方体内,则该晶体的化学式为( )A .M 2NB .MN 2C .M 7ND .M 4N 7解析 属于该晶胞的M =8×18+6×12=4,8个N 在正方体内,都属于该晶胞,M:N =4:8=1:2。
答案 B13.下列物质的分子中既有σ键,又有π键,并含有非极性键的是( )①HCl ②H 2O ③N 2 ④H 2O 2 ⑤C 2H 4 ⑥C 2H 2A .①②③B .③④⑤⑥C .①③⑥D .③⑤⑥解析 共价单键必定是σ键,HCl 、H 2O 、H 2O 2中只有σ键,无π键;N 2中有三个共价键:一个σ键,两个π键;C 2H 4中碳碳原子之间有两个共价键:一个σ键,一个π键;C 2H 2中碳碳原子之间有三个共价键:一个σ键,两个π键。
不同种原子形成的共价键为极性键,同种原子形成的共价键为非极性键,N2中的N≡N键、C2H4中的C===C键、C2H2中的C≡C键均为非极性键。
答案 D14.下列说法正确的是()A.丙烯分子中有7个σ键,2个π键B.在60 g SiO2晶体中,Si—O键的数目为2N AC.共价键有方向性,但无饱和性D.由ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子化合物解析丙烯(CH2===CH—CH3)分子中含有8个σ键,1个π键;60 g SiO2晶体中Si—O键数目为4N A;共价键有方向性,也有饱和性;由ⅠA族和ⅥA族形成的原子个数比为1:1,电子总数为38的化合物是Na2O2,是含有共价键的离子化合物,D项正确。
答案 D15.元素X、Y、Z原子序数之和为33,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。
下列推测不正确的是() A.同周期元素中X的金属性最强B.同族元素中Z的氢化物沸点最高C.原子半径X>Y,离子半径X+>Z2-D.Y的单质和氧化物属于相同的晶体类型解析根据X+与Z2-具有相同的核外电子层结构可知,X是第ⅠA族元素,Z是第ⅥA族元素,又由X、Y、Z原子序数之和为33可推知,X为钠元素,是同周期中金属性最强的元素,Z为氧元素,Y为硅元素。
H2O中由于氢键的存在,沸点在同族的氢化物中最高;原子半径:Na>O,离子半径:Na+<O2-;硅和二氧化硅都为原子晶体。
答案 C二、非选择题(共6道题,共55分)16.(8分)现有几组物质的熔点数据如下表:A组B组C组D组金刚石:3110 ℃Li:181 ℃HF:-83 ℃NaCl:801 ℃硅晶体:1410 ℃Na:98 ℃HCl:-114 ℃KCl:776 ℃硼晶体:2300 ℃K:64 ℃HBr:-89 ℃RbCl:718 ℃二氧化硅:1723 ℃Rb:39 ℃HI:-51 ℃CsCl:645 ℃据此回答下列问题:(1)A组属于________晶体,其熔化时克服的微粒间的作用力是________;(2)B组晶体共同的物理性质是________(填序号);①有金属光泽②导电性③导热性④延展性(3)C组中HF熔点反常是由于___________________________;(4)D组晶体可能具有的性质是________(填序号);①硬度小②水溶液能导电③固体能导电④熔融状态能导电解析A组物质熔点高,为原子晶体,熔化时克服共价键;B组为金属晶体,所以应该具备金属晶体的性质;C组中HF存在氢键;D组为离子晶体,其水溶液或熔融状态能导电。
答案(1)原子共价键(2)①②③④(3)HF分子间能形成氢键,增大了分子间作用力(4)②④17.(8分)短周期元素在周期表中的位置关系如图所示。
XYZ(1)X元素的单质的分子式是________,若X核内中子数与质子数相等,则X的摩尔质量为________。
(2)Y与氢化合形成的化合物的结构式为________,在同主族元素的氢化物分子中,该氢化物分子中共价键键能最大,原因是_____。
(3)Z单质的晶体属于________,Z的氢化物的电子式是______,该分子中含________个σ键,________个π键(若不含填0)。
解析X、Y、Z分别为He、F、S元素。
(1)稀有气体是单原子分子,故X元素的单质的分子式为He,核内质子数与中子数相等,则X的摩尔质量为4 g·mol-1。
(2)在ⅦA族元素中,F原子半径最小,氢化物中H—F键键长最短。
(3)硫单质属于分子晶体,H2S分子中含有2个σ键,无π键。
答案(1)He 4 g·mol-1(2)H —F F 原子半径最小,H —F 键键长最短(3)分子晶体 H:S ····:H 2 0 18.(8分)用Cl 2生产某些含氯有机物时会产生副产物HCl 。