试验碱性磷酸酶的分离提取及比活力的测定
- 格式:ppt
- 大小:849.00 KB
- 文档页数:12
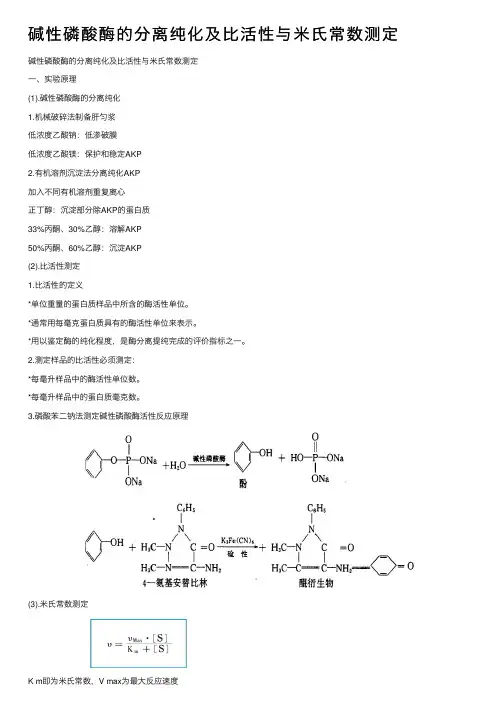
碱性磷酸酶的分离纯化及⽐活性与⽶⽒常数测定碱性磷酸酶的分离纯化及⽐活性与⽶⽒常数测定⼀、实验原理(1).碱性磷酸酶的分离纯化1.机械破碎法制备肝匀浆低浓度⼄酸钠:低渗破膜低浓度⼄酸镁:保护和稳定AKP2.有机溶剂沉淀法分离纯化AKP加⼊不同有机溶剂重复离⼼正丁醇:沉淀部分除AKP的蛋⽩质33%丙酮、30%⼄醇:溶解AKP50%丙酮、60%⼄醇:沉淀AKP(2).⽐活性测定1.⽐活性的定义*单位重量的蛋⽩质样品中所含的酶活性单位。
*通常⽤每毫克蛋⽩质具有的酶活性单位来表⽰。
*⽤以鉴定酶的纯化程度,是酶分离提纯完成的评价指标之⼀。
2.测定样品的⽐活性必须测定:*每毫升样品中的酶活性单位数。
*每毫升样品中的蛋⽩质毫克数。
3.磷酸苯⼆钠法测定碱性磷酸酶活性反应原理(3).⽶⽒常数测定K m即为⽶⽒常数,V max为最⼤反应速度*如上式表⽰,⽶⽒常数是反应速度为最⼤值的⼀半时的底物浓度,因此,⽶⽒常数的单位为mol/L。
当反应速度等于最⼤速度⼀半时,即V = 1/2 V max, K m = [S]*吸光度表⽰不同底物浓度时的酶反应速度。
以吸光度的倒数作纵坐标,以底物浓度的倒数作横坐标,按Lineweaver-Burk作图法可求出Km值。
⼆. 器材721分光光度计台式离⼼机恒温⽔浴锅微量移液器托盘天平匀浆器试管三.试剂1. 0.5mol/L醋酸镁溶液称取醋酸镁5.3625g溶于蒸馏⽔中,稀释⾄50ml.2. 0.1mol/L醋酸钠溶液称取醋酸钠0.0820g溶于蒸馏⽔中,稀释⾄10ml.3. 0.01mol/L醋酸镁---醋酸钠溶液取0.5mol/L醋酸镁溶液2ml及0.1mol/L醋酸钠溶溶液10ml,混合均匀后加蒸馏⽔稀释⾄100ml.4. 丙酮(分析纯).5. 95%⼄醇(分析纯).6. Tris缓冲液(Ph8.8) 称取Tris 6.05g,⽤蒸馏⽔溶解成50ml,为0.1mol/L Tris 液,取0.1mol/L Tris液10ml,加0.5mol/L醋酸镁2ml,加蒸馏⽔80ml,再⽤1%醋酸调pH⾄8.8,然后⽤蒸馏⽔稀释⾄100ml.7. 0.01mol/L基质液称取磷酸苯⼆钠(C6H5PO4Na2.2H2o)0.3g,4-氨基安替⽐林0.15g,分别溶于煮沸冷却后的蒸馏⽔中;两液混合并蒸馏⽔稀释⾄50ml,加0.2ml氯仿防腐,盛于棕⾊瓶中,冰箱内保存,可⽤⼀星期;临⽤时与等量0.1mol/L pH10的碳酸盐缓冲液混合即可.8. 0.1mol/L pH10的碳酸盐缓冲液称取⽆⽔碳酸钠0.318g及碳酸氢钠0.168g溶于蒸馏⽔,稀释⾄50ml.9. 碱性溶液量取0.5mol/L氢氧化钠溶液与0.5mol/L碳酸氢钠溶液各20ml,混合后加蒸馏⽔⾄100ml.10. 0.5%铁氰化钾溶液称取铁氰化钾0.25g和硼酸0.75g,各溶于20ml蒸馏⽔中,溶解后两液混合均匀,再加蒸馏⽔⾄50ml,置棕⾊瓶中暗处保存.11. 0.1mol/L醋酸镁溶液称取醋酸镁0.2145g溶于蒸馏⽔中,稀释⾄10ml.12. 酚标准液(0.1mg/ml).四.实验步骤(1). “碱性磷酸酶分离纯化”实验操作(2).“碱性磷酸酶⽐活性测定”实验操作1.样品中碱性磷酸酶活性测定:(1).取5⽀试管,编号,按表1操作:表1A’B’C’D’标准空⽩各阶段稀释液(ml) 0.1 0.1 0.1 0.1 - -0.1mg/ml酚标准液(ml) - -- - 0.1 -pH8.8Tris缓冲液(ml) - - - - - 0.1置37℃⽔浴中保温5分钟复合基质液(ml) 3.0 3.0 3.0 3.0 3.0 3.0混匀,37℃⽔浴中准确保温15分钟.保温结束后,各管⽴即加⼊1.0ml碱性溶液终⽌反应,再加⼊0.5%铁氰化物钾2.0ml,⽴即混匀,静置10min,在510nm波长下⽐⾊测定.2.酶活性单位计算每毫升酶液中酶活性单位=测定OD/标准OD X标准管中酚含量X1/0.1X稀释倍数3.样品中蛋⽩质含量的测定(1)测定蛋⽩质时,保留的A’管还需稀释5倍为A’’管,否则蛋⽩质浓度太⾼,其余各管不需再稀释,各⽤1.0ml进⾏测定.表2A’’B’C’D’空⽩各阶段稀释液(ml) 1.01.01.01.0 -0.1mg/ml酚标准液(ml) - -- -1.0pH8.8Tris缓冲液(ml) 5.0 5.0 5.0 5.0 5.0混匀,置20~25℃⽔浴中保温10分钟复合基质液(ml) 0.50.50.50.50.5(2)⽴即振摇均匀,在20~25℃保温30min后,于650nm波长处⽐⾊.(3)蛋⽩质浓度计算:从Lowry法标准曲线查得的蛋⽩质毫克数,乘以稀释倍数,即为每毫升样品中蛋⽩质毫克数.4.⽐活性及得率计算碱性磷酸酶⽐活性=每毫升样品中碱性磷酸酶活性单位数/每毫升样品中蛋⽩质毫克数纯化倍数=各阶段⽐活性数/匀浆(A液)⽐活性数得率=各阶段酶的总活性单位/匀浆(A液)中的酶的总活性单位X100%5.实验结果将上述各实验计算结果填⼊表3内.表3分离总体积蛋⽩质总蛋⽩每毫升酶总活性⽐活性纯化得率阶段(ml) 浓度(mg) 活性单位单位(U/mg ) 倍数(%)(mg/ml) (U/ml) (U)匀浆(A液)第⼀次丙酮沉淀(B液)第⼆次丙酮沉淀(C液)第三次丙酮沉淀(D液)3.⽶⽒常数测定1. 取15只试管,按照下表操作,1~7号重复两组,0 号为空⽩对照。

实验十一碱性磷酸酶的提取、比活性及Km测定(综合性实验)碱性磷酸酶的分离提取和比活性测定一、目的要求1. 熟悉从生物样品中提取与纯化酶的一般方法。
2.掌握碱性磷酸酶(AKP) 比活性的测定原理和方法。
3.了解测定酶比活性的意义。
二、实验原理本实验采取有机溶剂沉淀法从兔肝匀浆液中提取分离碱性磷酸酶(AKP)。
正丁醇能使部分杂蛋白变性,过滤除去杂蛋白,即得到含有AKP的滤液,AKP能溶于终浓度为33%的丙酮或30%的乙醇中,而不溶于终浓度为50%的丙酮或60%的乙醇中,通过离心即可得到初步纯化的AKP。
根据国际酶学委员会规定,酶的比活性(specific activity)用每mg蛋白质具有的酶活性单位(u/mg·pr)来表示。
因此,测定样品的比活性必须测定:(1)每ml 样品中的蛋白质mg数(mg/m1);(2)每ml样品中的酶活性单位数(U/ml)。
酶的纯度越高酶的比活性也就越高。
本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。
酚在碱性条件下与4-氨基安替比林作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。
于510nm处比色,即可求出反应过程中产生的酚含量,而碱性磷酸酶的活性单位(King-Armstrong法)可定义为:在37℃保温15min 每产生lmg的酚为一个酶活性单位。
样品中蛋白质含量测定用Folin-酚法测定。
三、实验器材(一)实验材料1.兔肝(二)实验仪器1.研钵 2.刻度离心管 3.移液管 4.电动离心机 5.玻璃漏斗和玻棒6.托盘天平 7.恒温水浴 8.分光光度计 9.剪刀 10.滤纸(三)实验试剂1. 0.5mol/L乙酸镁溶液:称取乙酸镁107.25g溶于蒸馏水中,稀释至1000ml。
2.0.1mol/L乙酸钠溶液:称取乙酸钠8.2g溶于蒸馏水中,稀释至1000ml。
3.0.01mol/L乙酸镁-0.01mol/L乙酸钠溶液:取0.5mol/L乙酸镁溶液20ml及0.1mol/L乙酸钠溶液100ml,混合后加蒸馏水稀释到1000ml。

生物化学实验报告小牛肠碱性磷酸酶的提纯及酶活的测定、SDS-PAGE电泳法测定蛋白质相对分子质量摘要:碱性磷酸酶是在碱性条件下水解多种磷酸酯并具有转磷酸基作用的一组酶,并且在较高温度下扔具有活性,本实验中通过一系列分离纯化获得碱性磷酸酶,催化底物对硝基苯磷酸二钠生成对硝基苯酚,对硝基苯酚在405nm光波长下有最大吸收,通过测定吸光值的变化率,可以检测测定酶活性(在特定条件下,1min内催化1μmol底物转化成产物所需要的酶量被称为一个酶活力单位);蛋白质-考马斯亮蓝结合物在595nm波长下的光吸收与蛋白质含量成正比,所以可以利用考马斯亮蓝法测定蛋白质含量。
SDS-PAGE电泳法测定蛋白质的相对分子质量,是因为SDS可以与蛋白质形成蛋白质-SDS复合物,电泳迁移率主要取决于蛋白质的分子量大小,以推断出被测蛋白样品分子量的近似值。
关键词:碱性磷酸酶;提取;小牛肠;酶活性测定;马斯亮蓝法;蛋白质含量测定;SDS-PAGE电泳法;实验部分1.1试剂与仪器试剂:正丁醇,丙酮(置于-20摄氏度冰箱保存),硫酸铵,30% 丙烯酰胺,10% 过硫酸铵,1 mol/L HAc,1 mol/L NaOH,TEMED(四甲基乙二胺),电泳缓冲液,平衡缓冲液(0.01 mol/L Tris-HCl,pH 8.0,含1.0×10-3 mol/L MgCl2和1.0×10-5 mol/L ZnCl2);底物缓冲液(1 mol/L 二乙醇胺-盐酸缓冲液,pH 9.8,含0.5×10-3 mol/L MgCl2);酶的底物溶液(用底物缓冲液配制15×10-3 mol/L 对硝基苯磷酸二钠溶液);分离胶缓冲液(1.5 mol/L Tris-HCl缓冲液,pH 8.8,已加入10% SDS)浓缩胶缓冲液(0.5 mol/L Tris-HCl缓冲液,pH 6.8,已加入10% SDS);上样缓冲液(100 mg SDS、2 mg溴酚蓝、2 g甘油,加0.1 mL巯基乙醇、2 mL 0.05mol/L pH 8.0 Tris-HCl,加超纯水定容至10 mL);染色液(含0.1% 考马斯亮蓝R250,40%甲醇和10%冰酸的染色液500 mL);脱色液(500 mL 10%甲醇和10%冰醋酸的脱色液1000 mL);电泳缓冲液(0.1% SDS,0.05mol/L Tris,0.384 mol/L甘氨酸pH 8.3)仪器:匀浆机(常州国华电气有限公司JJ-2);高速冷冻离心机(eppendorf centrifuge 5804R);恒温水浴(上海一恒科技有限公司HWS-12);紫外可见分光光度计(上海精密科学仪器有限公司UV720);双垂直电泳槽(DYCZ-24D);电泳仪(北京市六一仪器厂DYY-8C);脱色摇床:WD-9405A 1.2.1小牛肠碱性磷酸酶的提取1、刮取新鲜小牛肠内粘膜。

2014年生物化学实验B实验报告姓名:姓名学号:201247044实验时间:2014.11.15实验分组:第七组组内成员:组员201247002组员201247020组员201247060 任课教师:李晓晖小牛肠碱性磷酸酶的提取及酶活测定考马斯亮蓝法测定蛋白质含量SDS-聚丙烯酰胺凝胶电泳测定蛋白质相对分子质量组员1,组员2,组员3,组员4化工与环境生命学部 化工学院 化学工程与工艺(国际)1201班摘要 本文以从小牛肠中提取碱性磷酸酶为例,介绍了生物体中分离、提取酶的方法,以及如何使用考马斯亮蓝法测定所提取酶的蛋白含量并以此得出酶活。
同时通过SDS-聚丙烯酰胺凝胶电泳来测定给定蛋白质样品的相对分子质量。
关键词 小牛肠碱性磷酸酶 酶活 对硝基苯酚 吸光值 考马斯亮蓝R-250 SDS-聚丙烯酰胺凝胶电泳 蛋白质相对分子质量碱性磷酸酶(AKP,EC 3.1.3.1)是一种非特异性水解酶,广泛存在于动物各脏器、微生物和植物中。
它在体外能催化多种磷酸单脂类化合物的水解,得到相应的醇。
不同来源的AKP ,其分子量和亚基结构各不相同。
小牛肠碱性磷酸酶相对分子质量为145000,等电点为7.5。
在体外可催化底物对硝基苯磷酸二钠生成对硝基苯酚,后者在405nm 光波长下有最大吸收,通过测定吸光值的变化率,即可测定碱性磷酸酶的活力。
酶活定义:在最适条件下,以每分钟催化水解1µmol 底物的酶量为一个酶活力单位。
本实验温度取37℃。
酶活力的计算:酶活力(u/mg )=L C V DV A E R ⨯⨯⨯⨯⨯∆405E min /式中,∆A/min 为405nm 波长下的吸光值的变化率;V R 为反应液的体积,D 为稀释倍数;E 405为405nm 波长下对硝基苯酚的摩尔消光系数,18.3;V E 为所加酶液体积;C 为蛋白浓度;L 为比色皿光程。
考马斯亮蓝R-250测定蛋白质含量属于染料结合法的一种。
考马斯亮蓝R-250在酸性溶液中的游离状态呈红褐色,当它与蛋白质结合后变为蓝色,前者最大吸收波长为465nm ,后者为595nm 。



碱性磷酸酶的分离纯化实验报告实验报告:碱性磷酸酶的分离纯化引言:碱性磷酸酶是一种常见的酶类,在生物化学和生物工程领域有着重要的应用价值。
分离纯化碱性磷酸酶可以有效地提高其催化活性,从而更好地满足利用需求。
本实验旨在通过分离纯化的方法获得高纯度的碱性磷酸酶。
材料与方法:材料:1. 含有碱性磷酸酶的混合酶液;2. DEAE-纤维素离子交换柱;3. 带有荧光物质的酶学百科试剂盒;4. 透析膜。
方法:1. 将50 mL含有碱性磷酸酶的混合酶液,通过DEAE-纤维素离子交换柱进行分离纯化;2. 用PBS缓冲液洗涤纤维素柱,收集洗脱液以及洗脱后的洗脱液,测定酶活力;3. 分别将洗脱后的洗脱液和洗脱液透析入PBS缓冲液中;4. 用带有荧光物质的酶学百科试剂盒测定样品的酶活力。
结果:样品中碱性磷酸酶的活性经过分离纯化后得到了提高,相对活性提高了3倍以上。
同时,样品纯度也有了显著的提高。
分析和讨论:本实验通过离子交换柱和透析膜的方法,成功地分离和纯化了碱性磷酸酶。
实验中使用的DEAE-纤维素离子交换柱是一种较为成熟且常见的方法,具有操作简单、精度高等特点。
透析膜则可以更为彻底地去除不需要的杂质,进一步提高受体的纯度。
在实验结果中,我们发现酶的相对活性得以提高,这说明经过纯化后酶的质量得到了提高,可以进行更好地应用。
但同时,这样的分离纯化也存在一定的局限性,如纯度并没有达到100%,仍存在需进一步提高的空间。
结论:本实验成功地纯化和分离了碱性磷酸酶,提高了其相对活性,获得了具有实际应用需求的高纯度酶样品。
同时,在实际应用过程中,需要根据需求进行更为严格的纯化和分离,以满足更加精细化的需求。


8碱性磷酸酶比活力测定概述碱性磷酸酶(alkaline phosphatase,ALP)是一种广泛存在于动植物组织和微生物中的酶,其主要功能是催化磷酸盐基团的水解反应。
ALP的活性主要由酸碱度、温度、金属离子浓度等因素所影响。
ALP比活力测定可以用于快速筛选和检测酶的活性及其活性变化等。
本实验采用8碱性磷酸酶作为模型酶,采用间接比色法测定其比活力。
材料和试剂试剂:1. 空白对照:含有ALP缓冲液的管2. 标准对照:10μg/mL碱性磷酸酶溶液3. 涂板洗涤缓冲液:PBS液,pH 7.44. 反应底物:pNPP溶液5. 停止液:2mol/L NaOH溶液6. ALP缓冲液:0.1mol/L甘氨酸缓冲液,pH 9.6,含有1mmol/L MgCl2仪器:1. 组合式洗板机2. 酶标仪3. 加热器4. 温度计方法注意事项:1. 所有的样品和标准溶液都应在同一天制备,并测量前混匀。
2. 所有的试剂和材料都要神经否则可能影响实验结果。
实验操作:1. 取100μL标准对照和100μL空白对照,分别加入洗涤缓冲液中,洗涤3次。
2. 加入100μL标准对照和待测样品至96孔板中。
每个样品平行加入两个孔。
3. 加入50μL反应底物至每个孔中,将板密封,加热反应30min。
4. 加入50μL停止液,将板洗涤5次。
5. 测定吸光度值,波长为405nm。
数据处理1. 记录96孔板中每个孔的吸光度值。
2. 以标准对照为基准,计算每个孔的相对吸光度值。
3. 以样品组的平均相对吸光度值为y,以标准对照相对吸光度值为x,绘制标准曲线,计算标准曲线的斜率。
4. 计算样品的ALP比活力。
样品ALP比活力= (样品相对吸光度值/y) x 斜率。
结果与分析以标准曲线计算每个样品的ALP比活力,根据结果可以判断样品中ALP酶的比活力。
若ALP比活力高,说明该样品中ALP酶活性较强;若低,则说明其活性相对较弱。
总结。

碱性磷酸酶的提取分离和比活力的测定项目名称碱性磷酸酶的提取分离和比活力的测定xinpingzhao@实验目的1. 了解酶提取纯化的基本实验技术;2. 掌握碱性磷酸酶酶活力及比活力的测定方法实验材料新鲜兔肝或兔肾主要仪器设备匀浆器,冷冻离心机,分光光度计,电子天平等.实验原理碱性磷酸酶(简称AKP)在磷酸盐代谢中起重要作用。
核酸序列分析、DNA重组技术、酶标免疫检测技术以及临床检验中都需要利用此酶。
本实验取材于兔肝,经匀浆、正丁醇抽提、硫酸胺分段盐析或者有机溶剂沉淀,获得碱性磷酸酶制品。
本实验采用对硝基苯磷酸二钠(p-NPP)为底物的方法测定酶活。
对硝基苯磷酸二钠在碱性磷酸酶的作用下被水解为游离磷酸及对硝基苯酚,对硝基苯酚在强碱性条件下显示亮黄色,在405nm处有强烈的吸收峰。
因此可以测定405nm处的吸收值A405nm来计算产物的生成量,从而计算出酶活力,然后通过各级纯化步骤产物蛋白含量的测定,从而计算出酶的比活力.第一部分: 碱性磷酸酶的提取以下操作均在4℃进行。
方案一:1. 称取新鲜兔肝2g,剪碎后,置于玻璃匀浆器中,按1:2(m/v)加入预冷的0.05mol/LTris-HCl (pH9.0)缓冲液,匀浆后4℃抽提20 min;4℃,8000r/min离心10min;取上清;此为A 液。
另取1支试管编号为A,取0.1mLA 液,加1.9mLTris缓冲液(pH 8.8),混匀,供测酶活性用。
2.上清液中加入1/5体积预冷正丁醇脱脂20min;8000r/min离心10min,取上清;此为B液。
吸取0.1m1B 液,置于编号为B 的试管中,加入1.9m1Tris 缓冲液(pH 8.8),供测酶活用。
3.加入硫酸铵至35%饱和度;4℃30 min;8000r/min离心10min,弃沉淀;取上清;此为C 液。
吸取C 液0.2m1置于编号为c 的试管中,加入1.8m1Tris 缓冲液(PH 8.8),供测酶活性用4.然后在上清液中加入硫酸铵至75%饱和度,4℃静置30 min后8000r/min离心10min,得沉淀..用0.05mol/LTris-HCl(pH9.0)缓冲液溶解沉淀;此为D 液。
碱性磷酸酶的提取分离和比活力的测定碱性磷酸酶是一种广泛存在于生物体内的酶,能够催化酸性环境下的磷酸酯水解反应,在多种生理过程中发挥重要作用。
其提取分离和比活力的测定具有重要的科学研究价值和应用前景。
一、碱性磷酸酶的提取分离1、组织样品制备将待提取的组织放入离心管中,加入磷酸盐缓冲液(pH 7.4),用高速离心离心3-5分钟,去除上清液并加入1mL磷酸盐缓冲液,在实验台上加入玻璃珠或石英砂,放入冰箱冷冻器中。
2、细胞裂解将组织经过粉碎的样品加入磷酸盐缓冲液(pH 7.4),放入研钵中,加入冰冷甲醇,研磨5-10分钟。
将打磨液离心分离,上清液用分液漏斗收集,加入等量的0.1mol/L四乙基铵溶液,静置20分钟,收集上清液并加入2.5%聚乙烯醇。
3、沉淀和提取将沉淀后的样品中加入氯仿等有机溶剂,轻微摇动,分离出沉淀,将上清液倒入烧瓶中,并用氯仿洗涤,收集洗涤液后将其合并,加入甲醇进行沉淀,离心分离,去除上清液,加入2-3倍体积的丙酮,静置反复冲洗多次。
将沉淀中加入适量的溶解液,摇混均匀,转移至离心管中,并用离心机转速2800r/min/5 min。
二、碱性磷酸酶的比活力测定1、酶活性试验体系将提取分离后的活性酶样品用注射器加入已配制好的酶活性试验体系中,包括10mM Tris-HCl缓冲液(pH 8.0)、1 mM EDTA缓冲液、2 mM酚酞液、0.1M NaCl等,总体积为2ml。
2、样品处理制备所需要的各种试剂和标准品,并制备好标准品不同浓度的稀释液。
将稀释后的酶样品取1ml,加入酶活性试验体系中,并在无酶样品控制下,以相同的温度下逐渐加入不同的底物溶液,如α-萘酚磷酸钠。
注意不要影响反应溶液 pH 值和终点的颜色产生,以免误诊。
3、反应终止在反应末期,可以加入固定量的0.1N NaOH终止反应,并使用p-酚酸作为对照品和标准品进行比较或质控,并测定比活力。
综上所述,选择合适的方法提取分离和测定碱性磷酸酶的比活力对于进一步探究其在生理过程中的作用机制以及相关疾病的诊断和治疗等方面具有重要的意义。
实验名称碱性磷酸酶的分离纯化、比活性测定与动力学分析实验日期2011年10月25号实验地点生化实验室合作者指导老师总分教师签名批改日期碱性磷酸酶(AKP或ALP)是一种底物特异性较低,在碱性条件下能水解多重磷酸单脂化合物的酶,需要镁和锰离子为激活剂。
AKP具有磷酸基团转移活性,能将底物中的磷酸基团转移到另一个含有羟基的接受体上,如磷酸基团的接受体是水,则其作用就是水解。
AKP最适PH范围为8.6-10,动物中AKP主要存在于小肠粘膜、肾、骨骼、肝脏和胎盘等组织的细胞膜上。
血清AKP主要来自肝,小部分来自骨骼。
AKP可从组织中分离纯化,也可以采用基因工程表达的方式获得:将碱性磷酸酶基因克隆到重组载体,转入宿主菌中进行重组表达,并从表达菌提取,并进行酶动力学分析。
一实验原理1、碱性磷酸酶的分离纯化AKP分离纯化的方法与一般蛋白质的分离纯化方法相似,常用中性盐盐析法、电泳法、色谱法、有机溶剂沉淀法等方法分离纯化。
有时需要多种方法配合使用,才能得到高纯度的酶蛋白。
本实验采用有机溶剂沉淀法从兔肝匀浆液中提取分离AKP。
正丁醇能使部分杂蛋白变性,过滤除去杂蛋白即为含有AKP的滤液,AKP能溶于终浓度为33%的丙酮或30%的乙醇中,而不溶于终浓度为50%的丙酮或60%的乙醇中,通过离心即可得到初步纯化的AKP。
2、碱性磷酸酶的比活性测定根据国际酶学委员会规定,酶的比活性用每毫克蛋白质具有的酶活性来表示,单位(U/mg••pr)来表示。
因此,测定样品的比活性必须测定:a每毫升样品中的蛋白质毫克数;b每毫升样品中的酶活性单位数。
酶的纯浓度越高酶的比活性也就越高。
本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。
酚在碱性条件下与4-氨基安替比作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。
于510nm 处比色,即可求出反应过程中产生的酚含量,而碱性磷酸酶的活性单位可定义为:在37摄氏度保温15min每产生1mg的酚为一个酶活性单位。
⽣化实验思考题参考答案解析[1]⽣化实验讲义思考题参考答案实验⼀淀粉的提取和⽔解1、实验材料的选择依据是什么?答:⽣化实验的材料选择原则是含量⾼、来源丰富、制备⼯艺简单、成本低。
从科研⼯作的⾓度选材,还应当注意具体的情况,如植物的季节性、地理位置和⽣长环境等,动物材料要注意其年龄、性别、营养状况、遗传素质和⽣理状态等,微⽣物材料要注意菌种的代数和培养基成分的差异等。
2、材料的破碎⽅法有哪些?答:(1) 机械的⽅法:包括研磨法、组织捣碎法;(2) 物理法:包括冻融法、超声波处理法、压榨法、冷然交替法等;(3) 化学与⽣物化学⽅法:包括溶胀法、酶解法、有机溶剂处理法等。
实验⼆总糖与还原糖的测定1、碱性铜试剂法测定还原糖是直接滴定还是间接滴定?两种滴定⽅法各有何优缺点?答: 我们采⽤的是碱性铜试剂法中的间接法测定还原糖的含量。
间接法的优点是操作简便、反应条件温和,缺点是在⽣成单质碘和转移反应产物的过程中容易引⼊误差;直接法的优点是反应原理直观易懂,缺点是操作较复杂,条件剧烈,不易控制。
实验五粗脂肪的定量测定─索⽒提取法(1)本实验制备得到的是粗脂肪,若要制备单⼀组分的脂类成分,可⽤什么⽅法进⼀步处理?答:硅胶柱层析,⾼效液相⾊谱,⽓相⾊谱等。
(2)本实验样品制备时烘⼲为什么要避免过热?答:防⽌脂质被氧化。
实验六蛋⽩质等电点测定1、在等电点时蛋⽩质溶解度为什么最低?请结合你的实验结果和蛋⽩质的胶体性质加以说明。
蛋⽩质是两性电解质,在等电点时分⼦所带净电荷为零,分⼦间因碰撞⽽聚沉倾向增加,溶液的粘度、渗透压减到最低,溶解度最低。
结果中pH约为4.9时,溶液最浑浊,达到等电点。
答:2、在分离蛋⽩质的时候,等电点有何实际应⽤价值?答: 在等电点时,蛋⽩质分⼦与分⼦间因碰撞⽽引起聚沉的倾向增加,所以处于等电点的蛋⽩质最容易沉淀。
在分离蛋⽩质的时候,可以根据待分离的蛋⽩质的等电点,有⽬的地调节溶液的pH使该蛋⽩质沉淀下来,从⽽与其他处于溶液状态的杂质蛋⽩质分离。
碱性磷酸酶的分离纯化及比活性与米氏常数测定一、实验原理(1).碱性磷酸酶的分离纯化1. 机械破碎法制备肝匀浆低浓度乙酸钠:低渗破膜低浓度乙酸镁:保护和稳定AKP2.有机溶剂沉淀法分离纯化AKP加入不同有机溶剂重复离心正丁醇:沉淀部分除AKP的蛋白质33%丙酮、30%乙醇:溶解AKP50%丙酮、60%乙醇:沉淀AKP(2).比活性测定1.比活性的定义*单位重量的蛋白质样品中所含的酶活性单位。
*通常用每毫克蛋白质具有的酶活性单位来表示。
*用以鉴定酶的纯化程度,是酶分离提纯完成的评价指标之一。
2.测定样品的比活性必须测定:*每毫升样品中的酶活性单位数。
*每毫升样品中的蛋白质毫克数。
3.磷酸苯二钠法测定碱性磷酸酶活性反应原理(3).米氏常数测定K m 即为米氏常数,V max为最大反应速度*如上式表示,米氏常数是反应速度为最大值的一半时的底物浓度,因此,米氏常数的单位为mol/L。
当反应速度等于最大速度一半时,即V= 1/2 V max, K m = [S]*吸光度表示不同底物浓度时的酶反应速度。
以吸光度的倒数作纵坐标,以底物浓度的倒数作横坐标,按Lineweaver-Burk作图法可求出Km值。
二. 器材721分光光度计台式离心机恒温水浴锅微量移液器托盘天平匀浆器试管三. 试剂1. 0.5mol/L醋酸镁溶液称取醋酸镁5.3625g溶于蒸馏水中,稀释至50ml.2. 0.1mol/L醋酸钠溶液称取醋酸钠0.0820g溶于蒸馏水中,稀释至10ml.3. 0.01mol/L醋酸镁---醋酸钠溶液取0.5mol/L醋酸镁溶液2ml及0.1mol/L醋酸钠溶溶液10ml,混合均匀后加蒸馏水稀释至100ml.4. 丙酮(分析纯).5. 95%乙醇(分析纯).6. Tris缓冲液(Ph8.8) 称取Tris 6.05g,用蒸馏水溶解成50ml,为0.1mol/L Tris液,取0.1mol/L Tris液10ml,加0.5mol/L醋酸镁2ml,加蒸馏水80ml,再用1%醋酸调pH至8.8,然后用蒸馏水稀释至100ml.7. 0.01mol/L基质液称取磷酸苯二钠(C6H5PO4Na2.2H2o) 0.3g,4-氨基安替比林0.15g,分别溶于煮沸冷却后的蒸馏水中;两液混合并蒸馏水稀释至50ml,加0.2ml氯仿防腐,盛于棕色瓶中,冰箱内保存,可用一星期; 临用时与等量0.1mol/L pH10的碳酸盐缓冲液混合即可.8. 0.1mol/L pH10的碳酸盐缓冲液称取无水碳酸钠0.318g及碳酸氢钠0.168g溶于蒸馏水,稀释至50ml.9. 碱性溶液量取0.5mol/L氢氧化钠溶液与0.5mol/L碳酸氢钠溶液各20ml,混合后加蒸馏水至100ml.10. 0.5%铁氰化钾溶液称取铁氰化钾0.25g和硼酸0.75g,各溶于20ml蒸馏水中,溶解后两液混合均匀,再加蒸馏水至50ml,置棕色瓶中暗处保存.11. 0.1mol/L醋酸镁溶液称取醋酸镁0.2145g溶于蒸馏水中,稀释至10ml.12. 酚标准液(0.1mg/ml).四.实验步骤(1). “碱性磷酸酶分离纯化”实验操作。
猪肝中碱性磷酸酶的分离纯化及部分性质研究实验报告摘要:碱性磷酸酶(alkaline phosphatase,简称ALP)广泛存在于微生物和动物体内,是一种非特异性磷酸单酯酶。
本实验材料取自猪肝,采用有机溶剂沉淀分离纯化其中所含的碱性磷酸酶,运用终止法和考马斯亮蓝法测定其酶活力和蛋白质含量。
根据酶活力变化,进行不同温度,PH对该酶的影响的实验,得出最适温度和最适PH。
关键词:碱性磷酸酶;有机溶剂沉淀;酶活力;PH;温度1 前言碱性磷酸酶是广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织经肝脏向胆外排出的一种酶。
碱性磷酸酶是一种能够将对应底物去磷酸化的酶,即通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基,这类底物包括核酸、蛋白、生物碱等。
而该脱去磷酸基团的过程被称为去磷酸化或脱磷酸化。
本实验中所用的猪肝中的碱性磷酸酶含量颇高,且其活性可在较长时间内得以保持。
1.1实验目的掌握以有机溶剂分离技术提取蛋白质及酶的原理和方法;酶蛋白纯化过程中的活性、比活性、得率及纯化倍数的概念及计算;了解AKP的临床意义及纯化蛋白质的一般方法。
1.2 实验试剂与仪器1.2.1 实验仪器电子天平;匀浆器;紫外可见分光光度计;高速冷冻离心机;PH计;磁力加热搅拌机1.2.2实验试剂及配制95%乙醇、丙酮、正丁醇、醋酸镁、醋酸钠、Tris、考马斯亮蓝G-250、硫酸镁、氢氧化钠(1)0.01mol/L醋酸镁-0.01mol/L醋酸钠混合溶液:取0.5mol/L醋酸镁20mL 及0.1mol/L醋酸钠100mL,混匀后加蒸馏水稀释至1000mL。
(2)0.01mol/L Tris-硫酸镁缓冲液(pH8.8):称取三羟甲基氨基甲烷(Tris)12.1g,用蒸馏水溶解,并稀释至1000mL,配制0.1mol/L Tris溶液;取0.1mol/L Tris溶液100mL,加蒸馏水约700mL,再加0.5mol/L醋酸镁20mL,混匀后用1%醋酸溶液调节pH至8.8,用蒸馏水稀释至1000mL即可。