碱性磷酸酶的分离提取
- 格式:ppt
- 大小:885.00 KB
- 文档页数:19

碱性磷酸酶的分离纯化与酶学性质研究董静 201131301031摘要:以猪肝为原料,采用低浓度醋酸钠(低渗破膜作用)制备肝匀浆,醋酸镁则有保护和稳定AKP 的作用,匀浆中加入正丁醇可使部分杂蛋白变性,释出膜中酶,过滤后,以去除杂蛋白。
含有AKP 的滤液用冷丙酮和冷乙酸进行重复分离纯化。
根据AKP 在33%的丙酮或30%的乙醇中溶解,而在50%的丙酮或60%的乙酸中不溶解的性质,用冷丙酮和冷乙醇重复分离提取,可从含有AKP 的滤液中获得较为纯净的碱性磷酸酶。
酶学性质研究表明该酶催化对磷酸苯二钠水解反应的最适PH值为10.0,最适温度为37℃,米氏常数值Km为3.154mmol/L,酶的热稳定性研究表明该酶在pH在8-9区间和温度在25℃-37℃区间下稳定。
关键字:碱性磷酸酶分离纯化热稳定性酸碱稳定性碱性磷酸酶(Alkalinephosphatase,EC3.1.3.1,简称AKP)广泛存在于微生物界和动物界,它在动物机体的骨化过程中及在磷化物和其他一些营养物质的消化、吸收和转运过程中起着重要作用。
此外,通过催化磷蛋白的水解,碱性磷酸酶在细胞调节过程中也具有一定的作用。
它可专一性的水解磷酸单酯化合物而释放无机磷,主要用于核酸研究,分析、测定核苷酸顺序及其基团的重组、分离,也是酶标免疫测定技术的常用工具酶之一。
药用化妆品中添加碱性磷酸酶有益于皮肤细胞的再生和新陈代谢,还可用于核苷酸脱磷产生核苷等。
它是一种膜结合蛋白,在生物体内直接参与磷酸基团的转移和代谢等生理过程[1]。
临床上通过测定AKP的活力,可作为诊断骨骼及肝脏疾病的重要生化指标。
因此纯化和研究AKP的性质、调控等有重要意义。
本实验尝试以猪肝为材料,分离纯化猪肝碱性磷酸酶,研究其酶学性质,旨在探讨以猪肝研制科研用碱性磷酸酶生化试剂的方法,同时也为进一步的深入研究该酶提供理论上的参考。
此外,猪肝来源广泛,价格便宜,可以作为生产碱性磷酸酶生化试剂的原料[2-3]。

碱性磷酸酶的分离纯化及比活性与米氏常数测定一、实验原理(1).碱性磷酸酶的分离纯化1. 机械破碎法制备肝匀浆低浓度乙酸钠:低渗破膜低浓度乙酸镁:保护和稳定AKP2.有机溶剂沉淀法分离纯化AKP加入不同有机溶剂重复离心正丁醇:沉淀部分除AKP的蛋白质33%丙酮、30%乙醇:溶解AKP50%丙酮、60%乙醇:沉淀AKP(2).比活性测定1.比活性的定义*单位重量的蛋白质样品中所含的酶活性单位。
*通常用每毫克蛋白质具有的酶活性单位来表示。
*用以鉴定酶的纯化程度,是酶分离提纯完成的评价指标之一。
2.测定样品的比活性必须测定:*每毫升样品中的酶活性单位数。
*每毫升样品中的蛋白质毫克数。
3.磷酸苯二钠法测定碱性磷酸酶活性反应原理(3).米氏常数测定K m 即为米氏常数,V max为最大反应速度*如上式表示,米氏常数是反应速度为最大值的一半时的底物浓度,因此,米氏常数的单位为mol/L。
当反应速度等于最大速度一半时,即V = 1/2 V max, K m = [S]*吸光度表示不同底物浓度时的酶反应速度。
以吸光度的倒数作纵坐标,以底物浓度的倒数作横坐标,按Lineweaver-Burk作图法可求出Km 值。
二. 器材721分光光度计台式离心机恒温水浴锅微量移液器托盘天平匀浆器试管三. 试剂1. 0.5mol/L醋酸镁溶液称取醋酸镁 5.3625g溶于蒸馏水中,稀释至50ml.2. 0.1mol/L醋酸钠溶液称取醋酸钠0.0820g溶于蒸馏水中,稀释至10ml.3. 0.01mol/L醋酸镁---醋酸钠溶液取0.5mol/L醋酸镁溶液2ml及0.1mol/L醋酸钠溶溶液10ml,混合均匀后加蒸馏水稀释至100ml.4. 丙酮(分析纯).5. 95%乙醇(分析纯).6. Tris缓冲液(Ph8.8) 称取Tris 6.05g,用蒸馏水溶解成50ml,为0.1mol/L Tris液,取0.1mol/L Tris液10ml,加0.5mol/L 醋酸镁2ml,加蒸馏水80ml,再用1%醋酸调pH至8.8,然后用蒸馏水稀释至100ml.7. 0.01mol/L基质液称取磷酸苯二钠(C6H5PO4Na2.2H2o) 0.3g,4-氨基安替比林0.15g,分别溶于煮沸冷却后的蒸馏水中;两液混合并蒸馏水稀释至50ml,加0.2ml氯仿防腐,盛于棕色瓶中,冰箱内保存,可用一星期; 临用时与等量0.1mol/L pH10的碳酸盐缓冲液混合即可.8. 0.1mol/L pH10的碳酸盐缓冲液称取无水碳酸钠0.318g 及碳酸氢钠0.168g溶于蒸馏水,稀释至50ml.9. 碱性溶液量取0.5mol/L氢氧化钠溶液与0.5mol/L碳酸氢钠溶液各20ml,混合后加蒸馏水至100ml.10. 0.5%铁氰化钾溶液称取铁氰化钾0.25g和硼酸0.75g,各溶于20ml蒸馏水中,溶解后两液混合均匀,再加蒸馏水至50ml,置棕色瓶中暗处保存.11. 0.1mol/L醋酸镁溶液称取醋酸镁0.2145g溶于蒸馏水中,稀释至10ml.12. 酚标准液(0.1mg/ml).四.实验步骤(1). “碱性磷酸酶分离纯化”实验操作。




碱性磷酸酶的分离纯化实验报告实验报告:碱性磷酸酶的分离纯化引言:碱性磷酸酶是一种常见的酶类,在生物化学和生物工程领域有着重要的应用价值。
分离纯化碱性磷酸酶可以有效地提高其催化活性,从而更好地满足利用需求。
本实验旨在通过分离纯化的方法获得高纯度的碱性磷酸酶。
材料与方法:材料:1. 含有碱性磷酸酶的混合酶液;2. DEAE-纤维素离子交换柱;3. 带有荧光物质的酶学百科试剂盒;4. 透析膜。
方法:1. 将50 mL含有碱性磷酸酶的混合酶液,通过DEAE-纤维素离子交换柱进行分离纯化;2. 用PBS缓冲液洗涤纤维素柱,收集洗脱液以及洗脱后的洗脱液,测定酶活力;3. 分别将洗脱后的洗脱液和洗脱液透析入PBS缓冲液中;4. 用带有荧光物质的酶学百科试剂盒测定样品的酶活力。
结果:样品中碱性磷酸酶的活性经过分离纯化后得到了提高,相对活性提高了3倍以上。
同时,样品纯度也有了显著的提高。
分析和讨论:本实验通过离子交换柱和透析膜的方法,成功地分离和纯化了碱性磷酸酶。
实验中使用的DEAE-纤维素离子交换柱是一种较为成熟且常见的方法,具有操作简单、精度高等特点。
透析膜则可以更为彻底地去除不需要的杂质,进一步提高受体的纯度。
在实验结果中,我们发现酶的相对活性得以提高,这说明经过纯化后酶的质量得到了提高,可以进行更好地应用。
但同时,这样的分离纯化也存在一定的局限性,如纯度并没有达到100%,仍存在需进一步提高的空间。
结论:本实验成功地纯化和分离了碱性磷酸酶,提高了其相对活性,获得了具有实际应用需求的高纯度酶样品。
同时,在实际应用过程中,需要根据需求进行更为严格的纯化和分离,以满足更加精细化的需求。

碱性磷酸酶提取分离纯化碱性磷酸酶、广泛存在于微生物界和动物界,碱性磷酸酶几乎能催化所有磷酸单酯的水解反应,产生无机磷酸和相应的醇、酚或糖。
他也可以催化磷酸基团的转移反应。
磷酸基团从磷酸酯转移到醇、酚或糖等磷酸受体上。
碱性磷酸酶(AKP或ALP)是一种底物特异性较低,在碱性条件下能水解多重磷酸单酯化合物的酶,需要镁和锰离子为激活剂,AKP具有磷酸基团转移活性能将底物中的磷酸基团转移到另一个含有氢基的接受体上,如磷酸基团的接受体是水,则其作用就是水解。
•KP最适合PH范围为8.6-10,动物中AKP主要存在于小肠粘膜、肾、骨骼、肝脏和胎盘等组织的细胞膜上。
血清AKP主要来自肝,小部分来自骨骼。
AKP可从组织中分离纯化,也可以采用基因工程表达的方式获得:将碱性磷酸酶基因克隆到重组载体,转入宿主菌中进行重组表达,从表达菌提取,并进行动力学分析。
分离纯化:1、取1g新鲜的兔肝至于70℃冰箱内进行预先冷冻处理后取出,至于玻璃匀浆器内。
加入0.01mo1/L醋酸镁、0.01mo1/L醋酸钠混合溶液3mL,充分研磨至糊状。
2、将匀浆液倒入刻度离心管中,使用4ml、0.01mo1/L醋酸镁、0.01mo1/L醋酸钠混合溶液冲洗研磨器具,将冲洗液一并转入离心管内,离心管一定要置于冰块保护下,以后各个步骤也要注意保持低温。
3、加1mL正丁醇与匀浆原液中,使用玻璃棒充分搅匀,放置冰浴中2min。
使用滤纸过滤,过滤置于另一支刻度离心管中,过滤液也需要冰块保护。
4、滤液中加入等体积的冷丙酮,立即混匀后离心、2000r/min5min,弃去上清液,在沉淀中加入0.5mol/L醋酸镁2mL用玻璃棒充分搅拌使其溶解。
5、向沉淀中加入4.0mL0.5mol/L醋酸镁溶液,充分搅拌使其溶解。
同时记录悬液体积向上清液中加入95%冷乙醇,使乙醇浓度到达60%,混匀后立刻离心5min(2500r/min),弃上清液。
6、向沉淀中加入4.0ml 0.01mol/L醋酸镁一0.01mol/L酸钠溶液,充分搅拌,使其溶解。

酶工程实验内容实验一碱性磷酸酶的分离纯化一、实验目的1.掌握酶分离纯化的一般步骤及相关原理2.悉碱性磷酸酶的分离纯化的方法步骤。
二、实验原理本实验采用有机溶剂沉淀法从肝匀桨中分离纯化碱性磷酸酶简称AKP。
先用低浓度醋酸钠低渗破模作用制备肝匀浆。
醋酸镁则有保护和稳定AKP 的作用。
匀浆中加入正丁醇可使部分杂蛋白变性释出膜中酶过滤后以去除杂蛋白。
含有AKP 的滤液用冷丙酮和冷乙酸进行重复分离纯化。
根据AKP 在33的丙酮或30的乙醇中溶解而在50的丙酮或60的乙酸中不溶解的性质用冷丙酮和冷乙醇重复分离提取可从含有AKP 的滤液中获得较为纯净的碱性磷酸酶。
三、仪器、原料与试剂仪器移液管、量筒、玻璃勺浆器管、剪刀、离心机、新华定性滤纸。
原料新鲜兔肝试剂 1. 0.5mol/L 醋酸镁溶液107.25g 醋酸镁溶于蒸馏水中定容至1000 m1。
2. 0.1mol/L 醋酸钠溶液8.2g 醋酸钠溶于蒸馏水中定容至1000 m1 3. 0.0lmol/L 醋酸镁一0.01mol/L 酸酸钠溶液准确吸取20mL 0.5mol/L 醋酸镁溶液及100mL0.14mol/L 醋酸钠溶液混匀后定容至1000 m1。
4. Tris—HCl pH8.8缓冲液称取三羟甲基氨基甲烷12.1g用蒸馏水溶解后定容至1000mL即为0.1mol/LTrls 溶液。
取100m10.1mol/LTrls 溶液加蒸馏水约780mL再加0.1mol/L 醋酸镁溶液100m1混匀后用1冰醋酸调pH 为8.8用蒸馏水定容至l000m1。
5. 正丁醇、丙酮、95乙醇均为分析纯试剂。
四、实验操作分离纯化碱性磷酸酶的操作流程如下以下操作均在0-4℃进行将分离提取的碱性磷酸分装成2ml瓶冰冻干燥保存或液体保存也可但均置于-60℃低温冰箱保存。
应用时稀释5—7倍测其Km值。
实验二碱性磷酸酶的动力学鉴定——Km测定一、原理当温度、PH及酶浓度恒定的条件下酶促反应的初速度随作用物浓度S增大而增大但增大到一定限度时作用物浓度再增加则反应速度不再增加。

#### 一、实验背景碱性磷酸酶(Alkaline Phosphatase,AKP)是一种广泛存在于生物体内的酶,具有在碱性条件下水解多种磷酸酯底物的能力。
AKP在生物体内参与多种生理和代谢过程,如钙磷代谢、细胞信号转导等。
本研究旨在通过实验手段对AKP进行分离纯化,并对其性质进行初步探讨。
#### 二、实验材料与仪器1. 材料:- 兔肝匀浆液- 丙酮、乙醇、正丁醇、硫酸铵等有机溶剂- DEAE-Sepharose FF、Sephacryl S-200等层析介质- SDS-PAGE电泳试剂- 蛋白质分子量标准品- 碱性磷酸酶底物及检测试剂2. 仪器:- 高速离心机- 紫外可见光分光光度计- 凝胶成像系统- 层析柱- 电泳槽- 移液器#### 三、实验方法1. 碱性磷酸酶的提取:- 将兔肝匀浆液用4℃预冷的丙酮沉淀,于4℃条件下静置2小时。
- 12,000 r/min离心30分钟,收集沉淀。
- 将沉淀用少量水溶解,加入硫酸铵至饱和,于4℃条件下静置2小时。
- 12,000 r/min离心30分钟,收集沉淀。
- 将沉淀用少量水溶解,加入正丁醇,于4℃条件下静置2小时。
- 12,000 r/min离心30分钟,收集含有碱性磷酸酶的上清液。
2. 碱性磷酸酶的纯化:- 将上清液用DEAE-Sepharose FF层析柱进行阴离子交换层析。
- 以磷酸盐缓冲液为洗脱液,收集碱性磷酸酶活性峰。
- 将活性峰用Sephacryl S-200分子筛层析柱进行分子筛层析。
- 以磷酸盐缓冲液为洗脱液,收集碱性磷酸酶活性峰。
3. 碱性磷酸酶的鉴定:- 将纯化后的碱性磷酸酶进行SDS-PAGE电泳,与蛋白质分子量标准品进行对比,确定其分子量。
- 利用紫外可见光分光光度计测定碱性磷酸酶的吸光度,计算其浓度。
4. 碱性磷酸酶的性质研究:- 通过酶活性测定,探讨碱性磷酸酶的最适pH值、最适温度等性质。
#### 四、实验结果1. 分离纯化结果:- 经过上述实验步骤,从兔肝匀浆液中成功提取并纯化了碱性磷酸酶。

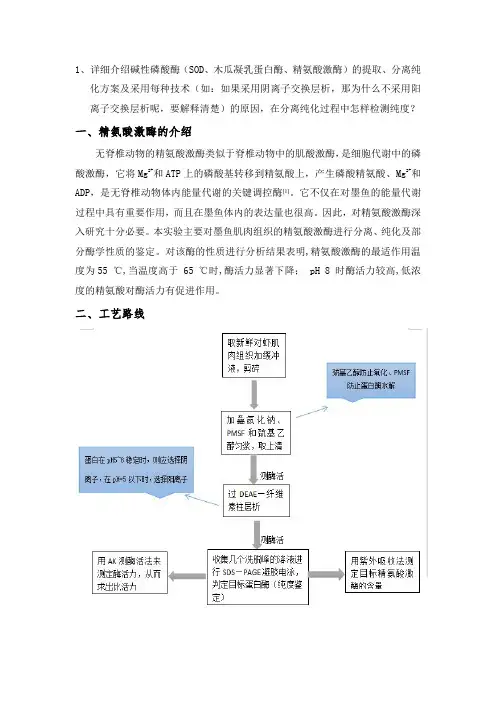
1、详细介绍碱性磷酸酶(SOD、木瓜凝乳蛋白酶、精氨酸激酶)的提取、分离纯化方案及采用每种技术(如:如果采用阴离子交换层析,那为什么不采用阳离子交换层析呢,要解释清楚)的原因,在分离纯化过程中怎样检测纯度?一、精氨酸激酶的介绍无脊椎动物的精氨酸激酶类似于脊椎动物中的肌酸激酶,是细胞代谢中的磷酸激酶,它将Mg2+和ATP上的磷酸基转移到精氨酸上,产生磷酸精氨酸、Mg2+和ADP,是无脊椎动物体内能量代谢的关键调控酶[1]。
它不仅在对墨鱼的能量代谢过程中具有重要作用,而且在墨鱼体内的表达量也很高。
因此,对精氨酸激酶深入研究十分必要。
本实验主要对墨鱼肌肉组织的精氨酸激酶进行分离、纯化及部分酶学性质的鉴定。
对该酶的性质进行分析结果表明,精氨酸激酶的最适作用温度为55℃,当温度高于65℃时,酶活力显著下降;pH8时酶活力较高,低浓度的精氨酸对酶活力有促进作用。
二、工艺路线三、研究内容与方案1.对虾精氨酸激酶的提取、分离取10g于-20℃贮存的新鲜对虾肌肉,高速组织捣碎机2000r·min-1匀浆5min,加入40mL预冷的缓冲液A(0.1mmol·L-1Tris-HCl,10mmo l·L-1巯基乙醇,5mmol·L-1叠氮化钠,20mmo l·L-1苯甲基磺酰氟(PMSF),pH8.0),搅拌均匀,把悬液放置于预冷的离心管中,4℃,5000×g离心20min后保存上清。
*选择使用巯基乙醇和PMSF的原因:巯基乙醇可以防止蛋白酶在分离提取过程中的氧化、PMSF是蛋白酶抑制剂,可以防止蛋白酶水解*注意事项该步骤完成后,要对粗酶液进行酶活力的测定2.对虾精氨酸激酶的纯化1)DEAE-纤维素柱层析装柱直接取商品DEAE cellulose DE-52装柱(2.5x40cm)装柱前,先在柱中加入一定量的层析柱平衡液(约10cm高),然后倒入凝胶,打开柱底部的出口,使其自然沉降,当柱中形成明显分界面时,放入两层大小合适的滤纸片与凝胶顶部,接上恒流泵,流速选用2.5ml/min,当柱不再进一步压缩时,保持柱顶部缓冲液1-2cm高[4]。
碱性磷酸酶的提取分离和比活力的测定项目名称碱性磷酸酶的提取分离和比活力的测定xinpingzhao@实验目的1. 了解酶提取纯化的基本实验技术;2. 掌握碱性磷酸酶酶活力及比活力的测定方法实验材料新鲜兔肝或兔肾主要仪器设备匀浆器,冷冻离心机,分光光度计,电子天平等.实验原理碱性磷酸酶(简称AKP)在磷酸盐代谢中起重要作用。
核酸序列分析、DNA重组技术、酶标免疫检测技术以及临床检验中都需要利用此酶。
本实验取材于兔肝,经匀浆、正丁醇抽提、硫酸胺分段盐析或者有机溶剂沉淀,获得碱性磷酸酶制品。
本实验采用对硝基苯磷酸二钠(p-NPP)为底物的方法测定酶活。
对硝基苯磷酸二钠在碱性磷酸酶的作用下被水解为游离磷酸及对硝基苯酚,对硝基苯酚在强碱性条件下显示亮黄色,在405nm处有强烈的吸收峰。
因此可以测定405nm处的吸收值A405nm来计算产物的生成量,从而计算出酶活力,然后通过各级纯化步骤产物蛋白含量的测定,从而计算出酶的比活力.第一部分: 碱性磷酸酶的提取以下操作均在4℃进行。
方案一:1. 称取新鲜兔肝2g,剪碎后,置于玻璃匀浆器中,按1:2(m/v)加入预冷的0.05mol/LTris-HCl (pH9.0)缓冲液,匀浆后4℃抽提20 min;4℃,8000r/min离心10min;取上清;此为A 液。
另取1支试管编号为A,取0.1mLA 液,加1.9mLTris缓冲液(pH 8.8),混匀,供测酶活性用。
2.上清液中加入1/5体积预冷正丁醇脱脂20min;8000r/min离心10min,取上清;此为B液。
吸取0.1m1B 液,置于编号为B 的试管中,加入1.9m1Tris 缓冲液(pH 8.8),供测酶活用。
3.加入硫酸铵至35%饱和度;4℃30 min;8000r/min离心10min,弃沉淀;取上清;此为C 液。
吸取C 液0.2m1置于编号为c 的试管中,加入1.8m1Tris 缓冲液(PH 8.8),供测酶活性用4.然后在上清液中加入硫酸铵至75%饱和度,4℃静置30 min后8000r/min离心10min,得沉淀..用0.05mol/LTris-HCl(pH9.0)缓冲液溶解沉淀;此为D 液。
碱性磷酸酶的提取分离和比活力的测定碱性磷酸酶是一种广泛存在于生物体内的酶,能够催化酸性环境下的磷酸酯水解反应,在多种生理过程中发挥重要作用。
其提取分离和比活力的测定具有重要的科学研究价值和应用前景。
一、碱性磷酸酶的提取分离1、组织样品制备将待提取的组织放入离心管中,加入磷酸盐缓冲液(pH 7.4),用高速离心离心3-5分钟,去除上清液并加入1mL磷酸盐缓冲液,在实验台上加入玻璃珠或石英砂,放入冰箱冷冻器中。
2、细胞裂解将组织经过粉碎的样品加入磷酸盐缓冲液(pH 7.4),放入研钵中,加入冰冷甲醇,研磨5-10分钟。
将打磨液离心分离,上清液用分液漏斗收集,加入等量的0.1mol/L四乙基铵溶液,静置20分钟,收集上清液并加入2.5%聚乙烯醇。
3、沉淀和提取将沉淀后的样品中加入氯仿等有机溶剂,轻微摇动,分离出沉淀,将上清液倒入烧瓶中,并用氯仿洗涤,收集洗涤液后将其合并,加入甲醇进行沉淀,离心分离,去除上清液,加入2-3倍体积的丙酮,静置反复冲洗多次。
将沉淀中加入适量的溶解液,摇混均匀,转移至离心管中,并用离心机转速2800r/min/5 min。
二、碱性磷酸酶的比活力测定1、酶活性试验体系将提取分离后的活性酶样品用注射器加入已配制好的酶活性试验体系中,包括10mM Tris-HCl缓冲液(pH 8.0)、1 mM EDTA缓冲液、2 mM酚酞液、0.1M NaCl等,总体积为2ml。
2、样品处理制备所需要的各种试剂和标准品,并制备好标准品不同浓度的稀释液。
将稀释后的酶样品取1ml,加入酶活性试验体系中,并在无酶样品控制下,以相同的温度下逐渐加入不同的底物溶液,如α-萘酚磷酸钠。
注意不要影响反应溶液 pH 值和终点的颜色产生,以免误诊。
3、反应终止在反应末期,可以加入固定量的0.1N NaOH终止反应,并使用p-酚酸作为对照品和标准品进行比较或质控,并测定比活力。
综上所述,选择合适的方法提取分离和测定碱性磷酸酶的比活力对于进一步探究其在生理过程中的作用机制以及相关疾病的诊断和治疗等方面具有重要的意义。
碱性磷酸酶的分离纯化及比活性与米氏常数测定一、实验原理(1).碱性磷酸酶的分离纯化1. 机械破碎法制备肝匀浆低浓度乙酸钠:低渗破膜低浓度乙酸镁:保护和稳定AKP2.有机溶剂沉淀法分离纯化AKP加入不同有机溶剂重复离心正丁醇:沉淀部分除AKP的蛋白质33%丙酮、30%乙醇:溶解AKP50%丙酮、60%乙醇:沉淀AKP(2).比活性测定1.比活性的定义*单位重量的蛋白质样品中所含的酶活性单位。
*通常用每毫克蛋白质具有的酶活性单位来表示。
*用以鉴定酶的纯化程度,是酶分离提纯完成的评价指标之一。
2.测定样品的比活性必须测定:*每毫升样品中的酶活性单位数。
*每毫升样品中的蛋白质毫克数。
3.磷酸苯二钠法测定碱性磷酸酶活性反应原理(3).米氏常数测定K m 即为米氏常数,V max为最大反应速度*如上式表示,米氏常数是反应速度为最大值的一半时的底物浓度,因此,米氏常数的单位为mol/L。
当反应速度等于最大速度一半时,即V= 1/2 V max, K m = [S]*吸光度表示不同底物浓度时的酶反应速度。
以吸光度的倒数作纵坐标,以底物浓度的倒数作横坐标,按Lineweaver-Burk作图法可求出Km值。
二. 器材721分光光度计台式离心机恒温水浴锅微量移液器托盘天平匀浆器试管三. 试剂1. 0.5mol/L醋酸镁溶液称取醋酸镁5.3625g溶于蒸馏水中,稀释至50ml.2. 0.1mol/L醋酸钠溶液称取醋酸钠0.0820g溶于蒸馏水中,稀释至10ml.3. 0.01mol/L醋酸镁---醋酸钠溶液取0.5mol/L醋酸镁溶液2ml及0.1mol/L醋酸钠溶溶液10ml,混合均匀后加蒸馏水稀释至100ml.4. 丙酮(分析纯).5. 95%乙醇(分析纯).6. Tris缓冲液(Ph8.8) 称取Tris 6.05g,用蒸馏水溶解成50ml,为0.1mol/L Tris液,取0.1mol/L Tris液10ml,加0.5mol/L醋酸镁2ml,加蒸馏水80ml,再用1%醋酸调pH至8.8,然后用蒸馏水稀释至100ml.7. 0.01mol/L基质液称取磷酸苯二钠(C6H5PO4Na2.2H2o) 0.3g,4-氨基安替比林0.15g,分别溶于煮沸冷却后的蒸馏水中;两液混合并蒸馏水稀释至50ml,加0.2ml氯仿防腐,盛于棕色瓶中,冰箱内保存,可用一星期; 临用时与等量0.1mol/L pH10的碳酸盐缓冲液混合即可.8. 0.1mol/L pH10的碳酸盐缓冲液称取无水碳酸钠0.318g及碳酸氢钠0.168g溶于蒸馏水,稀释至50ml.9. 碱性溶液量取0.5mol/L氢氧化钠溶液与0.5mol/L碳酸氢钠溶液各20ml,混合后加蒸馏水至100ml.10. 0.5%铁氰化钾溶液称取铁氰化钾0.25g和硼酸0.75g,各溶于20ml蒸馏水中,溶解后两液混合均匀,再加蒸馏水至50ml,置棕色瓶中暗处保存.11. 0.1mol/L醋酸镁溶液称取醋酸镁0.2145g溶于蒸馏水中,稀释至10ml.12. 酚标准液(0.1mg/ml).四.实验步骤(1). “碱性磷酸酶分离纯化”实验操作。