碱性磷酸酶的分离纯化-袁野
- 格式:ppt
- 大小:420.50 KB
- 文档页数:10


碱性磷酸酶的分离纯化与酶学性质研究董静 201131301031摘要:以猪肝为原料,采用低浓度醋酸钠(低渗破膜作用)制备肝匀浆,醋酸镁则有保护和稳定AKP 的作用,匀浆中加入正丁醇可使部分杂蛋白变性,释出膜中酶,过滤后,以去除杂蛋白。
含有AKP 的滤液用冷丙酮和冷乙酸进行重复分离纯化。
根据AKP 在33%的丙酮或30%的乙醇中溶解,而在50%的丙酮或60%的乙酸中不溶解的性质,用冷丙酮和冷乙醇重复分离提取,可从含有AKP 的滤液中获得较为纯净的碱性磷酸酶。
酶学性质研究表明该酶催化对磷酸苯二钠水解反应的最适PH值为10.0,最适温度为37℃,米氏常数值Km为3.154mmol/L,酶的热稳定性研究表明该酶在pH在8-9区间和温度在25℃-37℃区间下稳定。
关键字:碱性磷酸酶分离纯化热稳定性酸碱稳定性碱性磷酸酶(Alkalinephosphatase,EC3.1.3.1,简称AKP)广泛存在于微生物界和动物界,它在动物机体的骨化过程中及在磷化物和其他一些营养物质的消化、吸收和转运过程中起着重要作用。
此外,通过催化磷蛋白的水解,碱性磷酸酶在细胞调节过程中也具有一定的作用。
它可专一性的水解磷酸单酯化合物而释放无机磷,主要用于核酸研究,分析、测定核苷酸顺序及其基团的重组、分离,也是酶标免疫测定技术的常用工具酶之一。
药用化妆品中添加碱性磷酸酶有益于皮肤细胞的再生和新陈代谢,还可用于核苷酸脱磷产生核苷等。
它是一种膜结合蛋白,在生物体内直接参与磷酸基团的转移和代谢等生理过程[1]。
临床上通过测定AKP的活力,可作为诊断骨骼及肝脏疾病的重要生化指标。
因此纯化和研究AKP的性质、调控等有重要意义。
本实验尝试以猪肝为材料,分离纯化猪肝碱性磷酸酶,研究其酶学性质,旨在探讨以猪肝研制科研用碱性磷酸酶生化试剂的方法,同时也为进一步的深入研究该酶提供理论上的参考。
此外,猪肝来源广泛,价格便宜,可以作为生产碱性磷酸酶生化试剂的原料[2-3]。


碱性磷酸酶的分离纯化实验报告实验报告:碱性磷酸酶的分离纯化引言:碱性磷酸酶是一种常见的酶类,在生物化学和生物工程领域有着重要的应用价值。
分离纯化碱性磷酸酶可以有效地提高其催化活性,从而更好地满足利用需求。
本实验旨在通过分离纯化的方法获得高纯度的碱性磷酸酶。
材料与方法:材料:1. 含有碱性磷酸酶的混合酶液;2. DEAE-纤维素离子交换柱;3. 带有荧光物质的酶学百科试剂盒;4. 透析膜。
方法:1. 将50 mL含有碱性磷酸酶的混合酶液,通过DEAE-纤维素离子交换柱进行分离纯化;2. 用PBS缓冲液洗涤纤维素柱,收集洗脱液以及洗脱后的洗脱液,测定酶活力;3. 分别将洗脱后的洗脱液和洗脱液透析入PBS缓冲液中;4. 用带有荧光物质的酶学百科试剂盒测定样品的酶活力。
结果:样品中碱性磷酸酶的活性经过分离纯化后得到了提高,相对活性提高了3倍以上。
同时,样品纯度也有了显著的提高。
分析和讨论:本实验通过离子交换柱和透析膜的方法,成功地分离和纯化了碱性磷酸酶。
实验中使用的DEAE-纤维素离子交换柱是一种较为成熟且常见的方法,具有操作简单、精度高等特点。
透析膜则可以更为彻底地去除不需要的杂质,进一步提高受体的纯度。
在实验结果中,我们发现酶的相对活性得以提高,这说明经过纯化后酶的质量得到了提高,可以进行更好地应用。
但同时,这样的分离纯化也存在一定的局限性,如纯度并没有达到100%,仍存在需进一步提高的空间。
结论:本实验成功地纯化和分离了碱性磷酸酶,提高了其相对活性,获得了具有实际应用需求的高纯度酶样品。
同时,在实际应用过程中,需要根据需求进行更为严格的纯化和分离,以满足更加精细化的需求。




酶工程实验内容实验一碱性磷酸酶的分离纯化一、实验目的1.掌握酶分离纯化的一般步骤及相关原理2.悉碱性磷酸酶的分离纯化的方法步骤。
二、实验原理本实验采用有机溶剂沉淀法从肝匀桨中分离纯化碱性磷酸酶简称AKP。
先用低浓度醋酸钠低渗破模作用制备肝匀浆。
醋酸镁则有保护和稳定AKP 的作用。
匀浆中加入正丁醇可使部分杂蛋白变性释出膜中酶过滤后以去除杂蛋白。
含有AKP 的滤液用冷丙酮和冷乙酸进行重复分离纯化。
根据AKP 在33的丙酮或30的乙醇中溶解而在50的丙酮或60的乙酸中不溶解的性质用冷丙酮和冷乙醇重复分离提取可从含有AKP 的滤液中获得较为纯净的碱性磷酸酶。
三、仪器、原料与试剂仪器移液管、量筒、玻璃勺浆器管、剪刀、离心机、新华定性滤纸。
原料新鲜兔肝试剂 1. 0.5mol/L 醋酸镁溶液107.25g 醋酸镁溶于蒸馏水中定容至1000 m1。
2. 0.1mol/L 醋酸钠溶液8.2g 醋酸钠溶于蒸馏水中定容至1000 m1 3. 0.0lmol/L 醋酸镁一0.01mol/L 酸酸钠溶液准确吸取20mL 0.5mol/L 醋酸镁溶液及100mL0.14mol/L 醋酸钠溶液混匀后定容至1000 m1。
4. Tris—HCl pH8.8缓冲液称取三羟甲基氨基甲烷12.1g用蒸馏水溶解后定容至1000mL即为0.1mol/LTrls 溶液。
取100m10.1mol/LTrls 溶液加蒸馏水约780mL再加0.1mol/L 醋酸镁溶液100m1混匀后用1冰醋酸调pH 为8.8用蒸馏水定容至l000m1。
5. 正丁醇、丙酮、95乙醇均为分析纯试剂。
四、实验操作分离纯化碱性磷酸酶的操作流程如下以下操作均在0-4℃进行将分离提取的碱性磷酸分装成2ml瓶冰冻干燥保存或液体保存也可但均置于-60℃低温冰箱保存。
应用时稀释5—7倍测其Km值。
实验二碱性磷酸酶的动力学鉴定——Km测定一、原理当温度、PH及酶浓度恒定的条件下酶促反应的初速度随作用物浓度S增大而增大但增大到一定限度时作用物浓度再增加则反应速度不再增加。

碱性磷酸酶的分离纯化及比活性与米氏常数测定一、实验原理(1).碱性磷酸酶的分离纯化1.机械破碎法制备肝匀浆低浓度乙酸钠:低渗破膜低浓度乙酸镁:保护和稳定AKP2.有机溶剂沉淀法分离纯化AKP加入不同有机溶剂重复离心正丁醇:沉淀部分除AKP的蛋白质33%丙酮、30%乙醇:溶解AKP50%丙酮、60%乙醇:沉淀AKP(2).比活性测定1.比活性的定义*单位重量的蛋白质样品中所含的酶活性单位。
*通常用每毫克蛋白质具有的酶活性单位来表示。
*用以鉴定酶的纯化程度,是酶分离提纯完成的评价指标之一。
2.测定样品的比活性必须测定:*每毫升样品中的酶活性单位数。
*每毫升样品中的蛋白质毫克数。
3.磷酸苯二钠法测定碱性磷酸酶活性反应原理(3).米氏常数测定K m即为米氏常数,V max为最大反应速度*如上式表示,米氏常数是反应速度为最大值的一半时的底物浓度,因此,米氏常数的单位为mol/L。
当反应速度等于最大速度一半时,即V = 1/2 V max, K m = [S]*吸光度表示不同底物浓度时的酶反应速度。
以吸光度的倒数作纵坐标,以底物浓度的倒数作横坐标,按Lineweaver-Burk作图法可求出Km值。
二. 器材721分光光度计台式离心机恒温水浴锅微量移液器托盘天平匀浆器试管三.试剂1. 0.5mol/L醋酸镁溶液称取醋酸镁5.3625g溶于蒸馏水中,稀释至50ml.2. 0.1mol/L醋酸钠溶液称取醋酸钠0.0820g溶于蒸馏水中,稀释至10ml.3. 0.01mol/L醋酸镁---醋酸钠溶液取0.5mol/L醋酸镁溶液2ml及0.1mol/L醋酸钠溶溶液10ml,混合均匀后加蒸馏水稀释至100ml.4. 丙酮(分析纯).5. 95%乙醇(分析纯).6. Tris缓冲液(Ph8.8) 称取Tris 6.05g,用蒸馏水溶解成50ml,为0.1mol/L Tris 液,取0.1mol/L Tris液10ml,加0.5mol/L醋酸镁2ml,加蒸馏水80ml,再用1%醋酸调pH至8.8,然后用蒸馏水稀释至100ml.7. 0.01mol/L基质液称取磷酸苯二钠(C6H5PO4Na2.2H2o)0.3g,4-氨基安替比林0.15g,分别溶于煮沸冷却后的蒸馏水中;两液混合并蒸馏水稀释至50ml,加0.2ml氯仿防腐,盛于棕色瓶中,冰箱内保存,可用一星期;临用时与等量0.1mol/L pH10的碳酸盐缓冲液混合即可.8. 0.1mol/L pH10的碳酸盐缓冲液称取无水碳酸钠0.318g及碳酸氢钠0.168g溶于蒸馏水,稀释至50ml.9. 碱性溶液量取0.5mol/L氢氧化钠溶液与0.5mol/L碳酸氢钠溶液各20ml,混合后加蒸馏水至100ml.10. 0.5%铁氰化钾溶液称取铁氰化钾0.25g和硼酸0.75g,各溶于20ml蒸馏水中,溶解后两液混合均匀,再加蒸馏水至50ml,置棕色瓶中暗处保存.11. 0.1mol/L醋酸镁溶液称取醋酸镁0.2145g溶于蒸馏水中,稀释至10ml.12. 酚标准液(0.1mg/ml).四.实验步骤(1). “碱性磷酸酶分离纯化”实验操作(2).“碱性磷酸酶比活性测定”实验操作1.样品中碱性磷酸酶活性测定:(1).取5支试管,编号,按表1操作:表1A’B’C’D’标准空白各阶段稀释液(ml) 0.1 0.1 0.1 0.1 - -0.1mg/ml酚标准液(ml) - -- - 0.1 -pH8.8Tris缓冲液(ml) - - - - - 0.1置37℃水浴中保温5分钟复合基质液(ml) 3.0 3.0 3.0 3.0 3.0 3.0混匀,37℃水浴中准确保温15分钟.保温结束后,各管立即加入1.0ml碱性溶液终止反应,再加入0.5%铁氰化物钾2.0ml,立即混匀,静置10min,在510nm波长下比色测定.2.酶活性单位计算每毫升酶液中酶活性单位=测定OD/标准OD X标准管中酚含量X1/0.1X稀释倍数3.样品中蛋白质含量的测定(1)测定蛋白质时,保留的A’管还需稀释5倍为A’’管,否则蛋白质浓度太高,其余各管不需再稀释,各用1.0ml进行测定.表2A’’B’C’D’空白各阶段稀释液(ml) 1.01.01.01.0 -0.1mg/ml酚标准液(ml) - -- -1.0pH8.8Tris缓冲液(ml) 5.0 5.0 5.0 5.0 5.0混匀,置20~25℃水浴中保温10分钟复合基质液(ml) 0.50.50.50.50.5(2)立即振摇均匀,在20~25℃保温30min后,于650nm波长处比色.(3)蛋白质浓度计算:从Lowry法标准曲线查得的蛋白质毫克数,乘以稀释倍数,即为每毫升样品中蛋白质毫克数.4.比活性及得率计算碱性磷酸酶比活性=每毫升样品中碱性磷酸酶活性单位数/每毫升样品中蛋白质毫克数纯化倍数=各阶段比活性数/匀浆(A液)比活性数得率=各阶段酶的总活性单位/匀浆(A液)中的酶的总活性单位X100%5.实验结果将上述各实验计算结果填入表3内.表3分离总体积蛋白质总蛋白每毫升酶总活性比活性纯化得率阶段(ml) 浓度(mg) 活性单位单位(U/mg ) 倍数(%)(mg/ml) (U/ml) (U)匀浆(A液)第一次丙酮沉淀(B液)第二次丙酮沉淀(C液)第三次丙酮沉淀(D液)3.米氏常数测定1. 取15只试管,按照下表操作,1~7号重复两组,0 号为空白对照。

1、详细介绍碱性磷酸酶(SOD、木瓜凝乳蛋白酶、精氨酸激酶)的提取、分离纯化方案及采用每种技术(如:如果采用阴离子交换层析,那为什么不采用阳离子交换层析呢,要解释清楚)的原因,在分离纯化过程中怎样检测纯度?一、精氨酸激酶的介绍无脊椎动物的精氨酸激酶类似于脊椎动物中的肌酸激酶,是细胞代谢中的磷酸激酶,它将Mg2+和ATP上的磷酸基转移到精氨酸上,产生磷酸精氨酸、Mg2+和ADP,是无脊椎动物体内能量代谢的关键调控酶[1]。
它不仅在对墨鱼的能量代谢过程中具有重要作用,而且在墨鱼体内的表达量也很高。
因此,对精氨酸激酶深入研究十分必要。
本实验主要对墨鱼肌肉组织的精氨酸激酶进行分离、纯化及部分酶学性质的鉴定。
对该酶的性质进行分析结果表明,精氨酸激酶的最适作用温度为55℃,当温度高于65℃时,酶活力显著下降;pH8时酶活力较高,低浓度的精氨酸对酶活力有促进作用。
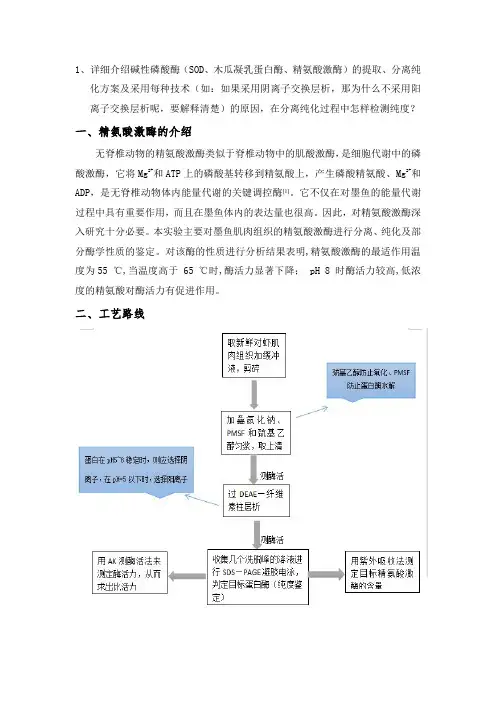
二、工艺路线三、研究内容与方案1.对虾精氨酸激酶的提取、分离取10g于-20℃贮存的新鲜对虾肌肉,高速组织捣碎机2000r·min-1匀浆5min,加入40mL预冷的缓冲液A(0.1mmol·L-1Tris-HCl,10mmo l·L-1巯基乙醇,5mmol·L-1叠氮化钠,20mmo l·L-1苯甲基磺酰氟(PMSF),pH8.0),搅拌均匀,把悬液放置于预冷的离心管中,4℃,5000×g离心20min后保存上清。
*选择使用巯基乙醇和PMSF的原因:巯基乙醇可以防止蛋白酶在分离提取过程中的氧化、PMSF是蛋白酶抑制剂,可以防止蛋白酶水解*注意事项该步骤完成后,要对粗酶液进行酶活力的测定2.对虾精氨酸激酶的纯化1)DEAE-纤维素柱层析装柱直接取商品DEAE cellulose DE-52装柱(2.5x40cm)装柱前,先在柱中加入一定量的层析柱平衡液(约10cm高),然后倒入凝胶,打开柱底部的出口,使其自然沉降,当柱中形成明显分界面时,放入两层大小合适的滤纸片与凝胶顶部,接上恒流泵,流速选用2.5ml/min,当柱不再进一步压缩时,保持柱顶部缓冲液1-2cm高[4]。
用不同的温度(20"C、30"C、35℃、40‘C、45"C、50"C)预处理上清液30min,然后用磷酸苯二钠比色法于37℃测试碱性磷酸酶活性。
2.1.3主要仪器冷冻离心机、恒温培养箱、电热恒温水浴锅、SC.15型数控超级恒温槽(宁波海曙天恒仪器厂)、PHS-3C型精密pH计(上海精科雷磁)、UV-9100型分光光度计C:ll:京瑞利分析仪器公司)、JY92-II型超声波细胞粉碎机(宁波新芝科器研究所)。
2.2结果与分析2.2.1碱性磷酸酶产生菌的微孔板初筛将自行分离的12株菌和已有的保存菌株20株共30株菌株用微孔板法初筛磷酸酶产生菌,试验结果见图2.1。
图2.1徽孔板法初筛磷酸酶产生菌Fig2.1IsolationthestrainCallproduceALPinmicroplate根据显色深浅可初步判断各菌株的磷酸酶活性,其由大到小依次为:HBI,1#,B7,衄10,3#,Lxy,31#,B31,HB2,33#,34#,BBll,B5,HB4,HB5,B1,4#,HB8,HB3,HB6,B3,B46,B45,HB9,HB7,髓12,B4,l—l,2#,Jial,062—2,B8。
故选取3株酶活较高的菌株进行进一步的试验。
2.2.2产酶菌株的复筛HBl,1#'B7三株菌的磷酸酶活力的测试结果见图2.2。
图中可见1#为产胞浙江大学硕士学位论文圈3.1菌株HBl时鞭毛(电镜40000×)ofstrianlmacellIithflagellaFig3.1Electronmicrographs3.2.2产酶苗株H81的生理生化特征产酶菌株}IBl在25.50"C生长好,其生理生化特征见表3.1。
表3.1菌株肿1与芽孢杆菌属种的表型特征比较坠坐苎!垡竺堕咝垒!塑堂_瞄坚墅垫墅!!坚鱼型!!坚墅试验项且鹏l且subtilisB,mcgarcriumB.5phaericm且cerewB.1icheniformis细胞直径>I.OBm一一+孢囊膨大一一一糖醇发酵:葡萄糖+++木耱一++甘露醇+++柠檬酸盐利用+++明胶水解+++淀粉水解一++VP试验一一硝酸盐还原+++吲哚试验一一一过氧化氢酶试验+++生长在7%NaCI中+++卵磷脂酶一一一42.949.9MoI%G+CofDN^48.g4L8-46.336.5一盯.434.0-40.03i.7—40.I+:positive;一:negative·3.2.3产酶苗株itBl的DNAG+c含量用Tm法测得菌株HBl的TⅢ值约为78.05,根据公式0.1ssc%G+c=51.2+2.08×(TmⅫ一TmⅫ#¨=)其nNA的G+C含量约为48.9%。
碱性磷酸酶的分离纯化与性质研究生物技术1101班其曼古丽·麦麦提2摘要:经过匀浆,正丁醇处理,凝胶过滤等步骤,从猪肝中部分纯化了碱性磷酸酶。
以磷酸苯二钠为底物,测得该酶的最适pH为10,最适温度为37℃,Km=1。
6565。
KH2PO4对酶的活性有不同程度的抑制作用。
关键词:猪肝,碱性磷酸酶,分离纯化,性质碱性磷酸酶(Alkalinephosphatase,简称AKP)是一种底物专一性较低的磷酸单酯酶,广泛存在于人体、动物、植物与微生物中,在生物体内直接参与了磷酸基团的转移和代谢过程【1】。
它在脊椎动物的骨化过程中发挥了重要作用【1】。
海洋中的甲壳动物锯缘青蟹体内的碱性磷酸酶是其赖以生长、生存的重要酶类之一,它对海水中钙质的吸收、磷酸钙的形成、甲壳素的形成与分泌都具有重要作用【2】。
提纯的碱性磷酸酶可用于核酸研究、毒物学研究及医学研究【3】。
由于有益于皮肤细胞的再生和新陈代谢,该酶还可添加到药用化妆品中【4】。
为了满足生产实践上的需要,仅国内以猪肝为材料来分离纯化碱性磷酸酶并对其性质进行分析的研究工作即已有若干.1。
1材料与方法1.1.1实验材料新鲜的猪肝脏.1。
1。
2试验仪器玻璃匀浆器,离心机,加样抢,恒温水浴锅。
1。
1.3试验试剂0。
5mol/L醋酸镁溶液;2,0.1mol/L醋酸钠;3,0。
01mol醋酸镁—0。
01mol/L 醋酸钠溶液;4,Tris—HClPH8。
8缓冲液;5,正丁醇;6,丙醇;7,95%乙醇;8,0.04mol/L作用物底物;9,0.1mol/L碳酸盐缓冲液(PH10。
0);10,碱性磷酸酶液;11,0.5mol/LNaOH溶液;12,0。
3%-氨基安替比林;13,0.5mol/L铁氰化钾;14,基质液,15,0.2m甘氨酸;16,0。
2NaOH;1。
1。
4试剂配制0。
5mol/L醋酸镁溶液:107.25g醋酸镁溶于蒸馏水中,定容至1000ml。
0.1mol 醋酸钠溶液:8.2g醋酸钠溶于蒸馏水中,定容至1000ml。
实验名称碱性磷酸酶的分离纯化、比活性测定与动力学分析实验日期2011年10月25号实验地点生化实验室合作者指导老师总分教师签名批改日期碱性磷酸酶(AKP或ALP)是一种底物特异性较低,在碱性条件下能水解多重磷酸单脂化合物的酶,需要镁和锰离子为激活剂。
AKP具有磷酸基团转移活性,能将底物中的磷酸基团转移到另一个含有羟基的接受体上,如磷酸基团的接受体是水,则其作用就是水解。
AKP最适PH范围为8.6-10,动物中AKP主要存在于小肠粘膜、肾、骨骼、肝脏和胎盘等组织的细胞膜上。
血清AKP主要来自肝,小部分来自骨骼。
AKP可从组织中分离纯化,也可以采用基因工程表达的方式获得:将碱性磷酸酶基因克隆到重组载体,转入宿主菌中进行重组表达,并从表达菌提取,并进行酶动力学分析。
一实验原理1、碱性磷酸酶的分离纯化AKP分离纯化的方法与一般蛋白质的分离纯化方法相似,常用中性盐盐析法、电泳法、色谱法、有机溶剂沉淀法等方法分离纯化。
有时需要多种方法配合使用,才能得到高纯度的酶蛋白。
本实验采用有机溶剂沉淀法从兔肝匀浆液中提取分离AKP。
正丁醇能使部分杂蛋白变性,过滤除去杂蛋白即为含有AKP的滤液,AKP能溶于终浓度为33%的丙酮或30%的乙醇中,而不溶于终浓度为50%的丙酮或60%的乙醇中,通过离心即可得到初步纯化的AKP。
2、碱性磷酸酶的比活性测定根据国际酶学委员会规定,酶的比活性用每毫克蛋白质具有的酶活性来表示,单位(U/mg•pr)来表示。
因此,测定样品的比活性必须测定:a每毫升样品中的蛋白质毫克数;b每毫升样品中的酶活性单位数。
酶的纯浓度越高酶的比活性也就越高。
本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。
酚在碱性条件下与4-氨基安替比作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。
于510nm 处比色,即可求出反应过程中产生的酚含量,而碱性磷酸酶的活性单位可定义为:在37摄氏度保温15min每产生1mg的酚为一个酶活性单位。
碱性磷酸酶的提取分离和比活力的测定项目名称碱性磷酸酶的提取分离和比活力的测定xinpingzhao@实验目的1. 了解酶提取纯化的基本实验技术;2. 掌握碱性磷酸酶酶活力及比活力的测定方法实验材料新鲜兔肝或兔肾主要仪器设备匀浆器,冷冻离心机,分光光度计,电子天平等.实验原理碱性磷酸酶(简称AKP)在磷酸盐代谢中起重要作用。
核酸序列分析、DNA重组技术、酶标免疫检测技术以及临床检验中都需要利用此酶。
本实验取材于兔肝,经匀浆、正丁醇抽提、硫酸胺分段盐析或者有机溶剂沉淀,获得碱性磷酸酶制品。
本实验采用对硝基苯磷酸二钠(p-NPP)为底物的方法测定酶活。
对硝基苯磷酸二钠在碱性磷酸酶的作用下被水解为游离磷酸及对硝基苯酚,对硝基苯酚在强碱性条件下显示亮黄色,在405nm处有强烈的吸收峰。
因此可以测定405nm处的吸收值A405nm来计算产物的生成量,从而计算出酶活力,然后通过各级纯化步骤产物蛋白含量的测定,从而计算出酶的比活力.第一部分: 碱性磷酸酶的提取以下操作均在4℃进行。
方案一:1. 称取新鲜兔肝2g,剪碎后,置于玻璃匀浆器中,按1:2(m/v)加入预冷的0.05mol/LTris-HCl (pH9.0)缓冲液,匀浆后4℃抽提20 min;4℃,8000r/min离心10min;取上清;此为A 液。
另取1支试管编号为A,取0.1mLA 液,加1.9mLTris缓冲液(pH 8.8),混匀,供测酶活性用。
2.上清液中加入1/5体积预冷正丁醇脱脂20min;8000r/min离心10min,取上清;此为B液。
吸取0.1m1B 液,置于编号为B 的试管中,加入1.9m1Tris 缓冲液(pH 8.8),供测酶活用。
3.加入硫酸铵至35%饱和度;4℃30 min;8000r/min离心10min,弃沉淀;取上清;此为C 液。
吸取C 液0.2m1置于编号为c 的试管中,加入1.8m1Tris 缓冲液(PH 8.8),供测酶活性用4.然后在上清液中加入硫酸铵至75%饱和度,4℃静置30 min后8000r/min离心10min,得沉淀..用0.05mol/LTris-HCl(pH9.0)缓冲液溶解沉淀;此为D 液。