高一化学极性分子和非极性分子
- 格式:pdf
- 大小:1.05 MB
- 文档页数:11
高中化学:分子极性一、分类:按照分子的极性,可把分子分为两类。
1、非极性分子:正负电荷重心重合,分子对外不显示电负性的分子。
例如:等。
疏水分子是指不溶于水的分子。
非极性分子是指原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子。
水分子是极性分子,根据相似相溶原理,非极性分子很难溶于水。
但疏水分子也可能是极性很大的分子,例如各类脂肪酸,所以疏水分子不一定是非极性分子!2、极性分子:正负电荷重心不重合,分子对外显示电负性的分子。
例如HCl、H2O2等。
二、掌握常见分子极性及其空间构型:常见分子极性及其空间构型可用下表表示。
三、了解常见分子空间构型及其键角:中学常见分子空间构型及其键角列举如下:(1)等双原子单质分子为直线形,夹角为180°。
(2)为平面形,夹角为104.5°。
(3)为三角锥形,夹角为107°18”。
(4)S为平面形,夹角为92°。
(5)为正四面体形,夹角为109°28”。
(6)为四面体形,夹角不确定。
(7)为直线形,夹角为180°。
(8)为平面形,夹角为120°。
(9)为平面形,夹角为60°。
(10)为正四面体形,夹角为109°28”。
(11)为直线形,夹角为180°。
(12)为平面形,夹角为120°。
②③④⑤注意:中学常见的四面体物质有①CH4⑥⑦⑧⑨等。
其中是正四面体的有①、⑤、⑥、⑦、⑧、⑨共6种。
四、分子极性判断规律。
①双原子单质分子都是非极性分子。
如等。
②双原子化合物分子都是极性分子。
如HCl、HBr、HI等。
③多原子分子极性要看空间构型是否对称,对称的是非极性分子,否则是极性分O、等是极性分子;子。
如H2等是非极性分子。
④形分子极性判断:若A原子的最外层电子全部参与成键,这种分子一般为非极性分子。
如等。
若A原子的最外层电子没有全部参与成键,这种分子一般为极性分子。

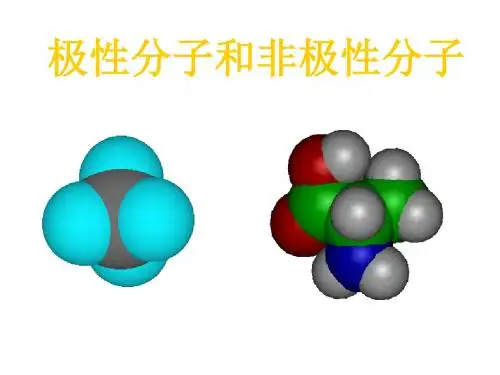
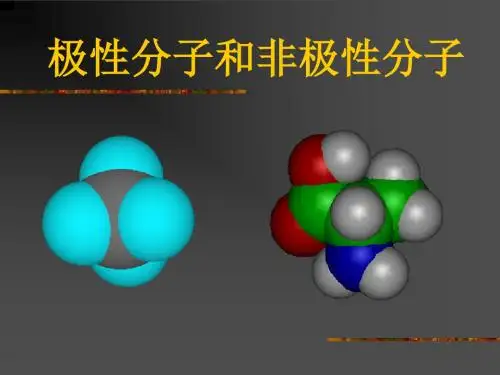
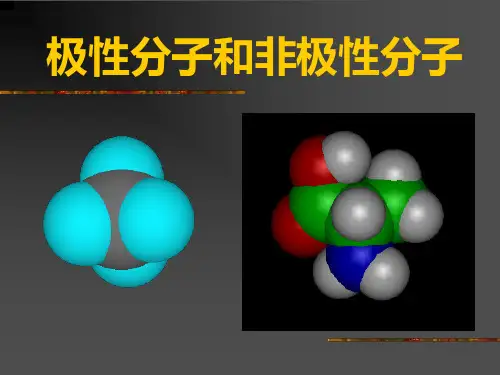


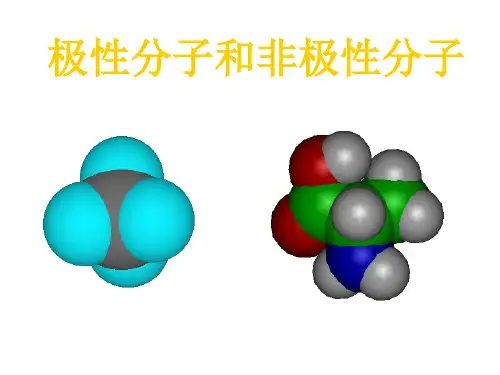
极性分子和非极性分子比较
(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定。
分子极性的判断方法:
An型分子(以非极性键结合形成的单质分子)一般是非极性分子(O3例外),AB型分子一定是极性分子。
对于ABn型分子是极性分子还是非极性分子,通常有以下判断方法。
根据分子的立体构型判断
判断ABn型分子是否有极性,关键是看分子的立体构型.如果分子的立体构型为直线形、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子。
若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子。
比如H2O分子中虽然2个H原子轴对称,但整
个分子的空间构型是不对称的:,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
根据实验现象判断
将液体放入适宜的滴定管中,打开活塞让其缓慢流下,将用毛皮摩擦过的橡胶棒靠近液流,流动方向变化(发生偏移)的是极性分子.流动方向不变的是非极性分子。
举例说明:。

高一化学 非极性分子和极性分子教学实例【教学设计】《非极性分子和极性分子》这节内容是在学习完键的极性的基础上进行授课的。
本节课要求学生通过对简单的分子结构的分析,了解化学键的极性与分子极性的关系。
在这堂课的教学中,我以多媒体作为辅助教学的手段,通过展示多种分子的立体结构,使学生更直观地学会从分子结构判断分子的极性,并在此基础上引导学生利用其他方面的知识来判断分子的极性。
【教学实录】师:演示实验:有机玻璃棒与稠布摩擦后接近滴定管放出的水柱,结果水柱发生偏转,分成几股溶液。
师:为什么有机玻璃棒摩擦后接近水流时会出现这种现象?生:因为玻璃棒带静电,水带电,电性与玻璃棒相反,异性相吸所以水发生偏向。
师:水溶液为什么发生偏转,是因为它带电吗?我们先把这个问题放在这,学习完接下来的内容我们再来找答案。
首先请同学们通读教材并思考两个问题:1、键的极性如何区别 2、分子的极性怎样判断,从教材中总结几条判断规律。
生:非极性键和极性键的判断方法是:同种元素原子形成的共价键是非极性键,不同种元素原子形成的共价键是极性键。
师:回答得很好,投影:师:那么分子的极性怎样判断呢?是否由极性键形成的分子就是极性分子?生:不一定,1、由非极性键结合的双原子分子一定是非极性分子。
如:H 2、Cl 2等;2、由极性键结合成的双原子分子一定是极性分子。
如:HCl 、HF ;3、由极性键结合形成的多原子分子,可能是极性分子也可能是非极性分子,决定于分子的空间结构。
师:总结得很好,双原子分子极性的判断方法比较简单,那么多原子分子究竟该怎样由分子结构来判断分子的极性呢?我们来看以下几个多原子分子的空间结构图。
投影: 展示CO 2、CH 4、H 2O 等分子的空间结构的动画判断键的极性的方法很简单,即看成键的两 原子是否相同,但要注意前提条件:该化学 键必须是共价键。
如:NaCl 分子中成键的两 元素不同,但并不是极性键,而是离子键。
折线型分三角锥型NH3SO2用简图表示:O=C=O师:已知以上六种分子的结构,请根据你从书中总结的判断规律分析它们分子的极性。

极性分子与非极性分子你知道冰为什么在4℃时密度最大吗?这就是本讲所学内容——分子间作用力和氢键的有关知识。
由于水分子间有氢键缔合这样的特殊结构。
根据近代X射线的研究,证明了冰具有四面体的晶体结构。
这个四面体是经过氢键形成的,是一个敞开式的松弛结构,因为5个水分子不能把全部四面体的体积占完,在冰中氢键把这些四面体联系起来,成为一个整体。
这种通过氢键形成的定向有序排列,空间利用率较小,约占34%,因此冰的密度较小。
液态水不像冰那样完全是有序排列了,而是有一定程度的无序排列,即水分子间的距离不像冰中那样固定,H2O分子可以由一个四面体的微晶进入另一微晶中去。
这样,分子间的空隙减少,密度就增大了。
温度升高时,水分子的四面体集团不断被破坏,分子无序排列增多,使密度增大。
但同时,水分子的热运动也增加了分子间的距离,使密度又减小。
这两个矛盾的因素在4℃时达到平衡,因此,在4℃时水的密度最大。
过了4℃后,分子的热运动使分子间的距离增大的因素,就占优势了,水的密度又开始减小。
知识延伸一、分子间作用力分子型物质无论是气态、液态或固态,都是由许多分子组成的,在分子间存在着一种较弱的作用力叫分子间作用力,也叫做范德华力。
它比分子内原子间的作用力(化学键)要小。
分子间的作用力是一个总的提法,按作用力产生的原因和特性可分为三种力:l.取向力当两个极性分子靠近时,同极相斥,异极相吸,产生相对转动,最后必然是异极相对,同极尽量远离,这叫做分子的取向。
这种由于极性分子取向而产生的力叫取向力。
2.诱导力当极性分子接近非极性分子时,极性分子的偶极电场使非极性分子发生极化从而产生正、负电荷重心不相重合,这种由于外来的影响而产生的偶极叫诱导偶极,诱导偶极与固有偶极产生的力称为诱导力。
一般说来,极性分子的极性越大,诱导力越大。
分子的变形性越大,诱导力也越大。
3.色散力非极性分子之间也存在着相互吸引力,非极性分子内部的原子核和电子都在不断地运动,不断地改变它们相对的位置。

高一化学化学键与极性分子和非极性分子【本讲主要内容】化学键与极性分子和非极性分子化学键的概念、分类、特点、成键条件、表示方法等,共价键的极性和分子的极性以及分子极性的判断方法。
【知识掌握】【知识点精析】一. 化学键1. 化学键概念的理解①概念:相邻的两个或多个原子之间强烈的相互作用。
注意:a. 必须是相邻的原子间。
b. 必须是强烈的相互作用,所谓“强烈的”是指原子间存在电子的转移,即共用电子对或得失电子。
②化学键只存在于分子内部或晶体中的相邻原子间及阴、阳离子间,对由共价键形成的分子来说就是分子内...的相邻的两个或多个原子间的相互作用,对由离子形成的物质来说,就是阴、阳离子间的静电作用,这些作用是物质能够存在的根本原因。
③化学键类型包括离子键、共价键和金属键2. 离子键①概念:阴阳离子之间的静电作用。
②成键元素:活泼的金属元素和活泼的非金属元素。
③成键粒子:阴、阳离子。
④成键性质:静电作用。
这种静电作用不是静电引力而是指阴、阳离子之间静电吸引力与电子之间、核间斥力处于平衡时的总效应。
⑤成键条件:⑥键的特点: 无方向性、无饱和性。
⑦存在范围:离子键存在于大多数强碱、盐及金属氧化物中。
⑧表示方法:电子式。
⑨影响离子键强弱的因素:离子半径和离子电荷。
离子半径越小、离子带电荷越多,离子键就越强。
离子键越强,破坏它所需能量就越大。
离子键的强弱主要影响离子化合物的熔沸点,离子键越强,熔沸点就越高。
3. 共价键①概念:原子之间通过共用电子对所形成的相互作用。
②成键元素:非金属元素或某些不活泼金属和非金属。
③成键粒子:原子。
④成键性质:共用电子对对两原子的电性作用。
⑤成键条件:非金属元素间原子最外层电子均未达饱和状态,相互间通过共用电子对结合形成共价键,体系总能量降低。
⑥键的特点:有方向性、有饱和性(最外层有几个不成对单电子,即可形成几个共价键)⑦存在范围:共价键存在于非金属多原子单质、共价化合物(如酸、有机物等)、复杂离子化合物中。
24.极性分子和非极性分子
教学目标
知识技能:使学生初步掌握非极性键、极性键、非极性分子和积极性分子的概念;通过对几种简单非极性分子、极性分子结构的分析,了解键的极性与分子极性的关系;使学生初步了解分子间作用力的概念。
能力培养:培养学生的自学能力、抽象思维能力、逻辑思维能力和表达能力。
科学思想:通过揭示物质之间的普遍联系,培养学生运用辩证唯物主义观点分析化学现象。
科学品质:培养学生严谨、求实、合作、进取的优良品质。
科学方法:通过引导学生观察、实验和抽象思维,向学生进行由微观到宏观、由现象到本质的科学方法的渗透。
重点、难点判断极性分子和非极分子,键的极性分子极性之间的关系。
1.(B) (E) (H)
2.(C) (D) (G) (I) (J)
3.(D) (G)
4.(A) (F)。
分子极性及其判断的规律高一化学教案分子的极性及其判别是中学化学的一个难点,关于这一难点的了解,同窗们可以从以下三个方面着手。
一. 分类依照分子的极性,可把分子分为两类:1. 非极性分子:电荷在分子中的散布对称。
如等。
2. 极性分子:电荷在分子中的散布不对称。
如等。
二. 掌握罕见分子的极性及其空间构型罕见分子的极性及其空间构型如下表所示:类型实例键的极性分子的极性空间构型X2H2、O2、N2非极性键非极性分子直线形XYHCl、NO极性键极性分子直线形XY2(X2Y)CO2、CS2极性键非极性分子直线形H2O极性键极性分子V形XY3BF3极性键非极性分子平面三角形NH3极性键极性分子三角锥形XY4CH4极性键非极性分子正四面体形三. 分子极性的判别规律1. 双原子单质分子都是非极性分子。
如等。
2. 双原子化合物分子都是极性分子。
如等。
3. 多原子分子的极性要看其空间构型能否对称,对称的是非极性分子,否那么是极性分子。
如等是极性分子; 等是非极性分子。
4. 判别型分子的极性还有一个巧妙的方法:价态电子法。
首先确定中心原子A的化合价和A原子的最外层电子数,然后依据两者能否相等停止判别。
假设A的化合价等于A原子的最外层电子数,那么该分子为非极性分子;假设A的化合价不等于A原子的最外层电子数,那么该分子为极性分子。
另外,从表中还可以看出分子的极性或非极性与键的极性或非极性没有肯定联络。
含有极性键的分子不一定是极性分子,含有非极性键的分子不一定是非极性分子。
同窗们在停止有关分子极性的判别时,一定要详细状况详细剖析。