分子极性与非极性 ppt课件
- 格式:ppt
- 大小:214.50 KB
- 文档页数:13
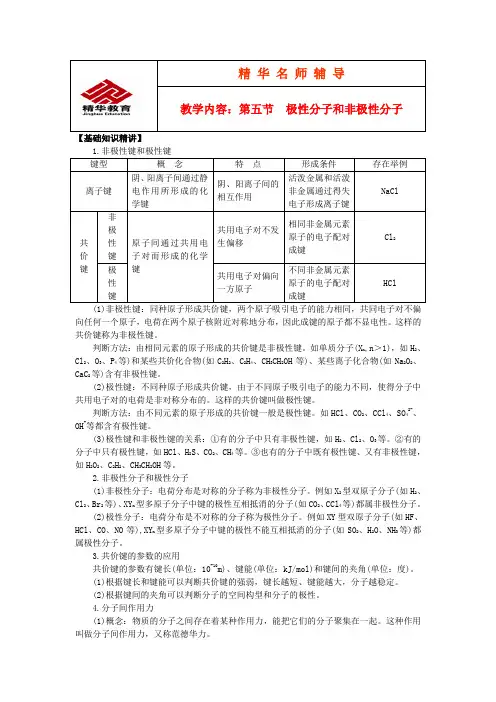
【基础知识精讲】(1)非极性键:同种原子形成共价键,两个原子吸引电子的能力相同,共同电子对不偏向任何一个原子,电荷在两个原子核附近对称地分布,因此成键的原子都不显电性。
这样的共价键称为非极性键。
判断方法:由相同元素的原子形成的共价键是非极性键。
如单质分子(X n,n>1),如H2、Cl2、O3、P4等)和某些共价化合物(如C2H2、C2H4、CH3CH2OH等)、某些离子化合物(如Na2O2、CaC2等)含有非极性键。
(2)极性键:不同种原子形成共价键,由于不同原子吸引电子的能力不同,使得分子中共用电子对的电荷是非对称分布的。
这样的共价键叫做极性键。
判断方法:由不同元素的原子形成的共价键一般是极性键。
如HCl、CO2、CCl4、SO42-、OH-等都含有极性键。
(3)极性键和非极性键的关系:①有的分子中只有非极性键,如H2、Cl2、O3等。
②有的分子中只有极性键,如HCl、H2S、CO2、CH4等。
③也有的分子中既有极性键、又有非极性键,如H2O2、C2H2、CH3CH2OH等。
2.非极性分子和极性分子(1)非极性分子:电荷分布是对称的分子称为非极性分子。
例如X2型双原子分子(如H2、Cl2、Br2等)、XY n型多原子分子中键的极性互相抵消的分子(如CO2、CCl4等)都属非极性分子。
(2)极性分子:电荷分布是不对称的分子称为极性分子。
例如XY型双原子分子(如HF、HCl、CO、NO等),XY n型多原子分子中键的极性不能互相抵消的分子(如SO2、H2O、NH3等)都属极性分子。
3.共价键的参数的应用共价键的参数有键长(单位:10-10m)、键能(单位:kJ/mol)和键间的夹角(单位:度)。
(1)根据键长和键能可以判断共价键的强弱,键长越短、键能越大,分子越稳定。
(2)根据键间的夹角可以判断分子的空间构型和分子的极性。
4.分子间作用力(1)概念:物质的分子之间存在着某种作用力,能把它们的分子聚集在一起。







