食品中致病性弧菌的检测和计数NMKL No 156
- 格式:doc
- 大小:49.50 KB
- 文档页数:10


原料验收监控计划原料验收监控计划原料验收的监控计划一、相关检验方法标准依据1、SN033094《出口食品中微生物学检验通则》2、SN016892《出口食品平板菌落计数》3、SN016992《出口食品中大肠菌群、粪大肠菌群和大肠杆菌检验方法》4、SN017092《出口食品沙门氏菌属(包括亚利桑那菌)检验方法》5、SN017292《出口食品中金黄色葡萄球菌检验方法》、ISO068881999(E)《金黄色葡萄球菌检测和计数方法》6、NMKL-No156-1997《食品中致病性弧菌的检测和计数》7、SN078493《出口食品中单核细胞增生李斯特氏菌检验方法》8、氯霉素ELISA试剂盒检测法9、硝基呋喃及代谢物LC/MS/MS检测法二、原料监控体系的机构设置和职责分工A、收购负责人:1、负责贯彻执行国家有关水产业的法律法规和方针政策,制定收购点的有关管理制定,并对实施情况进行监督检查。
2、在龙虾收购前负责对原料产区的水质和原料的抽样检测工作的实施。
确保在收购前将所有的收购证件办理到位,给公司提供一个安全原料收购区域。
3、负责对每天各个供应商的捕捞的小龙虾进行收购质量的把关。
同时,对所有供货的供货证明要严格检查,必要时对捕捞者进行有关法律法规方面的知识培训,使他们对有关原料安全项目引起注重,从而保证原料的安全性。
4、负责对收购点的收购原料实施监控,保证收购点的原料质量的安全性。
5、负责监督对原料虾的运输等工作,使原料能够安全到达公司。
B、收购点挑选人员工作职责:1、对所有收购的原料虾,都要按公司的要求进行认真挑选出残虾、杂质、不达规格等。
2、对所有的挑选后的原料虾要按先后的顺序进行摆放好,不得出现不合格的龙虾。
C、收购点的运输人员工作职责:1、对所有的小龙虾按收购的先后顺序进行运往公司等加工。
2、对所有的工器具必须每天要规范清洗消毒到位后再进行使用。
3、将收购的所有收购凭证及时的收回以便公司进行核查。
D、公司验收人员(品控部)的工作职责:1、首先对每批进公司的原料虾验收记录表的核查;2、检查每车的装虾的工器具是否达到清洁卫生的标准。
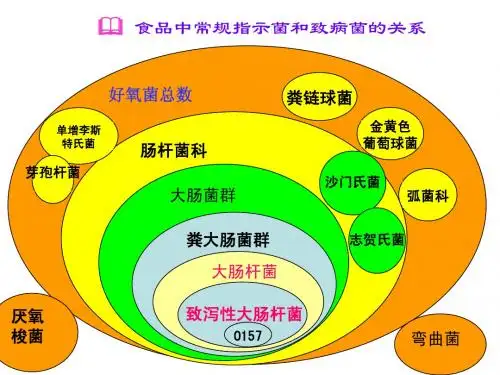


《食品卫生微生物学检验》-----阳性对照标准菌株中国工业微生物菌种保藏管理中心《食品卫生微生物学检验》新版标准GB/T 4789-2010于2010年6月1日开始实施。
新版《食品卫生微生物学检验》国标在检测流程、检验方法及培养基使用等方面进行了较大改动。
标准中要求实验室应当有阳性对照标准菌株,以下是中国工业微生物菌种保藏管理中心整理的《食品卫生微生物学检验》标准中涉及的阳性对照标准菌株,以方便食品监督管理部门、检验检疫机构、卫生防疫部门、大专院校、科研院所和食品企业微生物实验室使用。
附件:食品微生物学检验(GB/T 4789)阳性对照用菌下面是散文两篇,不需要的可以编辑删除闲时翻翻古书,觉陶公形象非一般君子之所比也,于是细细读之,连缀成篇以为学习之楷模。
陶渊明一生,大约可分三个阶段:出仕前(公元365--392年),出仕中(公元393--405年),归园田(公元406--427年)。
他所处的时代,正值东晋末季。
其间战乱频繁,国无宁日。
公元420年东晋灭亡,刘裕建刘宋王朝,陶渊明成亡国遗老,时55岁。
刘义龙元嘉四年(公元427年)十一月,他含恨离世,享年63岁。
没落,江河日下。
他在29岁时才出仕,任过一些小小祭酒,参军职务。
直到41岁时,其叔太常陶夔见其贫苦提用于小邑彭泽县令。
叹!然而这样的结局又在情理之中。
“宁困穷以济意,不委曲而累己“,他在作彭泽令时,为何只在官八十余里小儿!即日解绶去职。
赋《归去来》。
”孤高,不愿与世俗同流合污,这是他的性格,也是他在那个时代家世没落的重要原因。
不仅如此,疾恶如仇,是他又一性格特点。
《读山海经》是其代表作。
共十三首,第一首发端,二至十二首咏读书之所记,末首写了齐桓公不听管仲而任用奸臣易牙竖刁,继而为乱,桓公饥渴而死。
他大呼“明处天鉴,为恶不可履“!在他心里“猛志固常在”,他要效仿刑天,他要学习精卫,其济世壮志不亦显乎!他欣赏荊苛,“其人虽己殁,千载有余情“,封建时代,剑客轼君为大逆不道,正因他认为秦始皇独裁,残忍,园则成为他宁静闲适的修身养性之处,虽有人指责他“乐天安命”“洁身自好”,我们不妨看看那狂放不羁的上的阮籍,也不得不发出“时无英雄,遂使竖子成名“的慨叹,在“终身履薄冰“的恶劣环境下纵酒谈玄,佯狂放要求那个时代的人呢?陶渊明渴望理想社会,57岁时写的《桃花源诗并记》,充分反映了他这种思想。
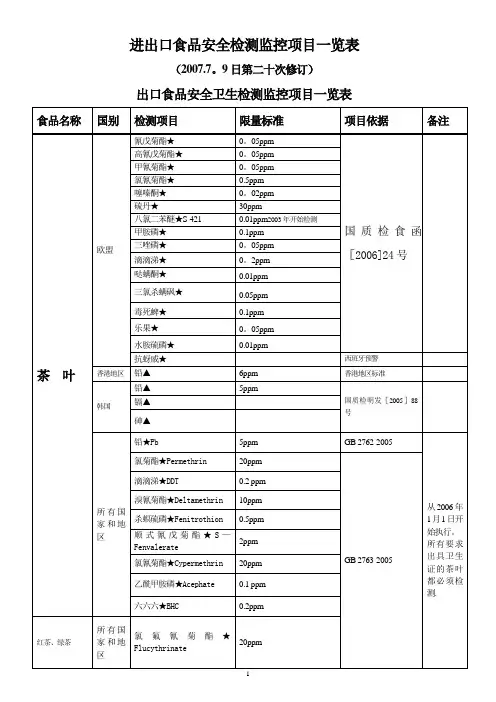
进出口食品安全检测监控项目一览表(2007.7。
9日第二十次修订)
出口食品安全卫生检测监控项目一览表
二、出口水产品安全卫生检测监控项目一览表(欧盟)
出口水产品安全卫生检测监控项目一览表(韩国)
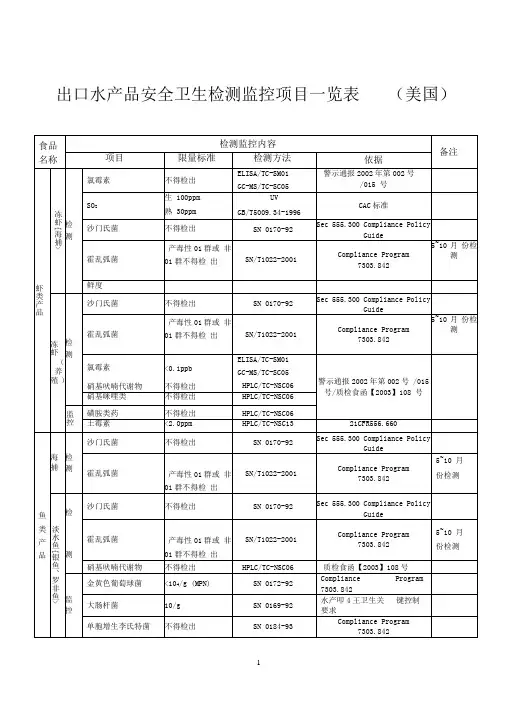
出口水产品安全卫生检测监控项目一览表(美国)
出口水产品安全卫生检测监控项目一览表(日本)
出口水产品安全卫生检测监控项目一览表(加拿大)
出口水产品安全卫生检测监控项目一览表(其他国家和地区)
注:
1、各出口卫生注册企业必须:对成品检测细菌总数和大肠菌群,对原料监控致病菌和金黄色葡萄球菌,要求每年制
定原料监控计划。
2、各检验检疫局于每季度的第一个月按上一年度的出口数并结合省局下达的监控计划制定季度监控计划,并将
本季度的残留监控计划和上季度的抽样完成情况报省局食检处。
进口食品、出口保健食品检测要求
注:部分已根据2003年GB标准修改。
2004.9.13
进口淡水水产品的检验检疫药残限量标准
水生动物禁用药物
其他有毒有害物质限量标准
进口海水水产品的检验检疫药残限量标准
进口海水水产品其他有毒有害物质限量标准
实验室检测项目、标准/方法、限量标准和检测对象。

菌落总数一、菌落总数介绍:菌落是指细菌在固体培养基上生长繁殖而形成的能被肉眼识别的生长物,它是由数以万计相同的细菌集合而成。
当样品被稀释到一定程度,与培养基混合,在一定培养条件下,每个能够生长繁殖的细菌细胞都可以在平板上形成一个可见的菌落。
菌落总数就是指在一定条件下(如需氧情况、营养条件、pH、培养温度和时间等)每克(每毫升)检样所生长出来的细菌菌落总数。
按国家标准方法规定,即在需氧情况下,3 7℃培养48h,能在普通营养琼脂平板上生长的细菌菌落总数,所以厌氧或微需氧菌、有特殊营养要求的以及非嗜中温的细菌,由于现有条件不能满足其生理需求,故难以繁殖生长。
因此菌落总数并不表示实际中的所有细菌总数,菌落总数并不能区分其中细菌的种类,所以有时被称为杂菌数,需氧菌数等。
菌落总数测定是用来判定食品被细菌污染的程度及卫生质量,它反映食品在生产过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价。
菌落总数的多少在一定程度上标志着食品卫生质量的优劣。
二、检验方法菌落总数的测定,一般将被检样品制成几个不同的10倍递增稀释液,然后从每个稀释液中分别取出1mL置于灭菌平皿中与营养琼脂培养基混合,在一定温度下,培养一定时间后(一般为48小时),记录每个平皿中形成的菌落数量,依据稀释倍数,计算出每克(或每ml)原始样品中所含细菌菌落总数。
基本操作一般包括:样品的稀释--倾注平皿--培养48小时--计数报告。
国内外菌落总数测定方法基本一致,从检样处理、稀释、倾注平皿到计数报告无何明显不同,只是在某些具体要求方面稍有差别,如有的国家在样品稀释和倾注培养进,对吸管内液体的流速,稀释液的振荡幅度、时间和次数以及放置时间等均作了比较具体的规定。
检验方法参见:GB4789.2-94 《中华人民共和国国家标准食品卫生微生物学检验菌落总数测定》SN0168-92 《中华人民共和国进出口商品检验行业标准出口食品菌落计数》三、说明(一)样品的处理和稀释:1.操作方法:以无菌操作取检样25g(或25ml),放于225mL灭菌生理盐水或其他稀释液的灭菌玻璃瓶内(瓶内预置适当数量的玻璃珠)或灭菌乳钵内,经充分振要或研磨制成1:10的均匀稀释液。

食品微生物检验内容与检测技术分析食品微生物检验是指对食品样品中的微生物进行检测和分析的过程。
食品微生物检验内容包括对食品中常见的致病菌、有害菌和变质菌的检测,以及对食品中的微生物总数、菌落总数、酵母和霉菌等指标的测定。
1. 致病菌的检测:致病菌是指能够引起食物中毒或食源性疾病的微生物。
常见的致病菌有大肠杆菌、沙门氏菌、金黄色葡萄球菌、产气荚膜梭菌等。
食品中的致病菌检测主要包括样品的预处理、分离培养、形态观察和生化鉴定等步骤。
2. 有害菌的检测:有害菌是指对人体健康有一定危害的微生物,包括产毒菌、过敏原菌等。
常见的有害菌有金黄色葡萄球菌、葡萄球菌、大肠埃希菌、变形杆菌等。
有害菌的检测可以采用PCR技术、酶联免疫吸附法(ELISA)、生物传感技术等。
3. 变质菌的检测:变质菌是指导致食品腐败、变质的微生物。
变质菌的检测常采用菌落总数进行评估,包括总生菌数、大肠杆菌群和金黄色葡萄球菌的测定。
常用的检测方法有平板计数法、过滤法、MPN法等。
4. 微生物总数的测定:微生物总数是指食品样品中各种微生物的总数目,是评价食品卫生质量的重要指标之一。
常用的方法有平板计数法、过滤法、MPN法等。
6. 酵母和霉菌的测定:酵母和霉菌是食品中常见的微生物,对食品的质量和安全有一定影响。
常见的方法有平板计数法、膜过滤法等。
食品微生物检验的技术包括传统培养方法和快速检测方法。
传统培养方法是指通过将食品样品接种于适当的培养基上,经过一定的温度和时间培养,观察和计数微生物菌落来确定食品样品中微生物的种类和数量。
快速检测方法是指利用现代生物技术手段,通过检测微生物的特定基因、代谢产物或抗原,结合分子生物学、免疫学等方法对微生物进行检测和鉴定。
常见的快速检测方法有PCR技术、酶联免疫吸附法(ELISA)、生物传感技术等。

出境活螃蟹监督管理和检验检疫程序1.目的为了规范江苏出境活螃蟹检验检疫和监管工作,统一检验检疫程序,提高工作质量,切实履行执法职责,特制定本程序。
2.适用范围出境活螃蟹的检验检疫和监督管理。
3.监督管理程序检验检疫机构对注册企业实行监督管理制度,定期对出境螃蟹养殖场、中转包装场、发运点的卫生状况、水质、病原体以及农药、兽药和有毒有害物质残留进行监测和监管,填写《检验检疫监管记事》。
3.1 注册养殖场检验检疫人员应定期对出境螃蟹注册养殖场实施监督管理。
养殖周期内至少每月日常监管一次,并填写《监管记事》。
监督管理的内容必须确保养殖场符合以下要求:3.1.1 蟹苗管理蟹苗必须来自非疫区的健康种苗。
养殖场在蟹苗投放前应对苗种进行孔雀石绿、氯霉素、氟喹诺酮类、呋喃类等药残进行监测,并具有完善的苗种验收记录、苗种消毒记录和投放记录。
3.1.2 药物使用管理养殖场严格遵守国家有关药物管理和使用的规定,不得存放和使用国家和进口国家或地区政府规定禁止使用的药物以及未经国家政府部门批准生产的或药物成份不明的药物;对允许使用的药物,必须严格按照养殖场的药物使用管理规定执行,实行专柜存放、采购和使用核销制度,严格遵守停药期的管理规定。
3.1.3 饲料使用管理要求螃蟹饲用配合饲料必须来自经检验检疫机构备案的饲料厂,并建立饲料验收台账、领用台账和饲喂记录。
水草、螺蛳、蚬子、小杂鱼等鲜活饵料必须来自水生动物非疫区和非污染区,必要时经检测合格后方能允许使用。
3.1.4 防疫消毒制度对养殖池、工器具、场地等做好消毒防疫工作,并具有消毒防疫记录。
3.1.5 养殖水质管理每年应定期对水质进行监测,养殖场水域周围必须无污染源,水质应符合国家渔业水质标准要求。
3.1.6 疫病防治管理养殖场应具有疫病监测、控制体系和疫情报告制度以及疫病防治记录。
3.1.7 养殖管理制度和记录养殖场应具有养殖、药物、饲料使用的管理制度以及记录档案,填写《出境水生动物企业安全卫生质量管理手册》内的所有内容,如水质监测、蟹苗投放、药物和饲料的采购和使用、防疫消毒情况以及捕捞记录等。

致病菌 pcr检测标准
致病菌 PCR 检测标准是指用于检测致病菌的聚合酶链反应(PCR)技术的标准。
这些标准通常由相关的政府机构、行业协会或学术组织制定,以确保检测结果的准确性和可靠性。
以下是一些常见的致病菌 PCR 检测标准:
1. 美国食品药品监督管理局 (FDA):FDA 制定了一些针对食品和饮料中致病菌检测的 PCR 标准,如检测大肠杆菌 O157:7777(E. coli O157:7777)和沙门氏菌(Salmonella)等。
2. 欧洲食品安全局(EFSA):EFSA 制定了一些针对食品和饲料中致病菌检测的 PCR 标准,如检测单核细胞增生李斯特菌(Listeria monocytogenes)和弯曲杆菌(Campylobacter)等。
3. 中国国家食品药品监督管理总局 (CFDA):CFDA 制定了一些针对食品和药品中致病菌检测的 PCR 标准,如检测金黄色葡萄球菌(Staphylococcus aureus)和大肠埃希氏菌(Escherichia coli)等。
4. 世界卫生组织 (WHO):WHO 制定了一些针对饮用水中致病菌检测的 PCR 标准,如检测霍乱弧菌(Vibrio cholerae)和军团菌(Legionella)等。
这些标准通常包括检测方法的详细说明、引物和探针的设计、反应条件的优化、质量控制和结果解释等方面的内容。
在进行致病菌 PCR 检测时,应严格按照相关标准进行操作,以确保检测结果的准确性和可靠性。
副溶血性弧菌检测微生物国标检测流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!副溶血性弧菌检测的微生物国家标准检测流程详解副溶血性弧菌,是一种常见的海洋性致病菌,主要引起食物中毒,对人类健康构成威胁。
常见致病菌的检测摘要:近年来食品药品安全的问题屡见不鲜,做好致病菌的检测,是防范于未然的措施,因而显得尤为的重要,也越来越受到人们的重视。
这就要求我们对一些常见的致病菌检测技术的要有一定的了解。
关键词:致病菌,肠球菌,霉菌和酵母菌,金黄色葡萄球菌,沙门氏菌。
一.肠球菌(1)、形态与染色【1】肠球菌为革兰阳性(G+)球菌,广泛分布于自然环境及人和动物消化道内。
20世纪80年代以来,肠球菌严重感染的发生率和病死率明显升高,并且由于肠球菌的固有耐药和获得性耐药,使许多常用抗菌药物在治疗肠球菌感染时失败。
因此,从分子水平对肠球菌致病因子、肠球菌引起的感染机制与治疗的研究显得尤为重要。
肠球菌为圆形或椭圆形、呈链状排列的革兰阳性球菌,无芽胞,无鞭毛,为需氧或兼性厌氧菌。
本菌对营养要求较高,在含有血清的培养基上生长良好。
(3)致病性【1】一般而言,肠球菌的毒力不高。
与金黄色葡萄球菌和化脓性链球菌相比,肠球菌对大多数动物的半数致死量(LD50)值相当高,而且肠球菌很少引起蜂窝织炎和呼吸道感染。
肠球菌只有在宿主组织寄殖,耐机体非特异及免疫防御机制,并引起病理改变,才能导致感染。
粘附测定显示肠球菌可通过细菌表面表达的为粘附素,吸附至肠道、尿路上皮细胞及心脏细胞。
这些粘附素的表达亦受细菌生长环境的影响。
另外,肠球菌可产生一种聚合物质(系一种蛋白表面物质,可聚集供体与受体菌,以利质粒转移),在体外增强其对肾小管上皮细胞的粘附。
细菌生长环境亦影响肠球菌与多形核白细胞反应。
血清中生长的肠球菌与多形核白细胞反应较弱,而肉汤中生长的细菌反应较强。
体外多形核白细胞对肠球菌的有效杀灭作用需血清补体蛋白参与,而抗肠球菌抗体可增强该作用。
(4)、肠球菌属主要检测步骤如下:【2】方法一:肠球菌平板计数法检验程序25g (mL) + 225 mL 缓冲蛋白胨水↓10 倍梯度稀释↓选择2 个~3 个适宜连续稀释度,各取1 mL 分别加入灭菌培养皿↙↘KF琼脂36℃士1℃ 48h 士2h肠球菌琼脂35℃士2℃ 24h士2h↘↙确证实验↓肠球菌阳性↓菌落计数及计算↓报告结果方法二:肠球菌最近似值(MPN )测定法检验程序25g(mL ) + 225 mL 缓冲蛋白胨水↓10 倍梯度稀释↓选择3 个适宜连续稀释度,各取1 ml 分别加入肉汤中↙↘叠氮化钠葡萄糖肉汤管肠球菌肉汤管37℃士1℃ ,24h~48h 35C 士2 ℃ 24h 士2h↓↓↓↓无混浊混浊变黑不变黑↓↓↓↓肠球菌阴性确证实验确证实验肠球菌阴性↓↓肠球菌阳性肠球菌阳性↘↙MPN 值法报告肠球菌数/g(mI)二.霉菌和酵母菌(1)、形态【1】酵母菌是单细胞真核微生物。
食品中致病性弧菌的检测和计数该NMKL法尚未经协同研究证实1.适用范围本法可用于检测和计数食品中的副溶血性弧菌,霍乱弧菌,刨伤弧菌和溶藻弧菌。
这些对人类有致病性的弧菌可能由粪便污染或水源受到污染而在食品中出现。
在食品,尤其是贝类、蜊蛄和鱼的微生物学控制和与疾病爆发有关的微生物学调查中可能需要对该菌进行检测。
2.定义弧菌是兼性厌氧,有动力,革兰氏阴性,常呈逗号形的杆菌。
钠离子是大多数菌株(霍乱弧菌除外)所必需的一种生长因子。
大多数菌种为氧化酶阳性,过氧化氢酶阳性,发酵葡萄糖不产气。
它们一般出现于盐浓度范围较宽的水域环境及海洋动物的表面和肠道中。
一些菌株也可在淡水中发现(霍乱弧菌)。
副溶血性弧菌呈现下列的生物化学反应模式:氧化酶阳性,在42℃生长,精氨酸脱氢酶阴性,赖氨酸脱羧酶阳性,不发酵蔗糖但可将硝酸盐还原为亚硝酸盐。
可发酵糖类但不产气。
在盐(氯化钠)浓度为6%时不能生长。
霍乱弧菌有如下的生物化学反应特性:氧化酶阳性,在42℃生长,缺少精氨酸脱氢酶,发酵蔗糖,可将硝酸盐还原为亚硝酸盐。
在无钠离子时可以生长。
在盐浓度为3%时可以生长,而盐浓度为8%时不能生长。
创伤弧菌呈现如下的生物化学反应模式:氧化酶阳性,在42℃生长,缺少精氨酸双水解酶,赖氨酸脱羧酶阳性,不能发酵蔗糖但可将硝酸盐还原为亚硝酸盐。
在无盐或盐浓度为8%的培养基中不能生长。
溶藻弧菌见表1。
所有弧菌在不同程度上都会受到0/129弧菌抑制剂(0/129 Vibrostaticum)的抑制。
3.参考文献NMKL Method No.91,2nd ed.1988:Pretreatment of foods for microbiological examination.NMKL Report No.5,2nd edition,1994:Quality Assurance Guidelines for Microbiological Laboratories.4.原理将欲检测该菌的已知量的食品接种于一种液体选择性培养基中,培养后涂布样品于一种固体选择性培养基上。
可疑菌落经进一步生物化学检验。
此外,可将已知量的可疑食品直接接种于一种选择性固体培养基上进行定量测定。
5. 培养基和试剂5.1稀释剂将8.5g氯化钠和1.0 g蛋白胨溶于1000mL蒸馏水中并煮沸,调节PH使之灭菌后25℃为7.0±0.2。
分装稀释剂于试管或广口瓶中以使12l℃高压灭菌20min 后分别含9.0±0.2ml和90±2ml。
5.2液体选择性培养基5.2.1含2%盐的碱性蛋白胨水酵母浸膏3g蛋白胨10g氯化钠20g蒸馏水至1000ml高压灭菌后25℃时PH为8.6±0.2。
倾入250ml的锥形瓶中,每瓶200ml,121℃高压灭菌15min。
5.2.2. 盐多粘菌素肉汤酵母浸膏3g胰蛋白胨10g氯化钠20g蒸馏水至1000ml将各成分加热溶解,调节PH以使灭菌后25℃时最终PH为8.6±0.2。
121℃高压灭菌15min。
使用前加入多粘菌素B,250IU/ml。
当检查含菌量较低的食品时,仅加25IU/ml。
倾入250ml的锥形瓶中,定性测定时每瓶200ml,5℃以下保存。
5.3.固体选择性培养基5.3.1.硫代硫酸盐柠檬酸盐蔗糖琼脂(TCBS)蛋白胨l0g酵母浸膏5g柠檬酸钠l0g硫代硫酸钠l0g牛胆汁,干的5g脱氢胆酸钠3g蔗糖20gNacl l0g柠檬酸铁1g麝香草酚兰0.04g溴麝香草酚兰0.04g琼脂14g蒸馏水至1000ml加热溶解各成分,25℃时调节PH至8.6±0.2。
煮沸灭菌(不是高压灭菌)15min。
5.4.用于对纯培养的可疑细菌进行诊断的培养基,抗生素试验和试剂5.4.1.Hugh-Leifson, 盐葡萄糖培养基(O/F培养基)蛋白胨2g氯化钠20g磷酸氢二钾0.3g溴麝香草酚兰0.08g琼脂 2.5g蒸馏水至1000ml25℃时调节PH至7.1+0.2, 121℃高压灭菌15min。
加入l0ml含l0g葡萄糖的水溶液(过滤除菌)。
5.4.2.胰蛋白胨肉汤胰蛋白胨10g氯化钠20g蒸馏水至1000ml将各成分溶于水中121℃灭菌15min。
5.4.3.弧菌抑制剂(Vibrostaticum)将菌株越过血琼脂(5.4.4)直径划一条线接种(8.5.3)后,在该划线上放一含150 μg二氨基二异丙基碟啶的0/129弧菌抑制剂园纸片。
5.4.4.血琼脂蛋白胨10g肉浸膏5g氯化钠7g琼脂15g蒸馏水至1000ml在25℃调节PH至7.4±0.2,121℃高压灭菌15分钟,然后于45±1℃水浴中冷却,加入加热至同一温度的5%脱纤维蛋白的小牛血。
倾注陪替氏皿前小心地将血与熔化的培养基混合。
该血必须来自小牛或幼牛。
5.4.5.氧化酶试剂盐酸对氨基二甲基苯胺(TMPD) 1.0g抗坏血酸100mg蒸馏水100ml将抗坏血酸溶于冷水中并加入1gTMPD,加约5~8m1该试剂于试管中,然后将其冷冻。
用前将试剂融化并用银纸包裹避光,在这些条件下氧化酶试剂可在冰箱中保存约l周。
也可使用商售的氧化酶试纸条。
也可使用相当于5.4提供的各成分的脱水培养基,如使用这种培养基,必须确保培养基的盐浓度与此方法所规定的盐浓度一致。
6、仪器和玻璃器皿:6.1. 均质器,用于非液体食品样品6.2.培养箱,37.0士1.0℃,42.0±1.0℃6.3.灭菌的弯曲玻璃棒, 三角形7.抽样在无菌操作条件下,并按照使样品尽可能地代表被检产品的方式抽样。
抽取至少50g的固体食品和至少100ml的液体食品。
若抽取后1小时内不能进行接种,最好将样品保存在7~l0℃适度的冷藏条件下。
抽样后12h内必须进行接种,如存放较长时间,应在报告结果时对此加以说明。
8.操作方法:8.1.样品材料的预处理按NMKL No.91(3)所述,涂布平板前必须将非液体食品进行均质。
均质,稀释和接种必须尽快地进行,检验贝类时,开贝壳前必须用刷子进行清洗并用乙醇消毒。
开壳时用一把无菌的小刀按非冷冻的固体食品所述进行。
8.2.直接涂布在固体选择性培养基上的定量方法。
将0.1ml各十倍稀释液涂布于TCBS培养基(5.3.1.)上。
用一支灭菌的三角形玻璃棒(6.3)在表面上涂布均匀,接种了的平板于37.0±1℃培养2天,一天、两天后分别读数。
8.3.在液体选择性培养基中增菌的定性方法。
霍乱弧菌、创伤弧菌、溶藻性弧菌:接种20g食品于含盐2%的200m1碱性蛋白胨水中(5.2.1)42.0±1.0℃培养18±2h。
副溶血性弧菌:加20g食品于200ml盐多粘菌素肉汤(5.2.2)肉汤中,于42.0土1℃培养18±2h。
8.4.在固体选择性培养基上接种。
将一环接种于TCBS琼脂(5.3.1)表面上,平板于37.0±l℃培养24±3h。
8.5.读取和纯培养8.5.1.纯培养在原始选择性平板上纯培养24h后,以下类型的菌落被怀疑为弧菌。
霍乱弧菌:黄色,扁平,直径2-3mm;副溶血性弧菌:蓝绿色,直径3-5mm;创伤弧菌:蓝绿色,直径2-3mm;溶藻性弧菌:黄色,直径3-5mm;根据最初平扳上不同形态的菌落在血琼脂(5.4.4)上制备纯培养物。
纯化培养和鉴定至少5个可疑菌落。
如果怀疑存在不同弧菌,继续进行相应地分离和鉴定。
可按照表1进行最后鉴定,注意应向需要的培养基中补加1%的盐。
可在专门的实验室做进一步测定。
8.5.2.动力试验。
在胰蛋白胨肉汤(5.4.2)中检查动力,通过下列方法确定:a.直接用显微镜观察,或b.在添加0.5%琼脂于胰蛋白胨肉汤中制备的半固体琼脂中培养。
8.5.3.对弧菌抑制剂0/129的敏感性试验,用镊子将已放入冰箱浸湿了弧菌抑制剂1小时的一张圆纸片,放在划线接种后的平板(5.4.3)上,在37.0土1.0℃培养,24±3h后评价抑制结果。
8.5.4产气和产酸试验将O/F培养基(5.4.1)倾入试管中,用前在蒸汽流中将其溶化并立即在冷水中冷却。
用接种针穿刺到底部接种两支试管,其中一管用液体石蜡封形成厌气。
于37.0±1.0℃培养,每天观察产气和产酸情况直至四天。
厌氧和需氧管中均产酸(黄色)表明发酵(F)。
需氧管的上层产酸表明氧化(0)。
8.6.证实将用生物化学试验确定为霍乱弧菌的分离物送至专业实验室用O1和O139抗血清做最后鉴定。
9.结果的报告根据结果报告:20g样品中(或被分析的样品量)中检出或未检出弧菌。
如果进行了弧菌各种间生物化学区分,还应说明该种别,如20g样品中检出副溶血性弧菌。
如果进行了定量测定,则要报告每克食品中的弧菌数量,还要考虑到的稀释倍数。
10、实验室的卫生:由于某些致病性弧菌的感染剂量很低,要指出在工作中应特别小心,应该严格保持GLP。
例如,不能用嘴吸吸管。
11、方法的审定人本NMKL方法已由The Municipal Laboratory for Environment and Food Control,Aalborg,Denmark 的Maja kraglund Holfort 作了详细说明并得到了The Veterinary and Agricultural University,Frederiksberg,Denmark Niels Skovgaard的帮助表1各种弧菌的生物化学反应霍乱弧菌付溶血性弧菌创伤弧菌溶藻性弧落革兰氏染色- - - -动力***)+ + + +细胞色素氧化酶+ + + + Hugh和leifson***)F*/- gas F/- gas F/- gas F/- gas 在42℃生长***)+ + + +0/129弧菌抑制剂(150μg) + + + +还原硝酸盐为亚硝酸盐***)+**) + + +精氨酸脱氢酶***)- - - -赖氨酸脱羧酶***)+ + + + ONPG***)+ - + -由下列糖产酸--气:葡萄糖***)+ d - d蔗糖***)+ - - +纤维二糖***)- - + -嗜盐性:0%Nacl + - - - 6%Nacl - + + + 8%Nacl - + - + 10%Nacl - - - +*)F表示发醇。
**)表明偶有例外。
***)表示必须向培养基中加入1%Nacl。
+ 表示85-100%的分离物此特性为阳性。
d 表示16-84%的分离物此特性为阳性。
- 表示0-15%的分离物此特性为阳性。
译自《北欧食品分析委员会方法(NMKL),№.156—1997(第二版)》。