常见的漂白剂及漂白原理
- 格式:docx
- 大小:13.82 KB
- 文档页数:1

漂白粉漂白原理
漂白粉是一种常用的漂白剂,它可以将有色物质表面的色素颗粒去除,使物体恢复到原本的白色。
漂白粉的主要成分是过氧化氢。
其漂白原理是通过氧化作用将有机物中的色素分子还原或分解,从而使物体变白。
当漂白粉溶解在水中时,过氧化氢分解成氧气和活性氧离子。
活性氧离子具有强氧化性,可以破坏有机物中的双键、芳环和杂原子键,使有机物中的色素分子失去色彩。
此外,溶解在水中的氧气也可以与有机物发生氧化反应,进一步分解有机物的分子结构,使物体恢复到白色。
漂白粉的使用方法很简单。
只需将其溶解在水中,然后将待漂白的物体浸泡在溶液中,经过一段时间后,物体的颜色就会逐渐变白。
在使用漂白粉时需要注意控制好浓度和漂白时间,以免对物体造成损坏。
需要注意的是,漂白粉对不同类型的物体有不同的漂白效果。
对于有机物,如织物、纸张等,漂白效果较好。
而对于无机物,如金属、瓷器等,漂白效果就比较有限。
此外,一些特殊的有色物质,如咖啡渍、果汁渍等,可能需要使用专门的漂白剂才能去除。
总之,漂白粉的漂白原理是通过氧化作用将有机物中的色素分子还原或分解,使物体恢复到白色。
在使用漂白粉时需要控制好浓度和漂白时间,避免对物体造成损坏。

漂白剂的工作原理和分类参考资料:中国环保网/trade/supply/index--1000100310021008--.htm吸收液用氯化汞与氯化钠作用生成四氯汞钠,当样品中的SO2与吸收液作用之后,生成一种稳定的络合物(可防止SO2的损失),这种络合物与甲醛及盐酸副玫瑰苯胺作用生成紫红色络合物,颜色的深浅与SO2浓度成正比,可在580nm下比色测定。
常用的氧化漂白剂有两种:一种是含氯漂白剂,另一种是含氧漂白剂。
一、含氯漂白剂,简称氯漂,是能释放活性氯的氧化剂,通常有氯漂水和氯漂粉。
作为漂白剂,它的漂白去污能力比氧漂强,使用氯漂可使布草白度保持及表面净化程度较好,但织物纤维在漂白过程中受到的损伤也比氧漂要大。
为此,在漂白过程中对pH 值、温度、时间和浓度要进行严格的控制,以减少织物受到的损伤。
其中温度对氯漂漂白有显著影响,提高温度,能加快漂白反应速度,缩短漂白时间。
在一定温度下,温度增加7℃左右,漂白速度可增加一倍,温度增加10℃左右漂白速度增加两倍。
专业洗涤工作量大,并希望迅速完成,因此在使用氯漂漂白织物时,通常通过适当升高温度,以提高漂白和洗涤速度。
但洗涤过程中并不是温度越高越好,要注意的是温度过高会使纤维聚合度降低。
一般建议使用氯漂的温度在60-70℃左右,时间为10-15分钟。
二、含氧漂白剂,简称氧漂,通常有氧漂剂和彩漂粉。
它对织物的漂白较温和,一般不会损伤织物,可令白色或有色织物漂白后色泽更亮丽。
常用的含氧漂白剂主要是双氧水和彩漂粉,有较好的漂白作用和杀菌作用。
氧漂是通过在水溶液中经过过羟离子游离出活性氧而产生漂白作用,在常温下,它的漂白速度比较缓慢,为了提高洗涤速率,一般在高温条件下进行漂白,既提高了漂白速度,也增加了织物的的去污力和白度。
因此通常使用双氧水洗涤漂白温度控制在80~90℃,漂白时间在10~15min。
在洗衣業上,一般使用的漂白剂,大致可分为二大类:一为氧化漂白剂,一为还原漂白剂。

高中化学知识要点总复习高中化学知识要点高中化学知识要点总复习一常见的漂白剂:1、强氧化型漂白剂:利用自身的强氧化性破坏有色物质使它们变为无色物质,这种漂白一般是不可逆的、彻底的。
(1)次氧酸(HClO):一般可由氯气与水反应生成,但由于它不稳定,见光易分解,不能长期保存。
因此工业上一般是用氯气与石灰乳反应制成漂粉精:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O漂粉精的组成可用式子:Ca(OH)2?3CaCl(ClO)?nH2O来表示,可看作是CaCl2、Ca(ClO)2、Ca(OH)2以及结晶水的混合物,其中的有效成分是Ca(ClO)2,它是一种稳定的化合物,可以长期保存,使用时加入水和酸(或通入CO2),即可以产生次氯酸;Ca(ClO)2+2HCl=CaCl2+2HClO,Ca(ClO)2+CO2+H2O=CaCO3+2HClO。
漂粉精露置于空气中久了会失效,因此应密封保存。
(2)过氧化氢(H2O2):也是一种强氧化剂,可氧化破坏有色物质。
其特点是还原产物是水,不会造成污染。
(3)臭氧(O3)具有极强的氧化性,可以氧化有色物质使其褪色。
(4)浓硝酸(HNO3):也是一种强氧化剂,但由于其强酸性,一般不用于漂白。
(5)过氧化钠(Na2O2):本身具有强氧化性,特别是与水反应时新生成的氧气氧化性更强,可以使有机物褪色。
2、加合型漂白剂:以二氧化硫为典型例子,这类物质能与一些有色物质化合产生不稳定的无色物质,从而达到漂白的目的,但这种化合是不稳定的,是可逆的。
如SO2可以使品红试褪色,但加热排出二氧化硫后会重新变为红色。
另外,此类漂白剂具有较强的选择性,只能使某些有色物质褪色。
[中学只讲二氧化硫使品红褪色,别的没有,注意它不能使石蕊褪色,而是变红。
]3、吸附型漂白剂:这类物质一般是一些具有疏松多孔型的物质,表面积较大,因此具有较强的吸附能力,能够吸附一些色素,从而达到漂白的目的,它的原理与前两者不同,只是一种物理过程而不是化学变化,常见的这类物质如活性炭、胶体等。

各类漂白剂的漂白原理
各类漂白剂的漂白原理可以归纳为以下几种:
1. 氧漂剂:例如过氧化氢、漂白粉等。
氧漂剂可以通过释放氧气来漂白物质。
这种漂白剂会和污渍中的有机物质发生化学反应,将其氧化分解为无色或带有光泽的物质。
2. 氧化漂剂:例如酸性漂白液等。
氧化漂剂通过向物质中引入氧气或其他氧化剂,使其发生氧化反应而漂白。
氧化剂可以将有色物质中的电子转移给自身,从而使有色物质变为无色或色泽淡化。
3. 还原漂剂:例如亚硫酸盐、亚硝酸盐等。
还原漂剂通过向物质中引入电子,还原有色物质的色团,使其失去吸收光的能力而实现漂白。
这种漂白剂的漂白原理是将有色物质中的某些化学键还原断裂,从而破坏其吸收光的特性。
4. 酶类漂白剂:例如含有过氧化酶的洗衣粉。
酶类漂白剂通过特定的酶与污渍中的有机物质发生化学反应,使其分解为无色或较浅色的物质。
这种漂白剂的漂白原理是利用酶的催化作用,加速有机物质的降解反应。
除了以上的漂白原理,不同的漂白剂还可能涉及其他的成分和反应机制。
在使用漂白剂时,应根据具体的材料和污渍特性选择合适的漂白剂,遵循正确的使
用方法和注意事项,以确保安全和有效的漂白效果。

漂白的原理漂白是一种常见的化学处理过程,用于去除物质表面的污渍或改变物质的颜色。
漂白的原理主要是通过氧化或还原反应来改变物质的化学结构,从而达到漂白的效果。
氧化漂白是漂白过程中常见的一种方式。
氧化漂白是指通过氧化剂的作用,将有色物质中的色素分子氧化或分解,使其失去颜色。
常见的氧化剂包括过氧化氢、次氯酸钠等。
在漂白过程中,氧化剂与有色物质发生氧化反应,将有色物质中的双键或杂环结构破坏,使其失去颜色。
氧化漂白通常适用于纤维素类物质,如纸张、纺织品等。
还原漂白是漂白过程中另一种常见的方式。
还原漂白是指通过还原剂的作用,将有色物质中的色素分子还原或分解,使其失去颜色。
常见的还原剂包括亚硫酸盐、硫代硫酸钠等。
在漂白过程中,还原剂与有色物质发生还原反应,将有色物质中的色素还原为无色物质,从而达到漂白的效果。
还原漂白通常适用于含有醛、酮、双键等结构的有色物质。
除了氧化和还原漂白外,还有一些其他的漂白方式,如光漂白、酶漂白等。
光漂白是指利用紫外线或可见光的能量,使有色物质中的色素分子发生光化学反应,从而达到漂白的效果。
酶漂白是指利用酶的催化作用,将有色物质中的色素分子降解或氧化,使其失去颜色。
总的来说,漂白的原理是通过化学反应改变物质的化学结构,使其失去颜色或改变颜色,从而达到漂白的效果。
不同的漂白方式适用于不同的物质,选择合适的漂白方式可以达到更好的漂白效果。
在实际应用中,需要根据物质的性质和漂白的要求选择合适的漂白方式,以达到最佳的漂白效果。
漂白虽然可以改变物质的颜色,但在实际应用中也需要注意保护环境和人体健康。
漂白过程中产生的废水和废气可能对环境造成污染,因此在漂白过程中需要采取相应的环保措施,减少对环境的影响。
另外,一些漂白剂可能对人体健康造成危害,因此在使用漂白剂时需要注意安全,避免接触皮肤和呼吸道。
综上所述,漂白的原理是通过化学反应改变物质的化学结构,不同的漂白方式适用于不同的物质,选择合适的漂白方式并注意环保和安全问题,可以达到更好的漂白效果。

双氧水漂白原理双氧水,化学式H2O2,是一种常见的漂白剂,被广泛应用于纺织品、纸张、食品加工等领域。
那么,双氧水是如何实现漂白的呢?其漂白原理又是怎样的呢?接下来,我们将深入探讨双氧水的漂白原理。
首先,我们来了解一下双氧水的结构和性质。
双氧水是一种无色、无臭的液体,在常温下呈淡蓝色。
它是一种强氧化剂,可以与许多物质发生化学反应。
双氧水的分子结构中含有两个氧原子和两个氢原子,其中的氧原子呈单键连接,使得双氧水分子中的氧原子比水分子中的氧原子更容易释放出来,从而发挥氧化作用。
双氧水的漂白原理主要是通过氧化作用来实现的。
当双氧水与染料、色素或其他有色物质接触时,其中的氧原子会与这些有色物质发生化学反应,使其分子结构发生改变,从而使有色物质失去颜色。
这种氧化作用能够有效地去除物质表面的色素,达到漂白的效果。
另外,双氧水还可以通过分解产生氧气的方式实现漂白。
在双氧水分解的过程中,释放出的氧气能够与有色物质发生氧化反应,进而使其失去颜色。
这种分解产生氧气的方式不仅能够实现漂白效果,还能够减少对环境的污染,因此被广泛应用于纸张和食品加工等领域。
除了氧化作用和分解产生氧气的方式,双氧水还可以通过与金属离子发生氧化还原反应来实现漂白。
在这种反应中,双氧水的氧原子失去电子,从而氧化金属离子,使其发生颜色的改变,达到漂白的效果。
这种氧化还原反应的方式在一些特殊的漂白场合中得到应用,能够有效地去除物质表面的污渍和色素。
总的来说,双氧水的漂白原理主要是通过氧化作用、分解产生氧气和氧化还原反应来实现的。
这些化学反应能够有效地去除物质表面的色素和污渍,使其失去颜色,达到漂白的效果。
双氧水作为一种强氧化剂,具有较强的漂白能力,被广泛应用于纺织品、纸张、食品加工等领域,为人们的生活带来了便利。
通过对双氧水漂白原理的深入了解,我们不仅能够更好地应用双氧水进行漂白,还能够更好地保护环境,减少对环境的污染。
希望本文能够对大家有所帮助,让我们共同学习,共同进步。

漂白物质及原理
漂白物质是一类广泛应用于漂白和去除污渍的化学物质,常见的包括氯漂白剂、氧漂白剂和还原漂白剂等。
1. 氯漂白剂:
氯漂白剂广泛应用于家庭和工业清洁中。
其原理是通过释放氯离子来氧化并分解有色物质,进而去除污渍。
氯漂白剂一般包含次氯酸钠(NaClO)或过氧化氢(H2O2)等化学物质。
氯
离子与有色物质中的双键或结构中的可还原基团发生反应,使其发生裂解或氧化,从而达到漂白的效果。
2. 氧漂白剂:
氧漂白剂常用于漂白纸张、纺织品和食品加工过程中。
最常见的氧漂白剂是过氧化氢(H2O2),其分解产生氧气和水,通
过氧气的氧化作用来去除污渍。
氧漂白剂对于不同类型的污渍具有不同的漂白效果,能够有效降解染料分子的结构,实现漂白的效果。
3. 还原漂白剂:
还原漂白剂主要包括亚硫酸盐和亚硫酸氢钠等化学物质。
还原漂白剂通过具有强还原性的亚硫酸根离子(S2O3^2-)来还原
着色物质,使其失去着色性。
还原漂白剂常用于去除有机污渍,如茶渍、咖啡渍和汗渍等。
其作用原理是还原漂白剂中的亚硫酸根离子与污渍中的色素分子进行化学反应,将其还原为无色物质。

各种漂白剂的漂白原理漂白剂是一种可以去除物体表面颜色的化学物质。
不同种类的漂白剂具有各自的漂白原理。
下面我将介绍几种常见的漂白剂的漂白原理。
1. 氯漂白剂:氯漂白剂是一种常用的漂白剂,其主要成分是含氯化合物,如次氯酸钠。
氯漂白剂的漂白原理是通过氧化反应去除颜色。
在碱性条件下,次氯酸离解为次氯酸根离子和氧气。
次氯酸根离子具有强氧化性,能够与有机色素发生氧化反应,将其还原为无色或淡色物质,从而达到漂白的效果。
2. 过氧化氢漂白剂:过氧化氢漂白剂的主要成分是过氧化氢。
过氧化氢漂白剂的漂白原理是通过氧化反应去除颜色。
过氧化氢能够释放出活性氧,从而导致有机物发生氧化反应,使其颜色褪去。
过氧化氢漂白剂在酸性条件下更容易分解,释放出氧气,因此酸性的过氧化氢漂白剂更容易起到漂白的效果。
3. 硫代硫酸盐漂白剂:硫代硫酸盐漂白剂的主要成分是亚硫酸盐或硫代硫酸盐。
硫酸亚硫酸盐可通过氧化反应发生氧化还原反应,将有机物的色素分子还原为无色物质。
硫代硫酸盐漂白剂的漂白原理可通过亚硫酸根离子(SO3^2-)或硫酸酸根离子(S2O3^2-)对有机物色素产生还原作用,去除颜色。
4. 臭氧漂白剂:臭氧漂白剂的主要成分是臭氧。
臭氧漂白剂的漂白原理是通过氧化反应去除颜色。
臭氧是一种强氧化剂,能够与有机物发生氧化反应,将其颜色褪去。
臭氧漂白剂常常用于漂白纸浆和纺织品等领域。
需要注意的是,不同种类的漂白剂具有不同的适用范围和使用条件。
在使用漂白剂时,需要根据被处理物体的特性选择合适的漂白剂,并按照使用说明正确使用,以避免产生不良反应或危害人体健康。
此外,漂白剂的使用也应遵循环保原则,减少对环境的污染。
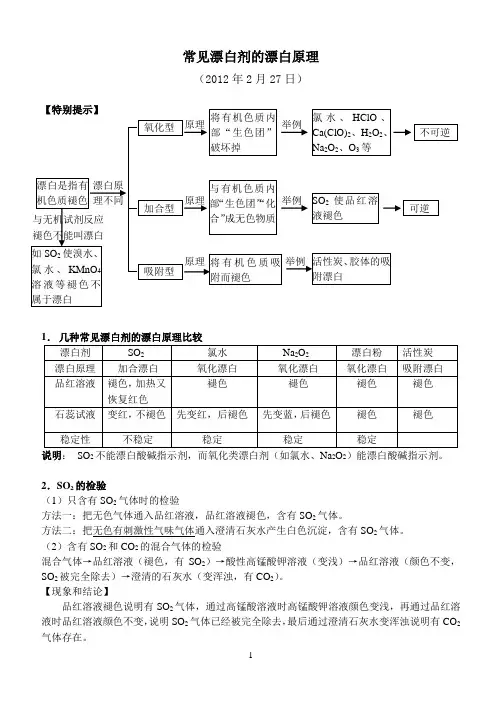
常见漂白剂的漂白原理(2012年2月27日)说明:SO2不能漂白酸碱指示剂,而氧化类漂白剂(如氯水、Na2O2)能漂白酸碱指示剂。
2.SO2的检验(1)只含有SO2气体时的检验方法一:把无色气体通入品红溶液,品红溶液褪色,含有SO2气体。
方法二:把无色有刺激性气味气体通入澄清石灰水产生白色沉淀,含有SO2气体。
(2)含有SO2和CO2的混合气体的检验混合气体→品红溶液(褪色,有SO2)→酸性高锰酸钾溶液(变浅)→品红溶液(颜色不变,SO2被完全除去)→澄清的石灰水(变浑浊,有CO2)。
【现象和结论】品红溶液褪色说明有SO2气体,通过高锰酸溶液时高锰酸钾溶液颜色变浅,再通过品红溶液时品红溶液颜色不变,说明SO2气体已经被完全除去,最后通过澄清石灰水变浑浊说明有CO2气体存在。
【发散思维】常用来鉴别和分离SO2与CO2的装置上述装置中各部分的作用:A.检验SO2的存在B.除去SO2气体C.检验SO2气体是否除去,并进一步吸收SO2D.检验CO2气体并吸收3.SO2与CO2的鉴别方法品红溶液溴水酸性KMnO4溶液FeCl3溶液氢硫酸溶液SO2褪色褪色紫色褪去黄色变为浅绿色淡黄色混浊CO2不褪色无明显现象无明显现象无明显现象无明显现象叠加化学反应方程式的计算技巧有些反应体系不只涉及一个反应,且不同的反应之间存在着某种联系,对于这样的反应体系,叠加化学反应方程式可使要解决的问题简便、明了。
叠加化学反应方程式的关键是量的关系的衔接和确定,确定量的关系常用待定系数法,它的理论依据是质量守恒。
例1:用1 L 1.0mol/L的NaOH溶液吸收0.8 mol的SO2,所得溶液中的SO32-和HSO3-的物质的量的浓度之比最接近于()A.2:1 B.1:3 C.3:2 D.2:3解析:评注:(1)若不用叠加方程式解题,则可根据SO2+2NaOH==Na2SO2+H2O和SO2+NaOH==NaHSO3两个化学反应方程式,通过列方程组求解。

高考化学漂白知识点总结一、漂白的定义漂白是指通过化学方法去除物质中的颜色、污渍或杂质的过程。
漂白可以分为氧化漂白和还原漂白两种方式。
氧化漂白是指通过氧化反应使染色质氧化而脱色,还原漂白则是指通过还原反应使染色质还原而脱色。
二、漂白剂的种类1. 氯漂白剂:大气中的氯气和水生成的次氯酸溶液,次氯酸钠和次氯酸钙。
2. 臭氧漂白剂:臭氧气体。
3. 过氧化氢漂白剂:过氧化氢溶液。
4. 硫代硫酸盐漂白剂:亚硫酸氢钠和硫代硫酸钠。
三、漂白原理1. 氯漂白剂原理:次氯酸可以氧化分子中的双键,氧化染料使其脱除色。
同时也可以分解有机物,氧化染色物使其脱除色。
2. 臭氧漂白剂原理:臭氧能将染料中的双键氧化,或通过和分子中某些固定位置的双键分子发生加成反应而发生分子的裂解,使其变得无色。
3. 过氧化氢漂白剂原理:过氧化氢本身在水溶液中是不稳定的,它可以分解为活性自由基,自由基氧化染料使其脱除色。
4. 硫代硫酸盐漂白剂原理:亚硫酸氢根离子和双氧-亚硫酸根离子能与染料中的双键发生加成反应,活化染料分子,或起到还原作用,使其脱色。
四、漂白剂的应用1. 漂白衣物:在日常生活中,漂白剂常用于漂白衣物,以去除衣物上的污渍或变黄的部分。
2. 消毒食品:漂白可以杀菌消毒,使食品更加安全可靠。
3. 清洁环境:漂白剂也可以用于清洁户外场所,去除一些难以清洁的环境污染。
五、高考化学漂白的考点和解题技巧1. 理解漂白的原理和机制,掌握漂白剂的种类及其化学反应过程,例如次氯酸的生成和分解反应,次氯酸和染料中双键的氧化反应等。
2. 掌握漂白剂的应用场景和具体操作步骤,如何使用次氯酸或过氧化氢来漂白衣物、清洁环境等。
3. 掌握漂白相关的化学方程式,如次氯酸钠和氯气的反应方程,过氧化氢水溶液分解的反应方程等。
4. 注意漂白剂的化学性质和用途之间的关系,考查漂白剂是否可以氧化某种物质或还原某种物质的反应类型。
总之,在高考化学中,漂白是一个重要的考试内容,学生需要理解漂白的原理和机制,掌握漂白剂的种类和化学反应过程,掌握漂白剂的应用场景和具体操作步骤,掌握漂白相关的化学方程式,注意漂白剂的化学性质和用途之间的关系等,才能更好地应对考试中的相关题目。

过氧化氢的漂白原理
过氧化氢是一种常见的漂白剂,其漂白原理主要是通过氧化作
用来去除物质表面的颜色。
过氧化氢的分子结构中含有两个氧原子,因此它具有较强的氧化性,可以与许多有机物和无机物发生氧化反应,从而达到漂白的效果。
过氧化氢在漂白过程中,首先会释放出氧气,氧气的释放会产
生气泡,从而使被漂白的物质表面产生冲击力,将颜色颗粒冲离物
质表面,使其变得洁白。
同时,过氧化氢还会与色素分子中的双键
或芳香环发生氧化反应,破坏色素分子的结构,使其失去颜色。
这
种氧化反应是通过过氧化氢分子中的氧原子与被漂白物质中的化学
键发生反应而实现的。
在漂白过程中,过氧化氢还会与某些金属离子发生反应,形成
不稳定的过氧化物质,这些过氧化物质会进一步与色素分子发生氧
化反应,加速漂白的过程。
此外,过氧化氢还可以通过氧化还原反
应来改变被漂白物质的化学结构,使其失去颜色。
需要注意的是,过氧化氢的漂白效果受到许多因素的影响,如
温度、pH值、浓度等。
一般来说,较高的温度和较高的浓度会加速
过氧化氢的分解和反应速率,从而提高漂白效果。
而酸性条件下过氧化氢的漂白效果更好,因为酸性条件下过氧化氢更容易分解释放出氧气。
总的来说,过氧化氢的漂白原理是通过氧化作用来去除物质表面的颜色,其漂白效果受到多种因素的影响。
了解过氧化氢的漂白原理,有助于我们在日常生活和工作中更好地使用过氧化氢进行漂白,从而达到更好的漂白效果。
12.部编七下语文第六单元“语言简明”同步作文教/学案【话题导入】春去秋来,每一片叶都有它的故事;风雷雨雪,每一个人都有独特的感受。
有时候,一滴雨让你思绪纷飞;有时候,一个人让你感慨万千;有时候,一个瞬间让你难以忘怀;有时候,一个误会让你彻夜难眠。
怎样才能简洁扼要地记录生活故事?怎样才能简洁明了地抒写生活感受?怎样才能清楚明白地解释误会呢? 这就要求我们在作文时,语言要尽可能精练,不重复、啰唆,同时,表达的意思又要清楚明白,不让人产生误解。
【目标要求】1.学会锤炼语言,力争做到语言简明。
2.学会围绕中心展开话题,语言简明,要言不烦,并有一定的感染力。
3.能够运用多种方法构思行文,使文章跌宕起伏。
【名家领航】一件小事鲁迅我从乡下跑到京城里,一转眼已经六年了。
其间耳闻目睹的所谓国家大事,算起来也很不少;但在我心里,都不留什么痕迹,倘要我寻出这些事的影响来说,便只是增长了我的坏脾气,——老实说,便是教我一天比一天的看不起人。
(从“所谓国家大事”在“我”心里都不留什么痕迹写起,目的是引出并凸显下文所写一件小事队“我”心灵的冲击。
)但有一件小事,却于我有意义,将我从坏脾气里拖开,使我至今忘记不得。
(承上启下,概括说明“至今忘记不得”一件小事的真正原因。
)这是民国六年的冬天,大北风刮得正猛,我因为生计关系,不得不一早在路上走。
一路几乎遇不见人,好容易才雇定了一辆人力车,叫他拉到S门去。
不一会,北风小了,路上浮尘早已刮净,剩下一条洁白的大道来,车夫也跑得更快。
刚近S门,忽而车把上带着一个人,慢慢地倒了。
(交代事件发生的时间、地点等。
)跌倒的是一个女人,花白头发,衣服都很破烂。
伊从马路上突然向车前横截过来;车夫已经让开道,但伊的破棉背心没有上扣,微风吹着,向外展开,所以终于兜着车把。
幸而车夫早有点停步,否则伊定要栽一个大筋斗,跌到头破血出了。
(描述车子带人倒地这一事故发生的情形,为下文做铺垫。
)伊伏在地上;车夫便也立住脚。
漂白的各个原理漂白,也叫白化处理,是一种技术,旨在去除物料表面的颜色,可以提高物料的美观性,增加其商业附加值。
现行的技术有氯漂白,氧化漂白,光照漂白,水下化学漂白,水下光学漂白,水浴漂白等。
氯漂白时,使用的漂白剂是氯化氢,使其作用于物料的表面上的颜色分子,并无损害表面整体属性。
通常将物料放入漂白液中,在高温清洗和冷却后,如微波消毒则可使其苯甲酰混合物发生变化,形成有机磷水溶液,从而达到漂白的目的。
氧化漂白也叫电解漂白,原理是使用氧化剂,如过氧乙酸、过氧化氢等,加热到物料表面,当有机物被氧化后,溶解并转化为单组份,从而实现白色或要求的颜色。
光照漂白,它的原理是使用特定的光源去处理物料,如紫外线、紫外线灯等,使紫外线氧化物料表面的颜色分子,紫外线处理常用温度为180℃,时间为60分钟。
由于光的吸收作用,物料表面的颜色会逐渐改变,基质变白,它是一种无高温环境的环保技术。
水下化学漂白,它是将化学漂白剂直接加入水中,通过物料表面的层间反应,氯漂白剂可无损害材料地去除其颜色分子,使物料变得白色,有利于提高商品档次,促进销售。
水下光学漂白,它是将紫外线源加入水中,进行照射直接作用于物料表面,从而达到去除颜色的目的。
由于紫外线的特性,它的处理主要以改变物料的表面结构为主,例如低温,不会影响物料的属性特性,是一种世袭环保技术。
最后,水浴漂白技术是将漂白剂溶解于清水中,将物料放入其中,经冷却、滤棉清洗后,将漂白剂与悬浮物形成反应,从而冲洗掉物料表面的颜色物质,使物料变白,从而提高商业价值。
总之,漂白是一种技术,多种技术原理均可使物料变白,从而增加商业价值。
漂白剂的种类和漂白原理漂白剂是一种化学物质,可以将物体上的色素或杂质去除,使物体变得更加白净。
常见的漂白剂有氯漂白剂、过氧化氢、过氧化物等。
漂白剂常用于清洁和美白纺织品、纸张和其他物品。
1.氯漂白剂:氯漂白剂是最常见、最广泛使用的漂白剂。
氯漂白剂通常以含氯化合物形式存在,如次氯酸钠、次氯酸钙等。
在水中溶解后,氯漂白剂会释放出氯离子,氯离子与物体表面的色素或杂质反应,将其氧化分解,从而起到漂白的效果。
2.过氧化氢:过氧化氢漂白剂也常被称为氧漂白剂。
过氧化氢溶液可以直接用于漂白,也可以作为其他漂白剂的成分之一、过氧化氢通过释放氧气来漂白物体表面的色素或杂质。
过氧化氢也常用于医疗和消毒领域。
3.过氧化物:过氧化物是一类化学物质,包括过硫酸盐和过氧化物。
过氧化物可以被用作漂白剂,并且在一些特殊的应用中拥有较高的效果。
过硫酸盐和过氧化物在水中溶解后会释放活性氧,从而氧化漂白物体表面的色素或杂质。
漂白剂的原理:漂白剂的原理可以归结为两个主要的化学反应:氧化和光解。
1.氧化反应:漂白剂通过释放氧气氧化漂白物体上的色素或杂质。
这种氧化反应会分解色素分子的结构,破坏其对可见光的吸收,从而达到漂白的效果。
氯漂白剂、过氧化氢和过氧化物都能通过氧化反应来起到漂白的作用。
2.光解反应:漂白剂中的一些化学物质在受到光照时,会发生光解反应,产生氢氧根离子(OH-)。
氢氧根离子具有强氧化性,可以进一步氧化色素分子或杂质,从而实现漂白的效果。
光解反应常见于过氧化氢和过氧化物等漂白剂中。
此外,漂白剂还可通过其他方式起到漂白的效果,如与漂白物体上的色素形成不溶的复合物,从而使色素离开物体表面,达到漂白的目的。
总结起来,漂白剂通过氧化或光解等化学反应,能够分解漂白物体表面的色素或杂质,使物体变得更加白净。
不同的漂白剂根据原理不同,具有不同的适用性和漂白效果。
在使用漂白剂时,需要注意其使用方法和浓度,以免造成不必要的伤害。
漂白粉的漂白原理化学方程式漂白粉,又称氯漂粉,是一种常见的漂白剂,广泛应用于日常生活和工业生产中。
它能够有效地去除衣物、纸张等物品上的污渍,使其恢复洁净和明亮。
那么,漂白粉是如何实现漂白的呢?其漂白原理又是什么?下面我们将通过化学方程式来深入探讨漂白粉的漂白原理。
漂白粉的主要成分是次氯酸钠(NaClO),它是一种强氧化剂。
在漂白过程中,次氯酸钠会释放出活性氧,与染料或污渍发生氧化反应,使其分子结构发生改变,从而达到漂白的效果。
具体的化学方程式如下:1. 次氯酸钠的分解反应。
NaClO → NaCl + O。
在上述反应中,次氯酸钠分解为氯化钠和游离的氧。
这个游离的氧就是漂白粉漂白的关键。
2. 活性氧的氧化反应。
O + 染料→染料氧化产物。
活性氧与染料发生氧化反应,使染料分子中的双键或芳香环结构发生断裂,从而使染料变得无色,达到漂白的效果。
除了与染料发生氧化反应外,漂白粉还可以与有机物发生氧化反应,将其分解为无害的物质,起到除臭、消毒的作用。
因此,漂白粉不仅可以用于漂白衣物和纸张,还可以用于清洁和消毒厨房、卫生间等场所。
需要注意的是,漂白粉在使用过程中要小心避免与酸性物质混合,因为酸性物质会使次氯酸钠分解释放出有毒的氯气。
此外,漂白粉也不宜与易燃物质接触,以免引发火灾。
总之,漂白粉的漂白原理是利用次氯酸钠分解释放出的活性氧与染料或污渍发生氧化反应,使其分子结构发生改变,达到漂白的效果。
通过化学方程式的分析,我们更加深入地理解了漂白粉的漂白原理,也更加明白了在使用漂白粉时需要注意的事项。
希望本文能够对大家有所帮助,谢谢阅读!。
重难点6 常见漂白性物质及漂白原理1、漂白剂的类型及漂白原理类型原理特点举例氧化型漂白剂本身是氧化剂,利用其氧化性氧化有色物质,使之失去原有的颜色加热时不能恢复原有的颜色NaClO、Ca(ClO)2、HClO、H2O2、O3等化合型漂白剂与有色物质结合生成新的无色物质,使之失去原来的颜色加热时能恢复原来的颜色二氧化硫等吸附型有些固体物质疏松、多孔,具有较大的比表面积,可以吸附无色物质使之失去原来的颜色部分吸附剂可以重复使用活性炭、胶体等2、SO2和Cl2漂白比较(1)(2)特别提醒(1)二氧化硫的三种“褪色”:①二氧化硫能使品红褪色表现漂白性;②使溴水、氯水及酸性高锰酸钾溶液褪色体现还原性;③使滴有酚酞的氢氧化钠溶液褪色说明其水溶液呈酸性。
(2)SO2不能漂白紫色石蕊溶液、含酚酞的NaOH溶液,而氯水能漂白。
(3)检验SO2气体的方法是将气体通入品红溶液,溶液褪色后加热又恢复到红色。
★★★【重难点考向一】二氧化硫的漂白性【例1】能证明SO2具有漂白性的是( )A.酸性KMnO4溶液中通入SO2气体后,紫色消失B.显红色的酚酞通入SO2后,红色消失C.品红溶液中通入SO2后,红色消失D.溴水中通入SO2后,橙色消失【答案】C【重难点考向二】氯气与SO2漂白原理的区分【例2】下列说法正确的是( )A.SO2能使品红溶液、溴水和酸性KMnO4溶液褪色,是因为SO2具有漂白性B.SO2、Cl2都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质时,可增强漂白效果C.活性炭使有色物质褪色是利用了碳单质的还原性D.SO2使品红溶液褪色后,将褪色后的溶液加热,溶液重新变为红色【答案】D【解析】SO2能使品红溶液褪色,表现SO2的漂白性,SO2能使溴水和酸性KMnO4溶液褪色表现SO2的还原性,A项不正确;当SO2、Cl2等物质的量同时作用于潮湿的有色物质时,发生以下反应:Cl2+SO2+2H2O=2HCl+H2SO4,失去漂白作用,B项不正确;活性炭使有机物褪色利用了碳的吸附性,C项不正确;SO2与品红结合成不稳定的无色物质,加热后又分解成原来的品红,故D项正确。
漂白粉的作用和原理
漂白粉(又称氯漂粉)是一种常用的漂白剂,主要用于漂白衣物、食品加工以及消毒等方面。
它的主要成分是次氯酸钠(NaClO),可以通过以下两个过程来实现漂白效果:
1. 氧化作用:次氯酸钠中的次氯酸(HClO)能够从漂白粉中释放出来,它可以与污渍中的有机物相互作用,发生氧化反应,将彩色物质还原为无色化合物,因此可以去除衣物上的污渍或食品上的颜色。
2. 氯离子作用:氯离子(Cl-)可以和有机物中的染料或色素形成络合物,改变该物质的光学特性,使其变得无色或呈现淡色。
总的来说,漂白粉的作用机理主要是通过次氯酸的氧化作用以及氯离子的络合作用来实现漂白效果。