实验五 富马酸二甲酯的制取
- 格式:ppt
- 大小:208.50 KB
- 文档页数:11

富马酸二甲酯的合成学院:化学化工学院班级:09级应化(二)班姓名:张晓丽12009240215余翔12009240254雍明 12009240244摘要:目前国内外使用于食品和饲料的防腐防霉剂主要有苯甲酸、山梨脱氢醋酸、丙酸、柠檬酸、乳酸及它们的盐类等。
这些产品有的抗菌谱较窄、效果较差、应用pH值范围也较窄,有的价格较高。
如丙酸钙和山梨酸及其盐的使用,在酸性条件下效果交好,使用范围受到了限制,苯甲酸及其钠盐因对人体有害在美国及其他发达国家已提出进用。
富马酸二甲脂是当今食品工业被世界卫生组织批准公认的新型食品防腐剂。
由于马来酸酐廉价易得且成本低,本实验对富马酸和甲醇直接进行酯化反应合成富马酸并对反应条件进行了研究。
关键词富马酸富马酸二甲酯酯化前言:富马酸二甲酯简称DMF是一种新的食品防腐剂,它克服了上述产品的缺点,具有高效、毒性低、价廉、耐热性能好、pH值应用范围广泛等优点,是一种具有熏蒸作用的气氛型防霉剂。
不仅可用于食品饲料、水果、蔬菜、粮食的防霉杀虫,而且还可用于皮革、化妆品、纺织品、制药等行业中。
国内研究表明〔1〕,富马酸二甲酯具有较好的抗菌能力,对于饲料防腐防霉效果优于山梨酸、苯甲酸、丙酸及其盐类的防腐剂。
富马酸二甲酯的毒性底,属于敌蓄积性的物质,无致畸突变作用,进入人体后很快转变成正常代谢产物富马酸,无富马酸二甲酯残留物,因此应用的安全性很高,由于富马酸二甲酯的成本底、价格便宜、用途广泛,因而它是一个很有发展前途的防腐防霉剂。
由于马来酸酐廉价易得且成本低,本实验是对富马酸和甲醇直接进行酯化反应合成富马酸并对反应条件进行了研究。
正文1、 仪器及实剂1.1 仪器:三口瓶 搅拌器 温度计 球形冷凝管 滴液漏斗等1.2 药品:富马酸 甲醇 NaOH 浓硫酸2、实验原理DMF 可由糠醛氧化或由马来酸酐水解,在浓盐酸中异构化制得富马酸,然后与甲醇进行酯化而得。
本实验采用方法“2”和下列反应制得DMF:此种方法操作简便,原料易得,反应条件易掌握,成本低,收率高。


富马酸二甲酯的制备摘要以马来酸酐为原料合成富马酸二甲酯,马来酸酐在酸性条件下异构化,并与甲醇酯化成富马酸二甲酯.采用三因素三水平正交实验法探讨催化剂,反应配比,反应时间对产率的影响.试验得出最优条件为:马来酸酐5g,与甲醇摩尔比1:4,回流1h ,1mL浓HCl作催化剂,产率79.3%.关键词马来酸酐;甲醇;正交法;富马酸二甲酯前言富马酸二甲酯(Dimethyl Fumarate ,DMF),分子式为C6H8O4,又称为反丁烯二酸二甲酯,白色结晶,略有酯香味,熔点103-104℃,沸点193℃,溶于乙醇,乙酸乙酯,氯仿,微溶于水,常温下可以升华,对光和热稳定,在紫外线和阳光照射下72h基本无变化,110℃加热2h不分解.富马酸二甲酯的合成方法主要有以下几种:1、马来酸和甲醇直接酯化合成;2、经盐酸-硫酸或盐酸-磷酸为催化剂 ,在马来酸或马来酸酐甲醇体系中进行异构酯化反应合成;[1\2]3、以酸催化马来酸酐水解异构化合成富马酸 ,然后使用催化剂 ,富马酸和甲醇酯化合成.本实验采用以马来酸酐为原料 ,合成富马酸二甲酯的反应,反应如下:通过正交实实验探究催化剂种类、反应时间和反应酸酯的配比对富马酸二甲酯的产率的影响,共设置了9个实验,探究各个因素对反应产率的影响,得出最佳反应条件,并在最佳反应条件下制备富马酸二甲酯.1 实验1.1实验仪器与试剂1.1.1试剂及用量马来酸酐45g;甲醇(Ar)120mL;三氯化铁(Ar) 3g;浓盐酸(Ar)3mL;浓硫酸(Ar)3mL;冰水.1.1.2仪器三颈烧瓶;温度计;蒸馏装置;抽滤瓶;布氏漏斗1.2实验内容与步骤在装有回流装置和温度计的三颈烧瓶中按正交实验表各组反应条件,加入马来酸酐与甲醇 ,以及催化剂 ,加热回流一定时间 ,温度保持在102℃左右.[1]待反应结束后 ,蒸出过量的甲醇 , 在搅拌下,将剩余物倒入5 倍于剩余物的冰水烧杯中 ,外部用冰水冷却至 5 ℃左右 ,继续搅拌结晶 ,待结晶完全后抽滤,经洗涤和干燥得到产品,称重,计算产率[3].根据正交表选出最优反应条件.2 实验现象浓硫酸做催化剂:试验号为1产物为浅棕色粉末,2、3号产物为乳白色粉末,并混有少量白色鳞片状晶体.浓盐酸作催化剂:均为白色粉末,并混有少量白色鳞片状晶体.氯化铁作催化剂:均为浅黄色粉末.3 结果与讨论3.1 通过正交试验选择最佳酯化条件为了综合探讨反应时间,摩尔配比,及催化剂对反应产率的影响,采用L9(34)表进行实验.因素水平表见表1,实验结果分析见表2.[2]表1 酯化反应正交试验因素水平表水平因素催化剂类型A酸酐和醇的摩尔比B反应时间(h)C1 2 3 H2SO4HClFecl31:4(8.3mL)1:6(12.4mL)1:8(16.5mL)0.51.02.0注:马来酸酐用量5g.表2 酯化反应正交试验结果分析表实验号水平组合 催化剂类型 摩尔比 时间A B C产率 (%)负责人1 A1B1C1 H2SO4 1:4 0.5 2.73 陈玉玲2 A1B2C2 H2SO4 1:6 1.0 5.47 陈玉玲3 A1B3C3 H2SO4 1:8 2.0 5.47 陈玉玲 4 A2B1C2 HCl 1:4 1.0 65.66 杨诗妮5 A2B2C3 HCl 1:6 2.0 56.09 杨诗妮 6 A2B3C1 HCl 1:8 0.5 53.35 杨诗妮7 A3B1C3 Fecl3 1:4 2.0 4.10 黄沛敏8 A3B2C1 Fecl3 1:6 0.5 0.00 黄沛敏9 A3B3C2Fecl3 1:8 1.0 9.58黄沛敏Ⅰ 13.67 72.49 56.08 最优条件Ⅱ 175.1 61.56 80.78 A2B1C2Ⅲ 13.68 68.4 65.66 K1 4.56 24.16 18.69 K2 58.37 20.52 26.93 K3 4.56 22.8 21.89 R53.813.648.24经极差分析,各因素对反应产率影响因素顺序为:催化剂类型>反应时间>摩尔配比.[4]此反应最优条件为A2B1C2,既是浓盐酸催化、1h 回流、摩尔配比1:4时反应最优.按最优条件进行实验,取5g 马来酸酐,制的干燥的富马酸二甲酯5.8g,产率为79.3%,为全部试验中产率最高的.3.2 催化剂对反应产率的影响表3 催化剂类型对反应产率的影响催化剂 H2SO4 HCl Fecl3K 值 4.56 58.37 4.56由表3可知,HCl 作催化剂催化时产率最高,不易形成油状物,且蒸出甲醇时温度要求不高,且产品外观好,白色粉末,并混有少量白色鳞片状晶体.H2SO4催化产率低,蒸出甲醇时,温度过高极易碳化,造成产品颜色加深,故需严格控制温度,此部分实验较麻烦且耗时多,易形成油状物而得不到固体.Fecl3催化产物颜色偏黄,杂质较多,FeCl3易水解形成胶状物,极易形成油状物而得不到晶体.故实验得出结论,浓HCl为最优催化剂.3.3 摩尔配比对反应产率影响图1 摩尔配比对反应产率影响由图1可知酸酐、醇摩尔配比1:4时,K值最大,既产率最大,1:6时产率较低,而1:8时产率与1:4时相当,但蒸出甲醇时需要蒸出大量甲醇,造成药品浪费,三个配比均为醇过量,故选用1:4时产率较高且成本较低.3.4 回流时间对反应产率的影响图2 回流时间对反应产率影响由图2可知,回流1小时产率最大,回流0.5小时反应尚未完全,产率较低,而回流2小时产率变化不大,但耗时较长,故最优条件为回流1小时.3.5 综合讨论3.5.1实验步骤设计回流温度为102℃,但实验时回流温度只有80-90℃,原因是甲醇与马来酸形成共沸物而导致回流温度上升不去,对实验探讨最优条件影响不大,控制全部反应温度基本一致即可.3.5.2在用冰水冷却产品时应将热的溶液倒入装有5倍冰水的烧杯中,而不可把冰水倒入热的溶液中,把冰水倒入热的溶液中会导致产品结块,产品粘在烧杯底部,造成产品损失. 3.5.3实验过程蒸出甲醇应尽可能蒸的干净,且用浓硫酸作催化剂蒸出甲醇的过程要小心控制温度,甲醇是有机溶剂,甲醇残留过多会溶解部分产物,导致产率降低.3.5.4第8号实验产物为红棕色油状,得不到白色粉末,用力震荡后油状物消失,加入富马酸二甲酯晶体促进结晶也得不到固体产物,原因可能是FeCl3水解形成胶体导致无法形成固体产物.经讨论,可尝试将热的溶液直接静置冷却结晶,不用冰水进行冷却.4 结果通过正交试验得出数据进行极差分析,各因素对反应产率影响因素顺序为:催化剂类型>反应时间>摩尔配比,进行分析得出此反应最优条件为:浓盐酸催化、1h回流、摩尔配比1:4时反应最优.按最优条件进行实验,制取富马酸二甲产率为79.3%,与理论最佳条件相符.参考文献:[1] 石辉文,蔡峰.富马酸二甲酯的合成[J].应用化工,2003(32):36-37[2] 苏秋芳,陈少华.富马酸二甲酯的合成工艺研究[J].化学工程师,1999(71):9-11[3] 范国枝. 富马酸二甲酯的合成工艺研究[J].应用化工,2004(33):44-46[4] 马鸿飞. 富马酸二甲酯的合成研究[J].化工时刊,2005(19):18-19[5] 岳志超,伍洲,宋维峰. 富马酸二甲酯的合成与应用[J].化工之友,2001(3):30[6] 新型食品防腐剂富马酸二甲酯的合成[J].化学工程与装备,2008(7):27-28富马酸二甲酯的制备学生姓名:陈玉玲学号:20082401215组员姓名:杨诗妮黄沛敏专业:化学教育年级班级:2008级化教5班指导老师:陶敬奇。
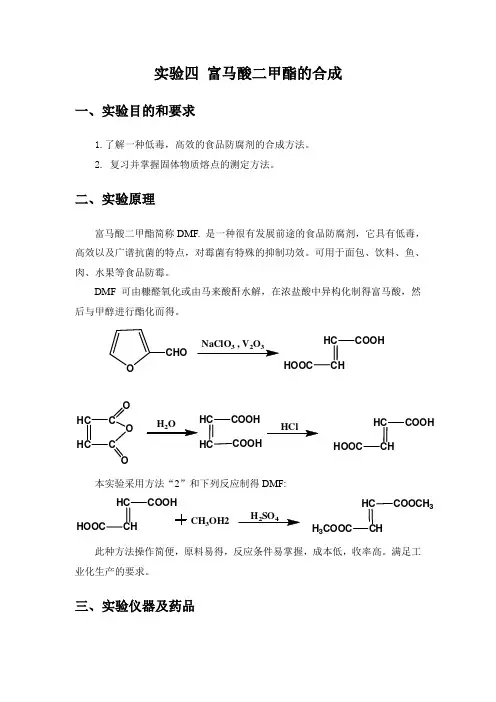
实验四 富马酸二甲酯的合成一、实验目的和要求1.了解一种低毒,高效的食品防腐剂的合成方法。
2. 复习并掌握固体物质熔点的测定方法。
二、实验原理富马酸二甲酯简称DMF. 是一种很有发展前途的食品防腐剂,它具有低毒,高效以及广谱抗菌的特点,对霉菌有特殊的抑制功效。
可用于面包、饮料、鱼、肉、水果等食品防霉。
DMF 可由糠醛氧化或由马来酸酐水解,在浓盐酸中异构化制得富马酸,然后与甲醇进行酯化而得。
本实验采用方法“2”和下列反应制得DMF:此种方法操作简便,原料易得,反应条件易掌握,成本低,收率高。
满足工业化生产的要求。
三、实验仪器及药品OCHOHC CHHOOCCOOHHC HCC CO OHC COOHCOOH HC HOOCCOOHHC HOOCCOOHCH 3OH2HCCOOCH 3H 3COOC250 ml 四颈瓶,球型冷凝管,恒压滴液漏斗,温度计,量筒(10ml, 20ml, 50ml各一个),天平,抽滤瓶,布氏漏斗,直型冷凝管,玻璃棒,水环真空泵,恒温磁力搅拌器,搅拌子。
马来酸酐,浓盐酸,甲醇,浓硫酸,蒸馏水,乙醇。
四、实验方法1.马来酸酐水解为马来酸再转化成富马酸。
在装有回流冷凝管及恒温磁力搅拌器的250ml四颈瓶中,加入9.8 g马来酸酐和15 ml水,恒温使马来酸酐完全溶解(一般在50-55℃),保温5分钟,再逐渐升温至78℃,保持10分钟,然后用恒压滴液漏斗分4次慢慢滴入20ml浓盐酸,在80—90℃保温30分钟,反应过程中有富马酸从热溶液中结晶析出,反应完全后冷却,抽滤得富马酸。
2.富马酸二甲酯的制备将上述得到的富马酸及30ml甲醇加入上述反应器,使反应温度逐渐升至78℃,保温10—15分钟,然后将0.6ml浓硫酸分次滴入反应器中,然后保温回流3小时左右,待反应完全后,蒸出大部分甲醇,趁热将反应产物倒入盛有50 ml 冷水的100 ml 烧杯中,此时有大量固体析出,然后用10%NaHCO3中和未反应的H+,直到没有气泡产生为止,抽滤,用蒸馏水洗涤得粗产品。

有机实验报告(富马酸二甲酯的制备)一、实验目的2.了解了解酯化反应的基本原理和反应条件。
3.学会使用相关实验仪器和设备。
二、实验原理富马酸二甲酯是甲酯的其中一种,通过酯化反应得到。
反应中,甲酸和富马酸缩合成含有羧酸功能基团的二元羧酸,然后与甲醇反应生成甲酯。
反应需要使用一定量的酸催化剂,例如硫酸、磷酸等。
反应式:CH3OH + HOOC(CH2)2COOH → CH3OOC(CH2)2COOH + H2OCH3OOC(CH2)2COOH + CH3OH → CH3COOCH3 + HOOC(CH2)2COOH三、实验步骤1. 在滴加漏斗中加入富马酸(0.021 mol)和甲酸(0.018 mol),加入少量丙酮混合。
将混合物转移到容量为50ml的圆底烧瓶中,在磁力搅拌下加热至70℃。
2. 在加热过程中,将硫酸(催化剂)加入到滴加漏斗中。
3. 一旦反应混合物达到了70℃,立刻开始缓慢地将硫酸滴加到反应体系中,并保持反应体系在温度为70℃。
4. 滴加约15分钟后,将滴加漏斗中的硫酸完全滴入反应体系中。
然后反应体系保持70℃反应,直到反应完成。
5. 至此,反应已经完成,得到的产物为一种无色液态物质。
将产物抽取到干燥的烧杯中,并进行蒸馏。
蒸馏温度为125~128℃,收集温度在125~128℃之间的产物。
四、实验结果1. 实验中,滴加了硫酸催化剂之后,反应混合物的温度逐渐上升。
当温度达到70℃时,滴加漏斗中的硫酸开始滴入反应体系,继续加热,直到反应完全完成。
整个反应体系看起来类似于透明的液体。
2. 经过蒸馏,得到的产物为透明的液体,物质相对分子质量为174.2g/mol,收集率约为82%。
五、实验讨论1. 在本次实验中使用的是硫酸作为催化剂,其催化效果足以加速酯化反应,但应注意不要加入过多的催化剂,否则将导致物质结构的变形。
2. 在反应过程中,反应液的温度应控制在70℃左右。
过高的温度会导致反应失效,而过低的温度则会降低反应速度。

富马酸及其二甲酯实验报告实验目的:了解富马酸及其二甲酯的性质和反应特点,掌握其制备方法及检测方法。
实验原理:1.富马酸是一种含羧酸的有机化合物,其化学式为HO2CCH=CHCO2H。
由于具有不对称性,因此其有两种异构构型:顺式富马酸和反式富马酸。
富马酸在水中会形成环状分子,称为内酰亚胺。
2.富马酸二甲酯是一种有机酯类,其化学式为(CH3O2CCH=CHCO2CH3)。
在甲苯和丙酮的混合溶剂中可得到两种异构体:顺式富马酸二甲酯和反式富马酸二甲酯。
富马酸二甲酯可用于合成多种化学物质,如涂料、塑料、树脂等。
实验步骤:1.富马酸制备:取适量顺式富马酸二甲酯,加入1mol/L的乙醇钠溶液中,搅拌30分钟,过滤固体,用乙酸酐水解,得到富马酸。
2.富马酸二甲酯制备:取适量富马酸、甲醇和稀硫酸加入三口瓶中,插入冷却器和磁力搅拌器,在冰水浴中搅拌反应15分钟,过滤得到去除残留硫酸的混合物。
加入适量NaHCO3溶液,使反应停止,并得到富马酸二甲酯。
反应式为:HO2CCH=CHCO2H + CH3OH → CH3O2CCH=CHCO2CH3 + H2O3.检测方法:用红色酚酞-盐酸溶液滴定,可以检测富马酸在酸性溶液中的酸量。
用氢氧化钠-乙酸酐溶液滴定,可检测富马酸二甲酯中羧酸酯的含量。
实验分析:富马酸属于无色晶体,具有酸味,容易溶于水和乙醇,不溶于乙醚和丙酮。
富马酸二甲酯为无色液体,具有水果香味,密度为1.13g/ml,沸点为174℃。
通过本次实验,我们成功制备了富马酸和其二甲酯,并通过滴定法检测到它们的性质和含量。
实验结论:富马酸和其二甲酯是重要的有机化合物,具有广泛的应用前景。
本次实验通过制备和检测,使我们更深入地了解了它们的化学性质和反应特点。


2023年有机实验报告富马酸二甲酯的制备引言科学实验是推动人类发展的重要力量,而有机实验更是如此。
在2023年,我们进行了一项关于富马酸二甲酯的制备的实验,本报告旨在介绍实验的过程和结果。
实验背景富马酸二甲酯是一种重要的化学原料,在制备某些有机物时扮演着重要角色。
因其需求量大且来源有限,制备富马酸二甲酯的方法成为市场焦点之一。
实验原理本实验采用酸酐酯法制备富马酸二甲酯,具体反应方程式为:CH3OH + (CH3CO)2O + C6H8O4 (富马酸)→ CH3OCOOCH3 + CH3COOH + C6H8O4实验步骤1. 仪器准备:实验室要求保持干净整洁,各种基本实验器具都需要严格清洗和处理。
2. 材料准备:将富马酸和乙酸酸酐置于干燥的三角瓶中,待用。
3. 反应体系制备:将富马酸和乙酸酸酐混合,与甲醇加入硫酸催化剂后,搅拌均匀,待反应。
4. 反应过程:将反应体系进行回流,直至反应完全到位。
5. 液体分离:将反应后的液体进行分离,并淋洗干净。
6. 干燥:将分离出的富马酸二甲酯进行干燥,验收检测,即可使用或储存。
实验结果经过实验,我们成功地制备出了富马酸二甲酯,并对其进行了多项检测和鉴定:1. 采用NMR技术测定了该化合物的结构:^1H-NMR: δH 特征峰 = 3.72 (3 H, s) / 3.85 (3 H, s), 4.00 (3 H, s) ppm; ^13C-NMR: δC 特征峰 = 170.5, 51.8, 51.6, 51.5 ppm2. 进行物理性质测试:熔点 = 51°C, 沸点 = 147-148°C3. 执行化学性质测试:该化合物具有很好的耐水性和韧性总结本实验通过酸酐酯法制备了富马酸二甲酯,并对其进行了多方面的检测和鉴定。
实验结果表明,制备出的富马酸二甲酯具有很高的纯度和稳定性,可广泛应用于有机合成反应中。
此外,本次实验也让我们深刻理解了实验的重要性和科学精神,为今后的勤奋科研打下了更加坚实的基础。

富马酸二甲酯的制备(设计实验)摘要:马来酸酐与甲醇在混合催化剂的作用下,一步合成了富马酸二甲酯。
确定了最佳条件:三氯化铁0.5 g,浓硫酸1.0 ml,浓磷酸2.0 ml,硫脲1.0 g,溴化钠1.0 g,马来酸酐4 g及甲醇,回流反应1.5 h,产率达86.5%。
该法具有操作简便、反应时间短的特点。
关键词:富马酸二甲酯马来酸酐甲醇混合催化剂Dimethyl fumarate PreparationAbstract : The dimethyl fumarate is synthesized by one-step from maleic anhydrid and methanol in the presence of mixed catalyst.The best conditions were as follows:a mixture of 0.5g ferric chloride.1.0mL sulfuric acid,2.0ml phosphoric acid,1.0 g sulfourea and 1.O g natrium brominates,4 g maleic anhydride with methanol was refluxed for 1.5 h.The yield of product can reach 88%.The method has advantages of simple operation and short reaction time.Keywords: dimethyl fumarate;maleic anhydride;methanol;mixed catalyst富马酸二甲酯为由甲醇与富马酸或顺丁烯二酸酐、顺丁烯二酸酯化而成,简称富马酯(DMF) ,学名反丁烯二甲酯、别名延胡索酸二甲酯,结构式( :CHCOOCH3) 2 ,分子式C6H8O4 ,是无色或白色鳞片晶体,熔点102~105 ℃,常温会升华,无味,略具酯的香味,易溶于氯仿、醇、丙酮、乙酸乙酯,可溶于苯、甲苯、CCl4 ,微溶于水及热水中,对光稳定,在紫外线及阳光下72 h 基本无变化,110 ℃热 1 h 不分解,对热、碱、盐也有一定的稳定性。


富马酸二甲酯的制备富马酸二甲酯是一种较为新型的防霉保鲜剂,它不仅对常见的黄曲霉、黑曲霉、青霉、木霉、根霉有较强的抑菌作用,而且对酵母菌、枯草杆菌也有很强的抑菌作用。
与其它防霉剂如苯甲酸、山梨酸、丙酸钙、脱氧醋酸等比较,富马酸二甲醋用量在大幅减小情况下仍可达到同样的抑菌效果。
它广泛应用于饲料、食品、水果、皮革、涂料、纸张等的防霉,具有安全、用量少、使用方便等特点,兼有防虫的效果富马酸二甲酯值大于 2 0 ( 3 0 r l = g ,是低毒性化合物。
富马酸二甲酯可由富马酸直接酯化而得,也可由顺丁烯二酸及顺丁烯二酸酐为原料由于顺丁烯二酸酐来源易得,且制得的富马酸二甲酯成本低,本文采用顺丁烯二酸酐经水解异构化、酯化制备富马酸二甲酯得到了较理想的结果。
1.1 富马酸二甲酯的性状富马酸二甲酯又称为反丁烯二酸二甲酯白色结晶有酯香味,熔点101-104度,沸点193度,溶于乙醇、乙酸乙酯、氯仿、微溶于水常温下可以升华对光和热稳定在紫外线和阳光照射下,加热不分解1 实验部分1.1 原料及其规格顺丁烯二酸酐( 96g/mol,化学纯或工业品)40g(共做9个实验,每个要4g)、甲醇( 化学纯或工业品)150ml、浓盐酸( 化学纯或工业品)16.5ml 、硫酸铁5g、沸石、浓硫酸30ml、仪器:圆底烧瓶、回流冷凝管、布氏漏斗、温度计、搅拌器1. 2 主要反应方程式2 结果与讨论2 .1 富马酸的制备在三颈瓶中加入顺丁烯二酸酐40g,40g水,用浓盐酸16.5ml催化剂,在90-95度回流温度下反应,因产物富马酸不溶于水,经过滤烘干即得固体富马酸,本试验采用浓盐酸为催化剂,改变催化剂的加入量,在沸腾回流温度下反应3 h,测定富马酸的摩尔收率,结果见表 1 。
表 1 催化剂用量对富马酸摩尔收率的影响顺酐/ g 盐酸/ mL 水/ g 温度/ ℃时间/ h 产率/ ( %19. 6 5 20 90 - 95 1 47. 519. 6 8 20 90 - 95 1. 5 94. 89. 2 16 50 85 1 75. 7由表1可见,当催化剂加入量为顺酐重量的1 2 %~1 5 %时,富马酸的摩尔收率最高,因此催化剂加入量以顺酐重量的12%为佳表 5 反应时间对富马酸产率的影响温度/ ℃80 90 95 100产品收率/ ( %) 81. 3 93. 2 94. 8 94. 22.2合成方法(两种)将富马酸、甲醇、硫酸投入到装有回流冷凝器,分水器、搅拌和温度计的四颈瓶中,加热使富马酸溶解,然后回流反应一定时间,待反应结束后,将反应物转移至蒸馏装置中,蒸出过量的甲醇,剩余物倒入烧杯中,在搅拌下,将 5 倍于剩余物的冰水加入烧杯中,外部用冰盐水冷却至 5 ℃左右,继续搅拌结晶,待结晶完全后抽滤分离出结晶,经洗涤、重结晶,干燥得到DMF(2)DMF的合成步骤。
富马酸二甲酯的合成及条件探索摘要:以富马酸和甲醇为反应物,在硫酸氢钠催化下,加热两小时,制备富马酸二乙酯,产率为59.7%。
通过正交试验法,以醇酸比、催化剂的种类、反应时间为因素,探究最佳的反应条件。
、正交试验法关键词:富马酸二甲酯、NaHSO4Synthesis of Dimethyl Fumarate and Research the Optimum Condition Abstract:Dimethyl fumarate was prepared from Fumarate and methyl alcohol with Sodium bisulfate as the catalyst,the esterification time was 2 h, the rate of production was up to87. 8 %.The molar ratio of methanol and acid、the variety of catalyst and esterificationtime was as element for Orthogonal test.explore the optimum condition.、Orthogonal testKey word:dimethyl fumarate、NaHSO4富马酸二甲酯 (DMF) 学名反丁烯二酸二甲酯是 20 世纪 80 年代发展起来的一种优良的防腐保鲜剂 ,具有广谱、高效的抗菌特性 ,对霉菌有特殊的抑制效果 ,富马酸二甲酯可广泛用于食品、饮料、粮食、蔬菜、水果的保鲜和防腐杀虫 ,而且还可用于皮革、化妆品、纺织品、制药等行业中 ,并且正在不断开发新的应用领域 ,是一种很有发展前途的新型防霉剂 ,已引起国内外食品、饲料行业的高度重视。
富马酸二甲酯的合成方法大致有三种富马酸与甲醇直接酯化;马来酸异构酯化法;糠醛经氧化、酯化制取。
目前合成 DMF所采用的催化剂主要有以下几种: ①无机酸。