5无菌及微生物检查方法验证
- 格式:pptx
- 大小:265.67 KB
- 文档页数:51


无菌检查方法验证验证项目编号R-YZ-501-01年月验证机构云南德华生物药业有限公司质控部化验室负责部门:质控部验证小组成员:验证方案批准对验证方案批准表示同意其测试内容、测试方法和本方案内的各种表格格式、内容。
目录1.概述2.验证目的3.验证范围4.验证人员及职责5.文件准备和培训6.验证条件及验证时间安排7.验证依据8.验证过程9.评价标准10.验证过程评价11.验证结论12.建议无菌检查方法验证1.概述无菌检查是用于检查药典要求无菌的药品、医疗器具、原料、辅料及其它品种是否无菌的一种方法。
无菌检查工作量大、操作不规范、人员的知识匮乏、检查方法应用不当等都会导致试验失败,因此在对一个产品进行无菌检查之前应先对无菌检查方法进行验证。
2.验证目的2.1确认所用的无菌检查方法适用于“医用即溶止血纱布”的无菌检查。
2.2确保检查结果的准确性、可靠性、准确性和重新性以及检查方法的完整性。
2.3通过对不同批次产品无菌检查的比较,对医用即溶止血纱布产品的生产全过程进行质量监控。
3.验证范围医用即溶止血纱布产品的无菌检查。
4.验证人员及职责验证委员会负责验证项目的确定;质控部负责该验证方案的起草及组织实施;验证小组负责验证方案的审批;质控部参与验证的实施及监督。
验证小组成员:5.文件准备和培训5.1检查验证所需的各类文件资料,应齐全;相关的文件草案是否已具备。
5.2培训参加验证人员需进行本文件及下述内容的培训:微生物知识、无菌检查及微生物检验操作培训。
6.验证条件及验证时间安排6.1验证条件6.1.1检验公用系统验证及仪器安装完成;仪表量器经过校验合格,且在有效期内。
6.1.2供试品3批①②③6.1.3培养基及试剂:氯化钠:临用前配成0.9%浓度的溶液硫乙醇酸盐流体培养基批号:生产厂家:改良马丁培养基批号:生产厂家:营养肉汤培养基批号:生产厂家:改良马丁琼脂培养基批号:生产厂家:6.1.4验证用菌株:(来源:云南省药品检验所)金黄色葡萄球菌【CMCC(B)26003】铜绿假单胞菌【CMCC(B)10104】枯草芽孢杆菌【CMCC(B)63501】生孢梭菌【CMCC(B)64941】大肠埃希菌【CMCC(B)44102】白色念珠菌【CMCC(F)98001】6.1.5无菌检验仪器及相关设备压力蒸汽灭菌器型号:生产厂家:生化培养箱型号:生产厂家:霉菌培养箱型号:生产厂家:超净工作台型号:生产厂家:6.2验证时间验证小组提出完整的验证计划,经批准后实施,整个验证活动按下面时间安排完成。

微生物限度和无菌检查方法验证中存在的问题
钟长鸣;陈希;吴燕红
【期刊名称】《中国药品标准》
【年(卷),期】2011(12)1
【摘要】@@ 有些药品由于其自身杀菌和抑菌作用,在微生物限度和无菌检查时就有可能出现假阴性结果,为使检查结果真实可靠则必须消除其自身杀菌和抑菌作用.消除药品自身杀菌和抑菌作用的方法有:培养基稀释、离心沉淀集菌、薄膜过滤、中和等方法.寻找一种恰当的能消除药品其自身杀菌和抑菌作用的方法是其方法验证的内容.我所在开展方法验证工作中发现存在一些问题.
【总页数】2页(P12-13)
【作者】钟长鸣;陈希;吴燕红
【作者单位】江西省食品药品检验所,南昌,330029;江西省食品药品检验所,南昌,330029;江西省食品药品检验所,南昌,330029
【正文语种】中文
【中图分类】R927
【相关文献】
1.对替硝唑注射液无菌检查方法验证中不同厂家集菌器使用问题的探讨 [J], 凌真;陈莹洁;丁莉
2.无菌、微生物限度及细菌内毒素检查方法学验证中常见问题及分析 [J], 国明;祝清芬;郑力真
3.加强药品无菌检查和微生物限度检查方法验证的对策 [J], 赵建英;寿文虹;李爱玲
4.无菌、微生物限度及细菌内毒素检查方法学验证中常见问题及分析 [J], 李红
5.微生物限度和无菌检查方法验证中存在的问题 [J], 郭焕君
因版权原因,仅展示原文概要,查看原文内容请购买。
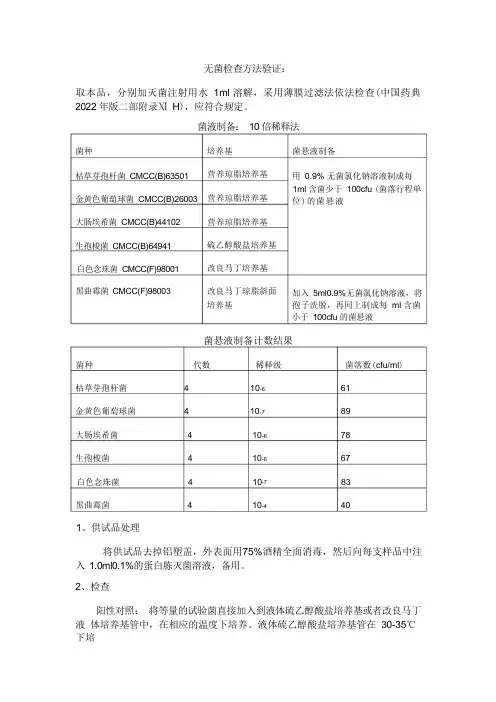
无菌检查方法验证:取本品,分别加灭菌注射用水 1ml 溶解,采用薄膜过滤法依法检查(中国药典 2022 年版二部附录Ⅺ H ),应符合规定。
菌液制备: 10 倍稀释法培养基 营养琼脂培养基营养琼脂培养基营养琼脂培养基硫乙醇酸盐培养基改良马丁培养基改良马丁琼脂斜面 培养基菌悬液制备计数结果菌种 代数 稀释级 菌落数(cfu/ml )枯草芽孢杆菌 4 10-6 61金黄色葡萄球菌 4 10-7 89大肠埃希菌 4 10-6 78生孢梭菌 4 10-6 67白色念珠菌 4 10-7 83黑曲霉菌 4 10-4 401、供试品处理将供试品去掉铝塑盖,外表面用75%酒精全面消毒,然后向每支样品中注 入 1.0ml0.1%的蛋白胨灭菌溶液,备用。
2、检查阳性对照: 将等量的试验菌直接加入到液体硫乙醇酸盐培养基或者改良马丁液 体培养基管中,在相应的温度下培养。
液体硫乙醇酸盐培养基管在 30-35℃下培菌种枯草芽孢杆菌 CMCC(B)63501 金黄色葡萄球菌 CMCC(B)26003 大肠埃希菌 CMCC(B)44102生孢梭菌 CMCC(B)64941白色念珠菌 CMCC(F)98001黑曲霉菌 CMCC(F)98003菌悬液制备用 0.9% 无菌氯化钠溶液制成每 1ml 含菌少于 100cfu (菌落行程单 位)的菌悬液加入 5ml0.9%无菌氯化钠溶液,将 孢子洗脱,再同上制成每 ml 含菌 小于 100cfu 的菌悬液养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
阴性对照:将灭菌的液体硫乙醇酸盐培养基或者改良马丁液体培养基管直接放在相应的温度下培养。
液体硫乙醇酸盐培养基管在30-35℃下培养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
样品 (薄膜过滤法):每种实验菌取10 支处理好的供试品溶液,将溶液合并后加入制备好的菌悬液1ml,用0.1%的蛋白胨灭菌溶液稀释至100ml,按薄膜过滤法过滤,取出滤膜,将其分为3 等份,分别置于含硫乙醇酸盐流体培养基及改良马丁培养基的容器中,其中一份作为阳性对照用。




无菌检验室微生物限度检验室阳性对照检验室验证方案一早,阳光透过实验室的窗户洒在我的桌子上,我泡了一杯咖啡,打开电脑,准备着手写这个方案。
这个方案对我来说,早已驾轻就熟,十年的经验让我对这类项目有了深刻的理解。
就让我用最自然的语言,把这个方案呈现出来。
我们得明确这个方案的目的。
简单来说,就是为了验证无菌检验室和微生物限度检验室的阳性对照检验室是否符合规定,确保检验结果的准确性和可靠性。
一、方案背景随着生物制品行业的迅速发展,对无菌检验室和微生物限度检验室的要求越来越高。
阳性对照检验室作为这两个检验室的重要组成部分,其验证工作的开展显得尤为重要。
本方案旨在对阳性对照检验室进行全面的验证,以确保检验结果的准确性和可靠性。
二、验证项目1.无菌检验室阳性对照检验室(1)环境验证:包括空气质量、温湿度、压力等指标的检测。
(2)设备验证:包括培养箱、生物安全柜、高压蒸汽灭菌器等设备的性能检测。
(3)操作规程验证:包括操作流程、检验方法、数据处理等环节的验证。
2.微生物限度检验室阳性对照检验室(1)环境验证:包括空气质量、温湿度、压力等指标的检测。
(2)设备验证:包括培养箱、生物安全柜、高压蒸汽灭菌器等设备的性能检测。
(3)操作规程验证:包括操作流程、检验方法、数据处理等环节的验证。
三、验证方法1.环境验证(1)空气质量检测:采用尘埃粒子计数器、空气培养箱等设备,对实验室空气质量进行检测。
(2)温湿度检测:采用温湿度计对实验室温湿度进行检测。
(3)压力检测:采用压力计对实验室压力进行检测。
2.设备验证(1)培养箱验证:采用标准菌株对培养箱进行温度、湿度、培养效果等方面的验证。
(2)生物安全柜验证:采用生物安全柜测试仪对生物安全柜的性能进行检测。
(3)高压蒸汽灭菌器验证:采用生物指示剂对高压蒸汽灭菌器的灭菌效果进行验证。
3.操作规程验证(1)操作流程验证:通过实际操作,对操作流程进行验证,确保操作过程的合规性。
(2)检验方法验证:采用标准菌株对检验方法进行验证,确保检验结果的准确性。


微生物限度检测:(1105 非无菌产品微生物限度检查:微生物计数法)一般有三种方法:平皿法、薄膜法、MPN法。
样品计数方法的验证:1 培养基适用性的检查TSA :培养的是需氧菌总数,包括真菌。
需要用的金黄色葡萄球菌,(革兰氏阳性菌)铜绿假单胞菌,(革兰氏阴性菌)枯草芽孢杆菌,(细菌中芽孢的代表)白色念珠菌,(酵母菌的代表)黑曲霉。
(霉菌的代表)SDA 霉菌和酵母的总数白色念珠菌,(酵母的代表)黑曲霉。
(霉菌的代表)怎么做呢?在TSA 验证时,每一株菌有4个平皿,试验组2个,对照组2个。
对照组用的是中检院的TSA对照组培养基。
每个皿中接不大于100CFU/ml 的菌。
然后:1摇匀 2 凝固 3 倒置(细菌是单细胞的生物正置会有水滴下来,菌落会蔓延)细菌培养 30-35度培养3d 需要做5种菌(金黄色葡萄球菌,铜绿假单胞菌,枯草芽孢杆菌,白色念珠菌,黑曲霉)真菌培养20-25度培养5d (培养的温度是由培养基的种类决定的,培养的时间是由微生物的种类决定的。
需要做2种菌。
结果:结论被检培养基上菌落的平均数与对照培养基上菌落的平均数的比值在0.5-2范围内合格。
2计数方法的适用性(有抑菌性,导致微生物数减少)微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。
Ppc 原理A组供试液(试验组)(供试液加菌液100CFU)2种方法:供试液+(每ml不超过100CFU的菌)平皿法+(每张膜中加入100CFU的菌)薄膜法B 组供试液组对照组供试液(以稀释液代替菌液组操作)C组菌液组菌液每ml 不超过100CFU的菌取不含中和剂及灭活剂的相应稀释液替代供试液,按试验组操作加入试验菌进行微生物的回收。
(A-B)/C的比值在0.5-2之间。
日常检测检验量:一次试验所用的供试品量(g、ml或cm2)一般为10g或10ml (随机抽取不少于2个最新包装,从两个包装中取)回收率;(修正系数)(用于医疗器械上的微生物的测量,或者是固体需要做的,因为洗脱不完全)第一种:薄膜过滤法(微生物较多的情况,产品直接洗脱法)无菌一、培养基适用性检查 (无菌性和灵敏度)目的:确认培养基的有效性。

中国药典微生物限度检查方法验证方案一、引言药品的质量与安全性是保障患者用药安全的重要方面。
微生物限度检查是药品质量控制的重要环节,用于评价药品中微生物的污染情况。
为确保检测结果的准确性和可靠性,本文旨在制定中国药典微生物限度检查方法验证方案。
二、背景微生物限度检查方法验证是指确定某一方法在特定条件下的适用性,方法验证的结果直接影响到药品生产和品质控制。
为了保证方法验证的可靠性,必须按照一定的规范和要求进行操作。
三、验证目的验证中国药典中所规定的微生物限度检查方法在实际应用中的准确性和可靠性,以确保药品的微生物限度符合国家及相关法规的要求。
四、验证程序1. 确定验证方法:根据中国药典中规定的微生物限度检查方法,选择合适的验证样品和验证条件。
2. 准备验证样品:从实际生产过程中随机选取药品样品,确保样品的代表性。
3. 执行验证实验:按照中国药典中的方法操作,对验证样品进行微生物限度检查。
4. 数据分析和评估:根据验证实验的结果,进行数据分析和评估,评估方法的准确性和可靠性。
5. 结果判定:根据数据评估结果,对微生物限度检查方法进行判定,判断方法是否适用于实际生产中的微生物限度检查。
6. 验证报告编制:根据验证实验的结果和结论,编制验证报告。
五、验证内容本次验证主要包括如下内容:1. 对选择的验证样品进行微生物限度检查。
2. 对验证样品进行菌落计数。
3. 对验证样品进行培养方法的验证。
4. 对不同微生物种类的检查方法进行验证。
5. 对不同微生物菌株的适应性进行验证。
六、风险评估在验证过程中,存在一定的风险因素,需进行风险评估,确保验证结果的可靠性和准确性。
风险评估主要包括验证样品来源的可靠性、实验操作的准确性、验证条件的合理性等。
七、验证结果与讨论根据验证实验的结果和数据分析,可以得出下列结论:1. 所验证的微生物限度检查方法在实际应用中的准确性和可靠性较高。
2. 所验证的微生物限度检查方法适用于不同药品制剂类型的微生物限度检查。
无菌检查方法的验证无菌检查方法是为了检查药典要求无菌的制剂及其他制品是否无菌而建立的试验方法,是作为无菌产品批放行的重要依据及药监部门对无菌产品质量监管的一个重要项目。
因此如何确保无菌检查方法的准确可靠至关重要,而检查方法的验证是保证检查结果的公正、科学和准确的基础,因此各个主要国家的gmp或药典都对无菌检查方法的验证提出了严格的要求,2021版中国药典对分析方法验证和检查的要求也有大幅度的提高,同时也是gmp检查中检查的重点和容易发现问题的区域。
验证要求与方法无菌检查方法验证一般分为前验证和再验证两种。
前检验,也表示进度表检验,所指在无菌分析方法正式宣布采用前,按照原订检验方案展开的检验。
如果没充份的理由,任何检查方法必须展开前检验。
再验证,指某一检查方法经过验证并在使用一段时间后进行的,旨在证实已验证状态没有发生飘移而进行的重新验证及对检查方法进行修订、改变时进行的验证。
通常一个无菌产品的检查流程为:首先基于产品的剂型、溶解度等性质,按照药典的建议确认与否须要展开前处置;然后根据产品的特性与否存有杀菌性,确认与否须要减少除去产品杀菌性的方法;最后检验整个检查方法中使用的一切及试验过程中的每一个环节包含样品的预处理方式、检查过程、培育条件等均不影响样品中微生物的生长。
这里,检验的重点环节包含:前处理方法直接影响后续步骤的效果和重现性,应是验证的重点。
供试品中杀菌活性的除去就是当前检验工作的重点,尤其特别强调应当充份检验供试品本身对微生物生长的影响。
具体内容的检验方法如下:菌种的挑选无菌检查方法验证中通常选择以下6种试验中常用的控制菌的标准菌株,它们分别代表不同类型的菌种:枯草芽孢杆菌[cmcc(b)63501]代表药品中常见的污染菌――芽孢杆菌、金黄色葡萄球菌[cmcc(b)26003]代表革兰阳性菌、生孢梭菌[cmcc(b)64941]代表厌氧菌、大肠埃希菌[cmcc(b)44102]代表革兰阴性菌、白色念珠菌[cmcc(f)98001]代表酵母菌、黑曲霉菌[cmcc(f)98003]代表霉菌。