2019_2020学年高中化学课时分层作业3物质的量及其单位(含解析)新人教版必修1
- 格式:doc
- 大小:86.00 KB
- 文档页数:3

物质的量及其单位——摩尔摩尔质量(30分钟50分)一、选择题(本题包括4小题,每小题5分,共20分)1.下列数量的各物质中,含分子个数最多的是 ( )A.1 mol HClB.3.01×1023个氧分子C.22 g CO2D.0.5 g H2【解析】选A。
A.1 mol HCl含N A个分子;B.含3.01×1023个O2的物质的量为0.5 mol,氧分子数为0.5N A;C.22 g CO2的物质的量为=0.5 mol,分子数为0.5N A;D.0.5 g H2的物质的量为=0.25 mol,分子数为0.25N A。
所以含分子数最多的是1 mol氯化氢,故答案为A。
【补偿训练】1.(2019·济南高一检测)下列说法正确的是( )A.摩尔是表示物质的量的单位,每摩尔物质含有6.02×1023个分子B.2H既可表示2个氢原子,又可表示2 mol氢原子C.相同物质的量的CO和CO2所含的原子总数目之比为2∶3D.相同质量的CO和CO2所含的原子总数目之比为1∶1【解析】选C 。
摩尔是物质的量的单位,物质的量是一个专有名词,不能任意删减,并且每摩尔物质含有的微粒不一定只有分子,也可能是原子或离子,A错误;2H只表示2个氢原子,B错误;相同质量的CO和CO2所含的原子总数目之比为22∶21,D错误。
2.(2019·襄阳高一检测)下列说法正确的是( )A.摩尔是表示物质数量的单位B.摩尔是表示物质多少的单位C.摩尔是既能表示物质所含微粒数的数量,又能表示物质质量的具有双重意义的单位D.摩尔是物质的量的国际单位【解析】选D。
物质的量是表示物质所含微粒数目多少的物理量,摩尔是物质的量的单位,1 mol物质约含有6.02×1023个微粒。
2.现在雾霾天气频繁,严重影响着人们的生活质量,因此一种号称“空气维生素”的神秘物质应运而生。
实际上空气维生素就是空气中的自由电子附着在分子或原子上形成的空气负离子(也叫阴离子)。

物质的量气体摩尔体积1.双酚基丙烷(BPA,分子式为C15H16O2)可能降低男性及女性的生育能力。
下列有关判断不正确的是( )A.BPA的摩尔质量是228 g·mol-1B.1 mol BPA中约含有6.02×1023个分子C.BPA属于有机化合物D.1 mol BPA在标准状况下的体积约为22.4 LD[BPA在标准状况下肯定不是气体。
]2.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。
下列叙述正确的是()A.偏二甲肼的摩尔质量为60 gB.6.02×1023个偏二甲肼分子的质量约为60 gC.1 mol偏二甲肼的质量为60 g·mol-1D.6 g偏二甲肼含有1.2N A个偏二甲肼分子B[A项,摩尔质量的单位为g·mol-1;B项,6.02×1023个偏二甲肼的物质的量为 1 mol,质量为60 g,正确;C项,1 mol物质的质量在数值上等于摩尔质量,质量的单位为g;D项,6 g偏二甲肼的物质的量为错误!=0。
1 mol,分子数为0。
1N A。
] 3.利用太阳能分解水制氢,若分解0.02 mol水,下列说法正确的是( )A.可生成H2的质量为0.02 gB.可生成氢的原子数为2.408×1023个C.可生成H2的体积为0。
224 L(标准状况)D.生成H2的量理论上等于0。
04 mol Na与水反应产生H2的量D[根据方程式2H2O===2H2↑+O2↑,分解0。
02 mol水,可产生0。
02 mol H2和0。
01 mol O2,结合n=错误!=错误!=错误!解答该题。
]4.下列叙述中正确的是()A.二氧化硫的摩尔质量是64 gB.一个镁原子的质量就是镁的相对原子质量C.水的相对分子质量等于18 gD.一个16O的实际质量约等于166.02×1023gD[二氧化硫的摩尔质量为64 g·mol-1,故A错误;一个镁原子的质量等于镁的摩尔质量与阿伏加德罗常数的比值,故B错误;水的相对分子质量为18,故C错误;一个16O的实际质量≈错误!,故D正确。

第1课时 物质的量的单位——摩尔[知 识 梳 理]知识点一 物质的量的单位——摩尔化学反应是原子、分子等粒子之间的反应,如何把微观的水分子的量和宏观的水的量联系起来,完成下列知识点我相信你就会知道: 1.物质的量七个基本物理量:长度(m)、时间(s)、质量(kg)、热力学温度(K)、电流(A)、发光强度(cd)、物质的量(mol)(1)概念:表示含有一定数目粒子的集合体的基本物理量。
(2)符号及单位:符号为n ,单位为摩尔。
2.摩尔3.阿伏加德罗常数 →人为规定的一个数值,用以联系物质的量与微观粒子个数之间的定量关系,类似一打指“12”,一双指“2”提醒:阿伏加德罗常数是指1 mol任何粒子的粒子数,这里的粒子是指同种“粒子”,如1 mol N2中的氮分子数为阿伏加德罗常数的值,1 mol N2中的氮原子数就不能为阿伏加德罗常数的值。
知识点二摩尔质量我们在用铁单质做化学实验时,不可能一个一个的查铁原子从而确定它的物质的量,我们只能通过测量铁的质量来确定它的物质的量,那么如何把质量和物质的量联系在一起?提醒:一种微粒的摩尔质量就是1 mol该微粒的质量,这种说法不正确,因为摩尔质量的单位是 g/mol,物质的质量单位是 g,二者的意义不同。
微判断(1)物质的量可以理解为物质的微观粒子数目。
( )(2)摩尔是国际单位制中七个基本物理量之一。
( )(3)1 mol氧气中约含有6.02×1023个原子。
( )(4)1 mol任何粒子所含有的粒子数相等。
( )(5)阿伏加德罗常数就是6.02×1023。
( )(6)H2O的摩尔质量(以g·mol-1为单位)在数值上等于18。
( )答案(1)×(2)×(3)×(4)√(5)×(6)√微训练1.下列叙述错误的是( )A.1 mol任何物质都含有约6.02×1023个原子B.1 mol C含有约6.02×1023个碳原子C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类D.物质的量是国际单位制中七个基本物理量之一答案 A2.(1)9 g H2O的物质的量为________,含有的氢原子数为________。

课时分层作业(二)(建议用时:25分钟)[合格基础练]1.下列叙述中正确的是( )A .12 g 碳所含的原子数就是阿伏加德罗常数B .阿伏加德罗常数没有单位C .摩尔是既表示物质粒子数量,又表示物质质量双重意义的单位D .摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个粒子D [选项A 应为12 g 12C ;选项B 中阿伏加德罗常数的单位为mol -1;摩尔是物质的量的单位,C 错,D 对。
]2.对于等质量的下列气体中,含有的分子个数最多的是( ) A .Cl 2 B .H 2 C .O 2D .COB [根据n =m M可知,气体的摩尔质量越小,气体的物质的量越多,分子个数越多。
] 3.有下列物质:①8.5 g NH 3、②6.02×1023个H 2分子、③4 ℃时10 mL H 2O 、④0.2 mol H 3PO 4,按所含分子数由多到少的顺序排列正确的是( )A .①④③② B.④③②① C .②③①④D .①②③④C [物质的量与分子数成正比,物质的量分别为①0.5 mol、②1 mol、③0.56 mol、④0.2 mol ,所以分子数由多到少的顺序正确的是C 。
]4.N A 代表阿伏加德罗常数,下列说法中正确的是( ) A .2.3 g 钠由原子变成离子时,失去的电子数为 0.2N A B .0.2N A 个硫酸分子与19.6 g 磷酸(H 3PO 4)含有相同的氧原子数 C .28 g 氮气所含的原子数为N AD .N A 个氧分子与N A 个氢分子的质量比为8∶1B [A 中Na +为+1价,2.3 g 钠为0.1 mol 钠原子,失去的电子数为0.1N A ,错误;B 中19.6g 磷酸即为0.2N A 个磷酸分子⎝ ⎛⎭⎪⎫19.6 g 98 g·mol -1=0.2 mol ,等物质的量的硫酸(H 2SO 4)与磷酸(H 3PO 4)含有相同的氧原子数,正确;C 中28 g 氮气(N 2)即为1 mol 氮分子⎝⎛⎭⎪⎫28 g 28 g·mol -1=1 mol ,所以应含2N A 个氮原子,错误;D 中N A 个氧分子质量为32 g ,N A 个氢分子质量为2 g ,则其质量比为16∶1,错误。
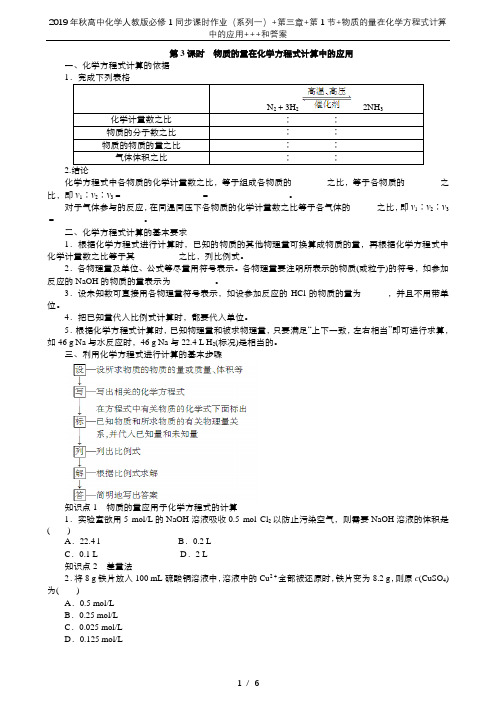
第3课时物质的量在化学方程式计算中的应用一、化学方程式计算的依据1.完成下列表格N2+3H22NH3化学计量数之比____ ∶____∶____物质的分子数之比____ ∶____∶____物质的物质的量之比____ ∶____∶____气体体积之比____ ∶____∶____化学方程式中各物质的化学计量数之比,等于组成各物质的________之比,等于各物质的________之比,即ν1∶ν2∶ν3=__________________=__________________。
对于气体参与的反应,在同温同压下各物质的化学计量数之比等于各气体的______之比,即ν1∶ν2∶ν3=____________________。
二、化学方程式计算的基本要求1.根据化学方程式进行计算时,已知的物质的其他物理量可换算成物质的量,再根据化学方程式中化学计量数之比等于其__________之比,列比例式。
2.各物理量及单位、公式等尽量用符号表示。
各物理量要注明所表示的物质(或粒子)的符号,如参加反应的NaOH的物质的量表示为__________。
3.设未知数可直接用各物理量符号表示,如设参加反应的HCl的物质的量为______,并且不用带单位。
4.把已知量代入比例式计算时,都要代入单位。
5.根据化学方程式计算时,已知物理量和被求物理量,只要满足“上下一致,左右相当”即可进行求算,如46 g Na与水反应时,46 g Na与22.4 L H2(标况)是相当的。
三、利用化学方程式进行计算的基本步骤知识点1物质的量应用于化学方程式的计算1.实验室欲用5 mol/L的NaOH溶液吸收0.5 mol Cl2以防止污染空气,则需要NaOH溶液的体积是()A.22.4 l B.0.2 LC.0.1 L D.2 L知识点2差量法2.将8 g铁片放入100 mL硫酸铜溶液中,溶液中的Cu2+全部被还原时,铁片变为8.2 g,则原c(CuSO4)为()A.0.5 mol/LB.0.25 mol/LC.0.025 mol/LD.0.125 mol/L知识点3关系式法3.10 g Mg、Al合金与足量100 mL NaOH溶液反应,产生H2的体积为6.72 L(标准状况下),求:(1)合金中Al的质量分数;(2)生成物NaAlO2的物质的量浓度(假设溶液体积不变)。

课时分层作业(十三) 物质的量浓度(建议用时:40分钟)[合格基础练]1.浓度为2.00 mol·L-1的盐酸1 L,欲使其浓度变为4.00 mol·L-1,下列方法可行的是( )A.蒸发掉0.5 L水B.标准状况下通入44.8 L HCl气体C.将溶液加热蒸发浓缩至0.5 LD.加入10 mol·L-1盐酸0.6 L,再将溶液稀释至2 LD[A、C不行,盐酸具有挥发性,蒸发掉0.5 L水浓缩至0.5 L时HCl也会逸出,所以不能实现。
B不行,标准状况下的44.8 L HCl 气体物质的量为2 mol,原溶液中HCl的物质的量为2.00 mol·L-1×1 L=2 mol,溶液的总体积大于1 L,则混合后溶液的浓度小于4 mol·L -1。
D可行,加入盐酸,再将溶液稀释至 2 L,HCl的浓度为c(HCl)=(10 mol·L-1×0.6 L +2.00 mol·L-1×1 L)÷2 L=4.0 mol·L-1。
]2.下列关于0.15 mol·L-1的Na2SO4溶液的说法中,正确的是( )A.1 L溶液中含有Na+、SO2-4总数为0.3N AB.1 L溶液中含有Na+数目是0.15N AC.1 L溶液中Na+的浓度是0.3 mol·L-1D.2 L溶液中含有SO2-4的浓度是0.3 mol·L-1C[0.15 mol·L-1的Na2SO4溶液Na+、SO2-4的浓度分别是0.3 mol·L-1和0.15 mol·L-1。
] 3.V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO2-4的物质的量浓度为( )A.56mV mol·L-1 B.3m56V mol·L-1C.m56V mol·L-1 D.3m112V mol·L-1D[n(Fe3+)=m g56 g·mol-1,n(SO2-4)=m56×32 mol=3m112 mol,c(SO2-4)=nV=3m112V mol·L-1。
人教版高一化学上册必修1《3物质的量的单位——摩尔》同步练习及答案课时跟踪检测(三)物质的量的单位——摩尔1.下列对“摩尔(mol)”的叙述不正确的是( )A.摩尔是一个单位,用于计量物质所含微观粒子的多少B.摩尔既能用来计量纯净物,又能用来计量混合物C.可以说“1 mol H2”但不能说“1 mol氢”D.摩尔是物质的微粒个数解析:选D 摩尔只表示物质的量的单位,不表示物质的微粒个数。
2.下列说法不正确的是( )A.H2的摩尔质量是2 gB.1 mol NaCl的质量是58.5 gC.氧气的摩尔质量是32 g·mol-1D.2 g H2含2 mol H解析:选A 摩尔质量的单位是“g·mol-1”,A项不正确,C项正确;NaCl的摩尔质量是58.5 g·mol-1,根据m=nM,可求出1 mol NaCl的质量为58.5 g,B项正确,2 g H2为1 mol,含H为2 mol,D项正确。
3.下列关于摩尔质量的描述或应用中正确的是( )A.1 mol OH-的质量是17B.二氧化碳的摩尔质量是44 gC.铁原子的摩尔质量等于它的相对原子质量D.一个钠原子质量等于236.02×1023g解析:选D 1 mol OH-的质量为m(OH-)=n(OH-)·M(OH-)=1 mol×17 g·mol-1=17 g,A错误;摩尔质量的单位为g·mol-1,B错误;摩尔质量的单位为g·mol-1,而相对分子质量或相对原子质量的单位为1,所以两者不能构建等式关系,C错误;1 mol Na的质量为23 g,故1个钠原子的质量为236.02×1023g,D正确。
4.下列说法中正确的是( ) A.1 mol H2中含有6.02×1023个H B.1 mol 氧含有6.02×1023个O2 C.1 mol CaCl2中含有1 mol离子D.1 mol H+中含有H+数为N A解析:选D A选项不正确,1 mol H2中应含有1.204×1024个H;B项不正确,1 mol氧指代不明;C项不正确,1 mol CaCl2中含1 mol Ca2+和2 mol Cl-,其离子总数为3 mol。
高中化学《物质的量及单位(摩尔)》练习题(附答案解析)学校:___________姓名:___________班级:___________一、单选题1.用 N A表示阿伏加德罗常数,下列说法正确的是()A.摩尔是一个基本物理量B.0.5 mol 氧气所占体积为 11.2LC.含有 2N A个氢原子的水,其物质的量为 1 mol D.2 mol NaCl 中含离子数 2N A2.下列名词中,哪个名词不属于物理量()A.长度B.质量C.摩尔D.时间3.下列叙述不正确的是()A.物质的量是七个基本物理量之一B.阿伏加德罗常数是没有单位的C.1molH2O约含有6.02×1023 个水分子D.物质的量的单位是摩尔4.下列有关物质的量及摩尔的叙述正确的是()A.1.5molCH4中含有1.5molC、6molHB.1mol是6.02×1023个粒子的集合体,如1mol大米、1mol苹果等C.物质的量与物质的数量、物质的质量是等价的D.摩尔是7个基本物理量之一,它既是物质的量的单位又是粒子数目的单位5.下列叙述正确的是()A.摩尔是七个基本物理量之一B.1 mol任何物质都含有6.02×1023个分子C.标准状况下,1 mol任何物质体积均为22.4 LD.摩尔质量在数值上等于该物质的相对分子质量或相对原子质量6.下列对于“摩尔”的理解正确的是()A.属于七种基本物理量之一 B.是物质的量的单位,符号为molC.12g碳所含有的原子数目为1摩尔 D.只能用来计量纯净物,不能用于混合物7.下列说法正确的是()A.物质的量是描述微观粒子集合的一个物理量B.摩尔可以把物质的质量、体积等宏观量与原子、分子或离子等微观粒子联系起来C.阿伏加德罗常数可近似表示为6.02×1023D.摩尔是国际单位制的七个基本物理量之一mol定义等一系列调整的提案,修改变化已于2019年5月20 8.第26届国际计量大会,通过了修改摩尔()日正式生效。
人教版高一化学上册必修1《3物质的量的单位——摩尔》同步练习及答案课时跟踪检测(三)物质的量的单位——摩尔1.下列对“摩尔(mol)”的叙述不正确的是( )A.摩尔是一个单位,用于计量物质所含微观粒子的多少B.摩尔既能用来计量纯净物,又能用来计量混合物C.可以说“1 mol H2”但不能说“1 mol氢”D.摩尔是物质的微粒个数解析:选D 摩尔只表示物质的量的单位,不表示物质的微粒个数。
2.下列说法不正确的是( )A.H2的摩尔质量是2 gB.1 mol NaCl的质量是58.5 gC.氧气的摩尔质量是32 g·mol-1D.2 g H2含2 mol H解析:选A 摩尔质量的单位是“g·mol-1”,A项不正确,C项正确;NaCl的摩尔质量是58.5 g·mol-1,根据m=nM,可求出1 mol NaCl的质量为58.5 g,B项正确,2 g H2为1 mol,含H为2 mol,D项正确。
3.下列关于摩尔质量的描述或应用中正确的是( )A.1 mol OH-的质量是17B.二氧化碳的摩尔质量是44 gC.铁原子的摩尔质量等于它的相对原子质量D.一个钠原子质量等于236.02×1023g解析:选D 1 mol OH-的质量为m(OH-)=n(OH-)·M(OH-)=1 mol×17 g·mol-1=17 g,A错误;摩尔质量的单位为g·mol-1,B错误;摩尔质量的单位为g·mol-1,而相对分子质量或相对原子质量的单位为1,所以两者不能构建等式关系,C错误;1 mol Na的质量为23 g,故1个钠原子的质量为236.02×1023g,D正确。
4.下列说法中正确的是( ) A.1 mol H2中含有6.02×1023个H B.1 mol 氧含有6.02×1023个O2 C.1 mol CaCl2中含有1 mol离子D.1 mol H+中含有H+数为N A解析:选D A选项不正确,1 mol H2中应含有1.204×1024个H;B项不正确,1 mol氧指代不明;C项不正确,1 mol CaCl2中含1 mol Ca2+和2 mol Cl-,其离子总数为3 mol。
课时分层作业(三)
(建议用时:25分钟)
[合格基础练]
1.在拉丁文中摩尔的本义是“堆,堆量”。
化学家对数量巨大的粒子的计数也像我们生活中数苹果、硬币一样“一堆堆”地去数。
以下相关说法中不正确的是( )
A .物质的量是国际单位制中七个基本物理量之一。
我们可以用熟悉的质量、长度等基本物理量的相关知识类比学习物质的量
B .和12条毛巾是一“打”,60分钟是一个“小时”一样,化学家们规定了0.012 kg 12
C 中所含有碳原子数为1“摩尔”,其数值恰好是6.02×1023
C .曹冲称象所采用的是“化整为零”的思想,从而进入可称量的范围
D .农业生产中采用的“百粒重”、“千粒重”,体现的是“积小成大,聚微成宏”思想,从而进入可称量范围,物质的量也体现了这一思想
B [1“摩尔”粒子数值约为6.02×1023。
] 2.下列说法中正确的是( )
A .1 mol 任何物质都含有6.02×1023
个原子
B .阿伏加德罗常数就是1 mol 粒子的粒子数,0.012 kg 12
C 中含有约6.02×1023
个 12
C C .摩尔是一个基本的物理量
D .1 mol 水中含有2 mol 氢和1 mol 氧
B [A 项,任何物质可以是分子、离子或原子;
C 项,摩尔是物质的量的单位;
D 项,2 mol 氢和1 mol 氧指代不明。
]
3.下列叙述中正确的是( ) A .CO 2的摩尔质量为44 g B .1 mol CO 2的质量为44 g/mol
C .CO 2的摩尔质量等于CO 2的相对分子质量
D .N A 个CO 2的质量(以g 为单位)与CO 2的相对分子质量在数值上相同
D [摩尔质量的单位是g/mol ,质量的单位是g ,A 、B 错误;摩尔质量以g/mol 为单位时,在数值上等于其相对分子质量,C 错误;N A 个CO 2即1 mol ,其质量以g 为单位时与CO 2的相对分子质量在数值上相同,D 正确。
]
4.a g NH 3中含b 个氢原子,则阿伏加德罗常数可表示为(单位为mol -1
)( ) A .17b
4a
B .17b 3a
C .17b a
D .17a b
B [NH 3的摩尔质量为17 g·mol -1
,每个NH 3中含有三个氢原子,故有:b N A =3a g 17 g·mol -1
,
则N A =17b 3a
mol -1。
]
5.偏二甲肼(C 2H 8N 2)是一种高能燃料,燃烧产生巨大能量,可作为航天运载火箭的推动力。
下列叙述中正确的是( )
A .偏二甲肼的摩尔质量为60 g
B .6.02×1023
个偏二甲肼分子的质量为60 g C .1 mol 偏二甲肼的质量为60 g/mol D .6 g 偏二甲肼含有N A 个偏二甲肼分子
B [偏二甲肼的摩尔质量为60 g/mol ;1 mol 这种物质的质量为60 g ;6 g 偏二甲肼含有0.1N A 个偏二甲肼分子。
]
6.下列物质中所含分子物质的量最多的是( ) A .44 g CO 2 B .1.5 mol H 2 C .64 g SO 2
D .3.01×1023个硫酸分子
B [A 项,44 g CO 2的物质的量是44 g÷44 g·mol -1
=1 mol ;C 项,64 g SO 2的物质的量是64 g÷64 g·mol
-1
=1 mol ;D 项,3.01×10
23
个硫酸分子的物质的量是
3.01×1023
÷(6.02×1023
mol -1
)=0.5 mol ,故选B 。
]
7.有以下四种物质:
①22 g 二氧化碳;②8 g 氢气;③1.204×1024
个氮气分子;④4 ℃时18 mL 水(ρ=1 g·mL
-1
)
它们所含分子数最多的是________,所含原子数最多的是________,质量最大的是
________,所含电子数最多的是________。
(均填序号)
[答案] ② ② ③ ③
[等级过关练]
8.用N A 表示阿伏加德罗常数的值。
下列说法中正确的是( ) A .2.4 g 金属镁变成镁离子时失去的电子数为0.1N A B .2 g 氢气中含有的原子数为N A
C .3.01×1023
个氮分子中含有的原子数为2N A D .17 g 氨气中含有的电子数为10N A
D [A 项,2.4 g Mg 变成Mg 2+
失电子数为2.424×2N A =0.2N A ;B 项,2 g H 2含有的原子数为
22×2N A =2N A ;C 项,3.01×1023
个N 2中原子数为3.01×1023
6.02×10
23×2N A =N A 。
] 9.已知Q 与R 的摩尔质量之比为9∶22,在反应X +2Y===2Q +R 中,当1.6 g X 与Y 完
全反应后,生成4.4 g R ,则参与反应的Y 和生成物Q 的质量之比为 ( )
A .46∶9
B .32∶9
C .23∶9
D .16∶9
D [该题考查的是质量守恒定律,设Q 、R 的摩尔质量是9a 、22a ,根据化学方程式及1.6 g X 生成4.4 g R ,可以求得X 的摩尔质量是8a ,由质量守恒定律可得Y 的摩尔质量是16a ,所以参与反应的Y 和生成物Q 的质量之比为其摩尔质量之比。
]
10.(1)用N A 表示阿伏加德罗常数的值,则0.3 mol NH 3中所含质子数与________个H 2O 中所含质子数相等。
(2)含0.4 mol Al 3+
的Al 2(SO 4)3中所含的SO 2-
4的物质的量是________。
(3)已知16 g A 和20 g B 恰好完全反应生成0.04 mol C 和31.76 g D ,则C 的摩尔质量为________。
(4)19 g 某二价金属氯化物(ACl 2)中含有0.4 mol Cl -
,则ACl 2的摩尔质量是________,A 的相对原子质量是________。
[解析] (1)0.3×10=N N A
×10,N =0.3N A =1.806×1023。
(2)n (SO 2-
4)∶n (Al 3+
)=3∶2,n (SO 2-
4)=0.6 mol 。
(3)M (C)=16 g +20 g -31.76 g
0.04 mol
=106 g/mol 。
(4)19 g 某二价金属氯化物中含有0.4 mol Cl -
,即19 g 某二价金属氯化物的物质的量
为0.2 mol ,则M =m n =19 g 0.2 mol
=95 g·mol -1
,A 的相对原子质量为95-35.5×2=24。
[答案] (1)1.806×1023
(或0.3N A ) (2)0.6 mol (3)106 g/mol (4)95 g/mol 24。