第十六章周环反应
- 格式:doc
- 大小:1.09 MB
- 文档页数:15







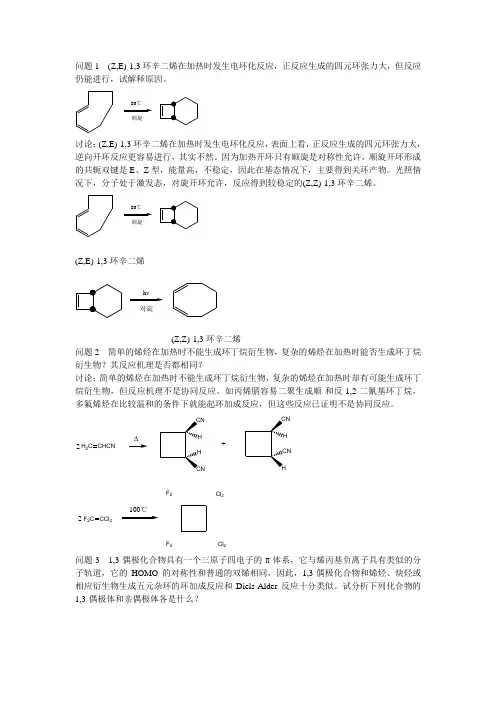
问题1 (Z,E)-1,3环辛二烯在加热时发生电环化反应,正反应生成的四元环张力大,但反应仍能进行,试解释原因。
顺旋80℃讨论:(Z,E)-1,3环辛二烯在加热时发生电环化反应,表面上看,正反应生成的四元环张力大,逆向开环反应更容易进行,其实不然。
因为加热开环只有顺旋是对称性允许,顺旋开环形成的共轭双键是E 、Z 型,能量高,不稳定,因此在基态情况下,主要得到关环产物。
光照情况下,分子处于激发态,对旋开环允许,反应得到较稳定的(Z,Z)-1,3环辛二烯。
顺旋(Z,E)-1,3环辛二烯对旋(Z,Z)-1,3环辛二烯问题2 简单的烯烃在加热时不能生成环丁烷衍生物,复杂的烯烃在加热时能否生成环丁烷衍生物?其反应机理是否都相同?讨论:简单的烯烃在加热时不能生成环丁烷衍生物,复杂的烯烃在加热时却有可能生成环丁烷衍生物,但反应机理不是协同反应。
如丙烯腈容易二聚生成顺-和反-1,2-二氰基环丁烷,多氟烯烃在比较温和的条件下就能起环加成反应,但这些反应已证明不是协同反应。
H 2C CHCN2+F 2C CCl 22Cl 2Cl 2F 2F 2问题3 1,3-偶极化合物具有一个三原子四电子的π体系,它与烯丙基负离子具有类似的分子轨道,它的HOMO 的对称性和普通的双烯相同,因此,1,3-偶极化合物和烯烃、炔烃或相应衍生物生成五元杂环的环加成反应和Diels-Alder 反应十分类似。
试分析下列化合物的1,3-偶极体和亲偶极体各是什么?ON R'R 6H 5N R'R R'''NN R'R 6H 5S N R'R S R''(1)(2)(3)(4)讨论:上述化合物的1,3-偶极体均为亲偶极体分别为: (1)(2)(3)(4)C 6H 5CHO R''C C R"'C 6H 5N O S C S问题4 5-氘代-5-甲基环戊二烯在加热条件下可以得到几个异构体?指出得到这些异构体的反应途径,写出这些异构体的名称。

第16章周环反应16.1 复习笔记一、周环反应和分子轨道对称守恒原理1.周环反应(1)定义:在化学反应过程中,能形成环状过渡态(cyclic transition state)的协同反应(synergistic reaction)统称为周环反应。
(2)协同反应是一种基元反应(elementary reaction)。
其含义是:在反应过程中,若有两个或两个以上的化学键破裂和形成时,都必须相互协调地在同一步骤中完成。
(3)周环反应具有如下的特点:①反应过程中没有自由基或离子这一类活性中间体产生。
②反应速率极少受溶剂极性和酸、碱催化剂的影响,也不受自由基引发剂和抑制剂的影响。
③反应条件一般只需要加热或光照,而且在加热条件下得到的产物和在光照条件下得到的产物具有不同的立体选择性(stereoselectivity),是高度空间定向反应。
④遵循微观可逆性原理。
(4)周环反应主要包括电环化反应(electrocyclic reaction)、环加成反应(cycloaddition)和σ迁移反应(σmigrate reaction)。
2.分子轨道对称守恒原理电环化反应在加热和光照条件下具有不同的立体选向性。
分子轨道对称性是控制这类反应进程的关键因素。
分子轨道对称守恒原理认为:化学反应是分子轨道进行重新组合的过程,在一个协同反应中,分子轨道的对称性是守恒的,即由原料到产物,轨道的对称性始终不变。
因此分子轨道的对称性控制着整个反应的进程。
二、前线轨道理论1.前线轨道理论的概念和中心思想(1)基本概念①最高占有轨道(HOMO):已占有电子的能级最高的轨道。
②最低未占有轨道(LUMO):未占有电子的能级最低的轨道。
③单占轨道(single occupied molecular orbital):有的共轭体系中含有奇数个电子,它的已占有电子的能级最高的轨道中只有一个电子。
用SOMO表示。
单占轨道既是HOMO,又是LUMO。
第16章周环反应
1.用前线轨道理论说明下列反应是热允许的,还是光允许的反应。
答:反,反-2,4-己二烯的分子轨道如下:
激发态的HOMO对旋生成产物顺-3,4-二甲基环丁烯,此反应是光允许的反应。
2.给下列反应提出合理的反应机理。
答:
3.从指定原料出发.选择适当的反应,实现下列成环或开环过程。
不超过4个碳的有机化合物)
不超过4个碳的有机化合物)
不超过4个碳的有机化合物)
不超过4个碳的有机化合物)
(不超过4个碳的有机化合物)
不超过4个碳的有机化合物)答:
4.合成下列化合物。
答:
5.下列反应是在生物体内发生的协同反应,请指出各步反应的类型。
答:第一步:电环化反应,光照条件下,4n+2体系顺旋开环;第二步:加热条件下,[1,7]氢的σ迁移反应。
6.用丙烯醛为主要原料合成下列化合物:
答:在中,醛基具有吸电子作用,通常可活化α-氢,容易在α-位生成碳负离子,进而与甲醛缩合得到产物。
但由于α,β-不饱和键的存在,此种活化作用受到严重抑制。
因此,如能够设法暂时屏蔽不饱和键,此合成路线即可获得成功。
由于第尔斯—阿尔德反应可逆,此处利用第尔斯—阿尔德反应就是一种很好的保护或屏蔽双键的方法。
逆合成分析:
合成:
在合成中,首先用环戊二烯保护双键,然后在醛基的α-位引入羟甲基,同时利用康尼查罗反应将醛基一并还原成羟基,再通过逆第尔斯—阿尔德反应除去环戊二烯单元即得到产物,合成路线简捷明了。
7.以苯、甲苯和其他不超过4个碳的有机化合物为原料合成下列化合物.无机试剂任意选用。
答:。

第十八章分子轨道理论简介一、教学目的和要求(1)了解分子轨道理论的原理。
(1)了解周环反应的一般规律。
(2)了解分子轨道对称守恒原理在有机合成中的作用。
二、教学重点与难点分子轨道理论的原理,周环反应的理论。
三、教学方法和教学学时1、教学方法:以课堂讲授为主,结合必要的课堂讨论。
教学手段以板书和多媒体相结合。
2、教学学时:2学时四、教学内容第一节电环化反应第二节环加成反应第三节σ迁移反应第四节周环反应的理论一、电环化反应机理二、环加成反应机理三、σ键迁移反应机理五、课后作业、思考题习题:1、2、4、6、11。
§18-1 周环反应的理论一、周环反应前面各章讨论的有机化学反应从机理上看主要有两种,一种是离子型反应,另一种是自由基型反应,它们都生成稳定的或不稳定的中间体。
还有另一种机理,在反应中不形成离子或自由基中间体,而是由电子重新组织经过四或六中心环的过渡态而进行的。
这类反应表明化学键的断裂和生成是同时发生的,它们都对过渡态作出贡献。
这种一步完成的多中心反应称为周环反应。
周环反应:反应中无中间体生成,而是通过形成过渡态一步完成的多中心反应。
反应物——→产物周环反应的特征:(1) 多中心的一步反应,反应进行时键的断裂和生成是同时进行的(协同反应)。
例如:(2) 反应进行的动力是加热或光照。
不受溶剂极性影响,不被酸碱所催化,不受任何引发剂的引发。
(3) 反应有突出的立体选择性,生成空间定向产物。
例如:二、周环反应的理论 (一) 轨道和成键周环反应的过程,广泛的应用轨道来描述,这些轨道往往是用图形来表示。
有机化学中涉及最多的原子轨道为1p 轨道和2s 轨道。
原子轨道线形组合成分子轨道。
当两个等价原子轨道组合时,总是形成两个新的分子轨道,一个是能量比原子轨道低的成键轨道,另一个是能量比原子轨道高的反键轨道。
(二)分子轨道对称守恒原理原子轨道组合成分子轨道时,遵守轨道对称守恒原理。
即当两个原子轨道的对称性相同(位相相同)的则给出成键轨道,两个原子轨道的对称性不同(位相不同)的则给出反键轨道。
CHO +CHOR h υR = -COOCH3成键轨道原子轨道X 12分子轨道对称守恒原理是1965年德国化学家五德沃德(R .B .Woodward )和霍夫曼(R .Hoffmann )根据大量实验事实提出的。
分子轨道对称守恒原理有三种理论解释:前线轨道理论;能量相关理论;休克尔-莫比乌斯结构理论(芳香过渡态理论)。
这几种理论各自从不同的角度讨论轨道的对称性。
其中前线轨道理论最为简明,易于掌握。
分子轨道对称守恒原理和前线轨道理论是近代有机化学中的重大成果之一。
为此,轨道对称守恒原理创始人之一R .霍夫曼和前线轨道理论的创始人福井谦一共同获得了1981年的诺贝尔化学奖。
1. σ-键的形成当两个原子轨道沿着键轴方向对称重叠时,可形成两个σ-键的分子轨道。
对称性相同的原子轨道形成σ-成键轨道,对称性不同的原子轨道形成σ*成键轨道。
见P 532~533。
2.π-键的形成当两个P 轨道侧面重叠时,可形成两个π分子轨道。
对称性相同的P 轨道形成成键π轨道。
对称性不同的P 轨道形成反键π*轨道。
见P 533~534。
(三)前线轨道理论前线轨道理论的创始人福井谦一指出,分子轨道中能量最高的填有电子的轨道和能量最低的空轨道在反应只是至关重要的。
福井谦一认为,能量最高的已占分子轨道(简称HOMO )上的电子被束缚得最松弛,最容易激发到能量最低的空轨道(简称LUMO )中去,并用图象来说明化学反应中的一些经验规律。
因为HOMO 轨道和LUMO 轨道是处于前线的轨道,所以称为前线轨道(简称FMO )。
例如,丁二烯分子中总共有4个π电子,可形成4 个分子轨道ψ1,ψ2,ψ3,ψ4,其中ψ1和ψ2为成键轨道,ψ3和ψ4为反键轨道。
当丁二烯处于基态时,分子轨道ψ1和ψ2各有两个电子,电子态为ψ12,ψ22,因E 2 > E 1,所以ψ2就是HOMO 轨道。
ψ3和ψ4是空轨道,而E 3 < E 4,所以ψ3是LUMO 轨道。
ψ2和ψ3都为前线轨道。
化学键的形成主要是由FMO 的相互作用所决定的。
原子轨道图形对称不对称轨道轨道S P§ 18-2 电环化反应电环化反应是在光或热的条件下,共轭多烯烃的两端环化成环烯烃和其逆反应——环烯烃开环成多烯烃的一类反应。
例如:电环化反应是分子内的周环反应,电环化反应的成键过程取决于反应物中开链异构物的HOMO 轨道的对称性。
一、含4n 个π电子体系的电环化以丁二烯为例讨论——丁二烯电环化成环丁烯时,要求:① C 1—C 2,C 3—C 4沿着各自的键轴旋转,使C 1和C 4的轨道结合形成一个新的σ-键。
② 旋转的方式有两种,顺旋和对旋。
③ 反应是顺旋还是对旋,取决于分子是基态还是激发态时的HOMO 轨道的对称性。
丁二烯在基态(加热)环化时,起反应的前线轨道HOMO 是ψ2所以丁二烯在基态(加热)环化时,顺旋允许,对旋禁阻。
ψψψψ1234E 1E 2E 3E 4基态激发态丁二烯的分子轨道图丁二烯在激发态(光照)环化时,起反应的前线轨道HOMO 是ψ所以丁二烯在激发态(光照)环化时,对旋允许,顺旋是禁阻的。
其他含有π电子数为4n 的共轭多烯烃体系的电环化反应的方式也基本相同。
例如:二、4n+2个π电子体系的电环化以己三烯为例讨论,处理方式同丁二烯。
先看按线性组合的己三烯的六个分子轨道。
顺旋允许的禁阻的υh υh 对旋(允许)顺旋(禁阻)CH 3CH 3Ph Ph33Ph CH 3PhCH 3℃25顺旋υH 3CCH 3H HH CH 3HCH 3CH 3HH CH 3顺旋对旋π轨道 从己三烯为例的π轨道可以看出:4n+2π电子体系的多烯烃在基态(热反应时)ψ3为HOMO ,电环化时对旋是轨道对称性允许的,C 1和C 6间可形成σ-键,顺旋是轨道对称性禁阻的,C 1和C 6间不能形成σ-键。
4n+2π电子体系的多烯烃在激发态(光照反应时)ψ4为HOMO 。
电环化时顺旋是轨道对称性允许的,对旋是轨道对称性禁阻的。
ψψψψψψ235461E 1E 2E 3E 4E 5E 6基态激发态ψ3对旋(允许)己三烯的热环合CH 3CH 3H H 130对旋33顺旋℃ψ4顺旋(允许)己三烯的光照环合υh υ其它含有4n+2个π电子体系的共轭多烯烃的电环化反应的方式也基本相似。
例如:从以上讨论可以看出,电环化反应的空间过程取决于反应中开链异构物的HOMO 的对称性,若一共轭多烯烃含有4n 个π电子体系,则其热化学反应按顺旋方式进行,光化学反应按对旋进行;如果共轭多烯烃含有4n+2个π电子体系,则进行的方向正好与上述相反。
此规律称为伍德沃德 — 霍夫曼规则,见表17-1电环化反应在有机合成上的应用也是很有成效的。
见P 538~539。
§ 18-3 环加成反应两分子烯烃或共轭多烯烃加成成为环状化合物的反应叫环加成反应。
例如:环加成反应根据反应物的P 电子数可分为[2+2]环加成和[4+4] 环加成类型。
环加成反应:(1)是分子间的加成环化反应。
(2)由一个分子的HOMO 轨道和另一个分子的LOMO 轨道交盖而成。
(3)FMO 理论认为,环加成反应能否进行,主要取决于一反应物分子的HOMO顺旋对旋υCH 2CH 2CH 2CH 2+υh CHOCHO+轨道与另一反应物分子的LOMO 轨道的对称性是否匹配,如果两者的对称性是匹配的,环加成反应允许,反之则禁阻。
从分子轨道(FMO )观点来分析,每个反应物分子的HOMO 中已充满电子,因此与另一分子的的轨道交盖成键时,要求另一轨道是空的,而且能量要与HOMO 轨道的比较接近,所以,能量最低的空轨道LOMO 最匹配。
一、[ 2+2 ]环加成 以乙烯的二聚为例在加热条件下,当两个乙烯分子面对面相互接近时,由于一个乙烯分子的HOMO 为π轨道,另一乙烯分子的LOMO 为π*轨道,两者的对称性不匹配,因此是对称性禁阻的反应。
光照条件下,到处于激发态的乙烯分子中的一个电子跃迁π*轨道上去,因此,乙烯的HOMO 是π*,另一乙烯分子基态的LOMO 也是π*,两者的对称性匹配是允许的,故环加成允许。
[ 2+2 ]环加成是光作用下允许的反应。
与乙烯结构相似的化合物的环加成方式与依稀的相同。
例见P 540。
二、[ 4+2 ]环加成 以乙烯与丁二烯为例讨论从前线轨道(FMO )来看,乙烯与丁二烯HOMO 和LUMO 如下图:A B π*πLUNOHOMO热反应(对称性禁阻)A B π*π*LUNO LUNO HOMO 原光反应(对称性允许)()MeMeMe Me+υMeMeMeMe当乙烯与丁二烯在加热条件下(基态)进行环加成时,乙烯的HOMO 与丁二烯的LUMO 作用或丁二烯的HOMO 与乙烯的LUMO 作用都是对称性允许的,可以重叠成键。
所以,[ 4+2 ]环加成是加热允许的反应。
如下图:对称性允许的乙烯和丁二烯的环加成(热反应)图在光照作用下[ 4+2 ]环加成是反应是禁阻的。
因为光照使乙烯分子或丁二烯分子激活,乙烯的π*LUMO 或丁二烯的π3*LUMO 变成了π*HOMO 或π3*HOMO ,轨道对称性不匹配,所以反应是禁阻的。
如下图:对称性禁阻的乙烯和丁二烯的环加成(光作用)图大量的实验事实证明了这个推断的正确性,例如D-A 反应就是一类非常容易进行且空间定向很强的顺式加成的热反应。
例如:πHOMO LUMO πππψ3ψ223**LUMO HOMO 乙烯的前线轨道图丁二烯的前线轨道图πHOMO LUMO πππ32**LUMO HOMO (乙烯)(丁二烯)πHOMO LUMO π3**LUMO HOMO (乙烯)(丁二烯)π3*LUMO π*(乙烯)(原来的 )(原来的 )LUMO CHO CHO+℃100100%其他环加成反应实例见P 541~542。
环加成除[ 2+2 ]、[ 4+2 ]外,还有[ 4+4 ]、[ 6+4 ]、[ 6+2 ]、[ 8+2 ]等。
例如:[ 2+2 ]、[ 4+4 ]、[ 6+2 ]的归纳为π电子数4n 的一类;[ 4+2 ] 、[ 6+4 ]、[ 8+2 ]的归纳为π电子数4n+2的一类。
环加成反应规律:§ 18-4 σ- 键迁移反应双键或共轭双键体系相邻碳原子上的σ键迁移到另一个碳原子上去,随之共轭链发生转移的反应叫做σ键迁移反应。
CO 2CH 32CH 3+H HCO 2CH 32CH 3OCH 3O CH 32υh H 3[ 4+4 }+345[ 6+4 ]例如:一、[1,j ] σ键迁移 1.[1,j ]σ键氢迁移 [1,j ]σ键氢迁移规律:迁移规律可用前线轨道理论解释:为了分析问题方便,通常假定C-H 键先均裂,形成氢原子和碳自由基的过渡态。