气体的制取、净化和除杂知识讲解
- 格式:doc
- 大小:660.94 KB
- 文档页数:4


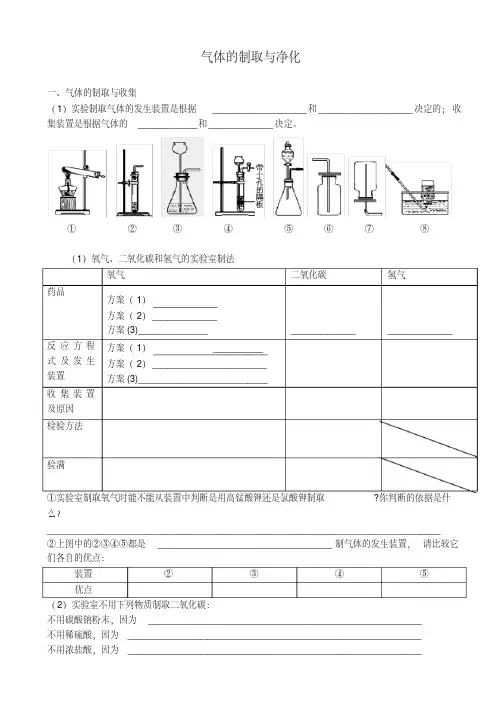
气体的制取与净化一、气体的制取与收集(1)实验制取气体的发生装置是根据___________________和___________________决定的;收集装置是根据气体的____________和_____________决定。
①②③④⑤⑥⑦⑧(1)氧气、二氧化碳和氢气的实验室制法氧气二氧化碳氢气药品方案(1)方案(2)_____________方案(3)______________ _____________ _____________反应方程式及发生装置方案(1)__________ 方案(2)_______________________ 方案(3)__________________________收集装置及原因检验方法验满①实验室制取氧气时能不能从装置中判断是用高锰酸钾还是氯酸钾制取?你判断的依据是什么?_______________________________________________________________________________②上图中的②③④⑤都是___________________________________制气体的发生装置,请比较它们各自的优点:装置②③④⑤优点(2)实验室不用下列物质制取二氧化碳:不用碳酸钠粉末,因为_______________________________________________________不用稀硫酸,因为___________________________________________________________不用浓盐酸,因为___________________________________________________________二、气体的干燥与净化用过氧化氢溶液制取氧气中通常会混有___________,用盐酸制取的气体中常会混有________和_________气体;通过溶液的气体中常混有__________。





气体除杂九年级化学知识点气体除杂是化学中的一个重要知识点,它涉及到气体的纯化和净化过程。
在化学实验和工业生产中,常常需要处理含有杂质的气体,为了确保实验结果的准确性和产品质量的稳定性,必须对气体进行除去杂质的处理。
本文将为大家介绍气体除杂的相关知识点。
一、气体的纯化方法气体的纯化方法主要包括物理方法和化学方法。
1. 物理方法物理方法主要利用了气体杂质的不同性质,通过物理性质的差异将气体中的杂质除去。
(1)冷凝法:根据气体的沸点差异,利用低温将混合气体冷凝,使其中的杂质凝固而得到纯净气体。
(2)吸附法:利用活性炭等材料对气体杂质的吸附性,将气体通入含有活性炭的吸附设备,通过吸附剂的作用将气体中的杂质吸附剔除。
(3)扩散法:利用气体分子速度分布不均匀的特性,将气体通过多个孔隙,使得分子速度快的气体分子相对集中在一起,达到纯化的目的。
2. 化学方法化学方法主要通过化学反应将气体中的杂质转化为其他物质,以达到纯化的目的。
(1)氧化还原法:通过氧化还原反应,将气体中的杂质氧化或还原为其他物质,再通过其他方法将其除去。
(2)吸收法:利用溶液中某些物质与气体杂质发生化学反应,将其吸收并与溶液中的其他物质结合,从而将杂质除去。
二、常见的气体除杂设备气体除杂的设备种类繁多,下面将介绍几种常见的设备。
1. 分子筛装置分子筛主要是一种多孔的固体物质,具有特定的吸附性能。
它可将分子直径较大的杂质截留在表面,从而达到除杂的效果。
分子筛广泛应用于石油、化工、医药等行业。
2. 活性炭过滤器活性炭是一种多孔的吸附剂,能有效去除气体中的有机杂质、异味物质和一些有毒有害气体。
活性炭过滤器广泛应用于空气净化、防毒面具等领域。
3. 冷凝器冷凝器是一种将气体冷凝成液体的装置。
它通过降低气体的温度,使气体中的水蒸气等杂质冷凝成液体,从而实现除湿和除杂的功能。
4. 吸附塔吸附塔是用于气体吸附除杂的设备,它采用吸附剂将气体中的杂质吸附下来,从而实现气体的纯化。

中学化学专题讲座气体的试验室制备、净化和收集1.气体制备试验的基本过程(1)气体制备试验装置一般包含以下几部分发生装置―→净扮装置―→干燥装置―→尾气处理装置 (2)气体制备的一般试验操作步骤①组装(从下到上,从左到右);②检验装置的气密性;③加入药品;④排尽装置内的空气;⑤验纯;⑥反应;⑦拆除装置。
2.气体发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类: (1)固体+固体――→△气体 发生装置:制备气体:O 2、NH 3、CH 4等留意事项:①试管口应稍向下倾斜,以防止产生的水蒸气在试管口冷凝后倒流,而使试管炸裂。
②铁夹应夹在距试管口1/3处。
③固体药品应平铺在试管底部。
④胶塞上的导管伸入试管内不能过长,否则会影响气体导出。
⑤如用排水集气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯,防止水倒吸。
(2)固体+液体或液体+液体――→△气体 发生装置:(a) (b) (c) 制备气体:Cl 2、C 2H 4等留意事项:①烧瓶应固定在铁架台上。
②先把固体药品放入烧瓶中,再缓缓加入液体。
③分液漏斗应盖上盖,留意盖上的凹槽对准分液漏斗颈部的小孔。
④对烧瓶加热时要垫上石棉网。
⑤液体+液体――→△气体时要加沸石,防止暴沸,如用(b)装置制取乙烯时需加碎瓷片。
⑥(c)装置中导管的作用是平衡气压,便于分液漏斗中的液体顺当滴下。
(3)固体+液体(不加热)―→气体发生装置:制备气体:H2、CO2、NO2、SO2、NO等留意事项:①块状固体及液体的混合物在常温下反应制备气体,可用启普发生器制备,当制取气体的量不多时,也可采纳简易装置。
②简易装置中长颈漏斗的下口应伸入液面以下,否则起不到液封作用而无法运用。
③加入块状固体药品的大小要相宜。
④加入液体的量要适当。
⑤最初运用时应待容器内原有的空气排净后,再收集气体。
⑥在导管口点燃氢气或其他可燃性气体时,必需先检验纯度。


高中化学气体除杂大全在高中化学中,处理气体除杂(或者气体制备和纯化)是一个重要的实验和理论主题。
以下是一些与气体制备和纯化相关的重要概念和方法:
1. 气体制备方法:
•分液漏斗法:通过溶解固体反应产生的气体在水中收集。
•实验室制备:例如,通过反应金属与酸、碳酸氢盐分解等。
•电解法:通过电解水制备氢气和氧气。
2. 气体的纯化:
•吸收法:利用吸附剂吸附气体中的杂质。
•液体气体分馏:利用液体的不同沸点分离杂质。
•压缩与冷却:通过压缩和冷却将杂质凝结或沉淀。
3. 气体分离方法:
•分子筛分离:利用分子筛对不同大小的分子进行筛选。
•膜分离:使用半透膜将气体分离。
4. 气体分析方法:
•质谱法:通过质谱仪分析气体组成。
•光谱法:利用光谱仪测定气体中的特定波长。
5. 气体的性质和行为:
•理想气体定律:包括Boyle's Law、Charles's Law、Avogadro's Law。
•气体扩散:描述气体在空气中的分散过程。
•气体溶解度:描述气体在液体中的溶解特性。
6. 气体的安全处理:
•气体收集和储存:安全地收集和储存气体,使用适当的装置和容器。
这些概念涵盖了高中化学中关于气体制备和纯化的基本知识。
在实验中,学生可能会接触到一些基本的气体制备和纯化实验,以及相应的理论知识。
气体的净化、除杂和干燥(一定先净化后干燥)1、气体的净化(除杂)将不纯的气体中杂质气体除去从而得到较纯净的气体的过程叫做气体的净化。
若选用的试剂是液体,这个过程又叫做气体的洗涤。
气体的净化常用试剂:(1)除CO2:可用氢氧化钠溶液。
反应原理。
(2)除HCl :可用NaOH溶液、Na2CO3溶液、NaHCO3溶液或水反应原理、、(3)除H2:先用灼热的氧化铜将其氧化成水,再用浓硫酸或碱石灰吸收。
反应原理。
(4)CO :先用灼热的氧化铜将其氧化为CO2,再用NaOH溶液吸收。
反应原理、。
(5)除O2:可用灼热的铜网。
反应原理。
注意:净化气体所用的试剂应根据气体的性质来选定。
吸收的试剂只能吸收杂质气体,不能吸收待净化的气体。
如CO2中混有HCl时,不能用NaOH溶液、Na2CO3溶液,因为它们既吸收了HCl,又吸收了CO2,所以要选用NaHCO3溶液,可将CO2中HCl除去。
三、气体的检验及性质实验A B C D注意:要证明某混合气体中某气体的存在,必须先除去混合气体中会造成所证气体实验现象不可靠的气体。
初中化学中常验证的气体有水蒸气、CO2、HCl气体、CO、H2等,它们通过试剂所表现的现象分别为:①水蒸气———无水CuSO4———变蓝(一般放在最先验证); ②CO2———澄清的石灰水———白色浑浊; ③HCl———AgNO3溶液———白色沉淀;④H2———灼热氧化铜、无水CuSO4———黑色粉末变红,白色粉末变蓝; ⑤CO———灼热氧化铜、澄清石灰水———黑色粉末变红、石灰水变浑浊。
四、其它1、尾气体的处理方法(当收集的是有毒气体,会污染环境,还需要考虑尾气的处理。
) (1)燃烧法 如:CO (2)液体吸收 如:SO 2 (3)收集法2、水的处理(1)作为杂质而除去:要先除去其他杂质,后干燥。
(2)作为产物的检验:先检验水,再检验其他产物。
(3)水的定测量:前后都要排除外来水的干扰。
备注:证明时,一定要先证明水再证明其它物质,证明水一定要用无水硫酸铜;除去水时,先除去杂质,再除去水 。
二轮复习:中考化学实验气体的制备与净化一、气体的制备1二、气体的净化(除杂、枯燥、尾气吸收)1、原那么:先除杂、后枯燥(先验水、后除水)2、常见试剂:Ca(OH)2溶液碱性证明CO2生成(是否存在) 确定CO2是否除尽出去少量CO2NaOH溶液吸收/除去CO2证明有CO2生成(质量变化)酸性:浓H2SO4枯燥:吸水证明有H2O生成(质量变化)证明H O生成(是否存在)3、洗气瓶的功能①枯燥、除杂:长进短出②贮气:短进气、长出水(短进长出)确定2 ρ>ρ空气:长进短出CuSO4粉末H2O是否除尽③集气ρ<ρ:短进长出重点:排序出去少量H2O方法:先排大装置,再排小接口注意:①装置只能使用一次(气体不用确认是否除尽)②装置可以重复使用(气体必须确认是否除尽)④平安瓶空气长进长出:除杂、集气短进短出:防倒吸2【例1】某同学用如下图装置进行实验,验证二氧化碳能与水反响(氮气的密度小于空气的密度)操作为: ①从b 端通入氮气②从分液漏斗中滴加适量水 ③从a 端通入二氧化碳④将石蕊溶液染成紫色的枯燥纸花放入广口瓶中其中实验操 作顺序最合理的是( ) A. ①②③④ B. ④③②①C. ④①③①②D. ④③①②③【例2】如下图,将气体X 和气体Y 同时通入液体Z ,最终一定能看到液体变浑浊的是( )序号 气体x 气体y 液体z A H 2 CO 2 水 B HCl CO 2 石灰水 C CO 2 O 2 氯化钙溶液 DCO 2CO石灰水【例3】人吸入空气,排出CO 2等气体。
为了证明人呼出的气体中含有CO 2且 能有效排除空气中CO 2的干扰,某学生设计了以下图所示的实验装置, 为了除去空气中的CO 2和检验人呼出的气体中含有CO 2,那么锥形瓶Ⅰ、Ⅱ中参加的试剂为( ) 瓶Ⅰ 瓶ⅡA CaCl 2 NaOHB NaOH Ca(OH)2C 石蕊 酚酞 DNa 2SO 4CaCl 2【例4】以下为二氧化碳制取和性质实验的组合装置图,A 中为盐酸和石灰石,请根据如下图答复相关问题.(假设各步均充分反响) ⑴根据上述实验如下图,写出该实验的目的是 假设关闭K 2翻开K 1,装置B 中盛放的药品是 ;假设关闭K 1翻开K 2,可看到的实验现象是 ⑵关闭E 、翻开C 时,假设F 中盛放的是枯燥剂,观察到D 中的蜡烛熄灭,说明二氧化碳具有 的性质3【例4】⑶关闭E 翻开C 时,假设F 中盛放的是过氧化钠(Na 2O 2),那么观察到D 中的蜡烛燃烧得更旺,说明有氧气生成.他的连接顺序为:A→ →F .小明还证明了反响后F 中含有碳酸钠,写出二氧化碳与过氧化钠(Na 2O 2)反响的化学方程式【例5】用下面的装置将一定量的CO 2和CO 的混合气体进行别离和枯燥。
气体的制取、净化和除杂
初中化学中的实验组合题一般以氧气、氢气和二氧化碳三大气体的制取和性质实验或迁移应用其原理和性质的实验为主线,将许多仪器连接起来形成完整的实验装置图,再根据要求进行实验。
实验仪器组装公式:气体发生装置—除杂装置—干燥装置—气体收集装置→尾气处理
固、液态物质反应常用装置:
一、实验室制取三大气体中常见的要除的杂质:
1、制O2要除的杂质:水蒸气(H2O)
2、用盐酸和锌粒制H2要除的杂质:
水蒸气(H2O)、氯化氢气体(HCl,盐酸酸雾)(用稀硫酸没此杂质)
3、制CO2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl)
常用除杂方法:
除水蒸气可用:
浓流酸、碱石灰(主要成份是NaOH和CaO)、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色)、生石灰、CaCl2固体等
除HCl气体可用:
AgNO3溶液(可检验出杂质中有无HCl)、石灰水、NaOH溶液、KOH溶液
除CO2可用:
澄清石灰水(可检验出杂质中有无CO2)、NaOH溶液、KOH溶液、碱石灰等
气体除杂的注意事项:
A 选择除杂试剂:一般只能跟杂质起反应,而不能与被净化的气体反应。
B 除杂务尽:选择除杂试剂要注意反应进行的程度。
(如除去CO2时用氢氧化钠溶液比用澄清石灰水要好。
因为氢氧化钠的溶解度比氢氧化钙要大很多,因此其溶质质量分数较大。
)
C 有许多杂质要除去时,要注意除杂的顺序。
一般来说,杂质中有许多酸性杂质时,先除酸性较强的杂质;而水蒸气要放在最后除去。
即:除杂和干燥一般是先除杂后干燥。
除去杂质和干燥的装置一般用洗气瓶或干燥管。
若用“洗气瓶”,要注意“长进短出”,若用干燥管要注意“大进小出”。
干燥剂
可干燥气体不可干燥气体干燥装置
名称或化学式酸碱性状态
浓H2SO4 酸性液态H2、N2、O2、CO2、
HCl、CH4、CO等
NH3 A
固体NaOH 生石灰碱性固态
H2、O2、N2、CH4、
CO、NH3等
CO2、SO2、HCl B或C
无水CaCl※中性固态除NH3外所有气体NH3 B或C
根据气体在水或吸收剂里的溶解性不同,可采用不同的方法来吸收气体使之溶解。
在水中极易溶解的气体如氨、氯化氢、溴化氢等应采用B法,装置特点是导气管连接了一个倒扣的漏斗,漏斗边缘浸入水中约1mm~2mm。
它的优点是可防止水倒流入气体发生装置,又可增大吸收面积,利于气体充分溶解。
它有自动调节气体发生装置内外压力趋于平衡的作用,即有自控倒吸作用。
如气体的溶解度不太大,如氯气、硫化氢等应采取A法。
三、气体检验
1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.
2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.
3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.
4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.
5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.
三、常用实验方法来验证混合气体里含有某种气体
(1)有CO的验证方法:(先验证混合气体中是否有CO2,有则先除掉)
将混合气体通入灼热的CuO,再将经过灼热的CuO的混合气体通入澄清石灰水。
现象:黑色CuO变成红色,且澄清石灰水要变浑浊。
(2)有H2的验证方法:(先验证混合气体中是否有水份,有则先除掉)
将混合气体通入灼热的CuO,再将经过灼热的CuO的混合气体通入盛有无水CuSO4中。
现象:黑色CuO变成红色,且无水CuSO4变蓝色。
(3)有CO2的验证方法:
将混合气体通入澄清石灰水。
现象:澄清石灰水变浑浊。
四、其他
1、氢气还原氧化铜:H2 + CuO === Cu + H2O 现象:黑色粉末状固体逐渐变为红色,试管口有水珠生成。
操作注意事项:实验开始时需先通一会氢气,再加热氧化铜,防止
氢气与空气混合加热时试管爆裂;实验停止后,要继续通入氢气,
直到试管冷却为止,防止灼热的铜被空气中的氧气氧化成氧化铜。
即:操作时应先通入纯净H2,将试管中空气排净再加热。
反应完毕
先熄灭酒精灯,待试管冷却后再停止通入H2。
重要提示:氢气还原氧化铜的实验装置中容易出现的典型错误:
(a )试管口高于试管底。
应使试管口略低于试管底,防止反应生成的水倒流。
(b )试管口加了胶塞。
试管口不能加胶塞,否则气体排不出,容易造成试管炸裂。
(c )导管略伸入试管口。
应使导管贴试管上壁伸入试管底部。
2、反应器为硬质玻璃管:气体和固体的反应,如CuO+CO Cu+CO2(图3)
注意:先将管内空气排净再加热;反应后应使生成物在CO 气流中冷
却。
3、一氧化碳还原氧化铁:3CO+Fe2O3 ===== 2Fe + 3CO2
操作注意事项:实验最好在通风橱中进行。
实验时应该先通—会CO ,
以排除试管中的空气,防止CO 与空气混合加热时引起爆炸。
多余的
一氧化碳不能直接排到空气中,应对着火焰烧掉。
4、木炭和氧化铜粉末在高温下的反应: C + 2CuO === 2Cu + CO2 ↑
实验现象:黑色固体逐渐变为红色,澄清石灰水变浑浊。
5、二氧化碳灭火
现象:烧杯中下面的蜡烛先熄灭,上面的蜡烛后熄灭。
结论:CO2气体比空气重,一般情况下不支持燃烧。
高温
高温 高温。