免疫球蛋白A(IGA)测定试剂盒(免疫比浊法)产品技术要求ldm
- 格式:docx
- 大小:13.35 KB
- 文档页数:2

免疫球蛋白A测定试剂盒(免疫比浊法)
适用范围:本产品用于体外定量测定人血清中免疫球蛋白A的含量。
1.1规格
具体产品规格见下表:
1.2组成成分
试剂1:
Tris缓冲液0.1mol/L 试剂2:
抗人免疫球蛋白A抗体0.1mg/ml
2.1 外观
2.1.1 外包装完整无破损;
2.1.2 试剂1:无色澄清透明液体;
2.1.3 试剂2:无色或淡黄色澄清或微浊液体。
2.2 净含量
净含量不低于标示值。
2.3 试剂空白吸光度
在主波长340nm、副波长700nm、37℃条件下,试剂空白吸光度不大于0.3。
2.4 线性
2.4.1 线性范围
[40.0,560.0]mg/dl,相关系数r>0.990。
2.4.2 线性偏差
(80.0,560.0]mg/dl线性范围内,相对偏差不超过±15%;
[40.0,80.0]mg/dl线性范围内,绝对偏差不超过±16.0mg/dl。
2.5 分析灵敏度
检测浓度为361.0mg/dl的样本时,吸光度变化不小于0.24。
2.6 重复性
测试高、中、低浓度的新鲜人血清或质控品,重复测试10次,高值:CV ≤10%;中值:CV≤12%;低值:CV≤15%。
2.7 批间差
用三个不同批号的试剂测试同一样本,重复测试3次,相对极差R≤10%。
2.8 准确度
测定ERM-DA470K/IFCC标准物质,测定结果应不超过标示值的±15%。
2.9 稳定性
原包装试剂2~8℃避光储存,有效期12个月。
效期后1个月内产品应符合2.3、2.4和2.8的要求。
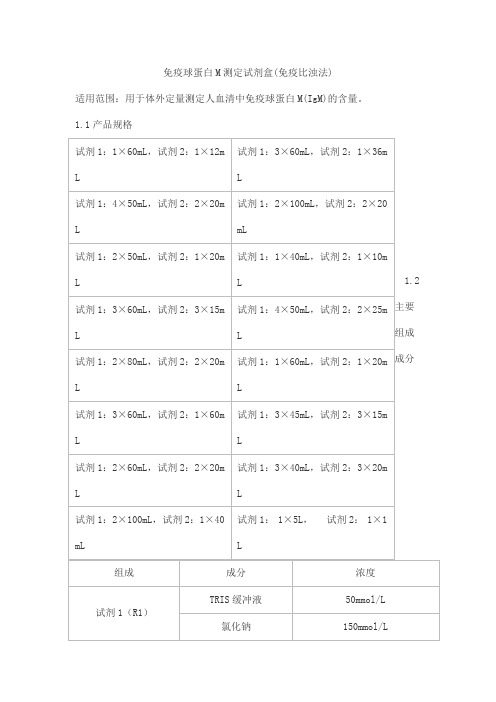
免疫球蛋白M测定试剂盒(免疫比浊法)
适用范围:用于体外定量测定人血清中免疫球蛋白M(IgM)的含量。
1.1产品规格
2.1 外观
试剂1应为无色澄清液体,试剂2应为无色或淡褐色澄清液体。
试剂盒标签标识清晰,外包装完整无损。
2.2 装量
不少于瓶签标示量。
2.3 试剂空白
在340nm处测定试剂空白吸光度,应≤0.5。
2.4 分析灵敏度
测试2.0 g/L的被测物时,吸光度变化值(ΔA)应≥0.1。
2.5 线性
2.5.1 在[0.1,
3.0] g/L区间内,线性相关系数r≥0.990。
2.5.2 在[0.1,1.0) g/L区间内,线性绝对偏差不超过±0.15g/L;在[1.0,
3.0] g/L区间内,线性相对偏差不超过±15%。
2.6 精密度
2.6.1 重复性
测试高、低两个水平浓度样本,其结果的变异系数应不超过5%。
2.6.2 批间差
随机抽取三批试剂盒测试同一份样本,批间相对极差(R)应≤10%。
2.7 准确度
待检系统与比对系统测值的相关系数r≥0.975;在[0.1,1.0) g/L区间内,绝对偏差不超过±0.15g/L;在[1.0,3.0] g/L区间内,相对偏差不超过±15%。
2.8稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7之规定。

免疫球蛋白M测定试剂盒(免疫比浊法)适用范围:本试剂盒用于体外定量测定人血清中免疫球蛋白M浓度。
1、型号规格试剂1:1×30ml;试剂2:1×10ml试剂1:2×30ml;试剂2:1×20ml试剂1:1×60ml;试剂2:1×20ml试剂1:3×80ml;试剂2:4×20ml试剂1:4×60ml;试剂2:4×20ml试剂1:2×60ml;试剂2:2×20ml试剂1:2×30ml;试剂2:2×10ml试剂1:6×60ml;试剂2:2×60ml2.1 外观试剂1、试剂2应澄清、无异物。
2.2 净含量试剂的净含量不少于标称装量。
2.3 试剂空白吸光度用生理盐水作为样本加入试剂测试时,试剂空白吸光度应<0.40A。
2.4 分析灵敏度IgM含量为1.7g/L时,测定吸光度差值的绝对值应>0.005△A。
2.5 线性区间试剂(盒)线性在[0.1,5.0]g/L区间内:2.5.1 线性相关系数(r)应不小于0.990;2.5.2 [0.1,1.0]g/L区间内,线性绝对偏差不超过±0.2g/L;(1.0,5.0]g/L区间内,线性相对偏差不超过±10%。
2.6 精密度2.6.1 重复性用相同批号试剂盒测试两个水平的样本,所得结果的变异系数(CV)应<10%。
2.6.2 批间差用3个不同批号试剂盒测试两个水平的样本,试剂(盒)批间相对极差应<10%。
2.7 准确度与已上市的同类产品比对,用40个在[0.1,5.0]g/L区间内不同浓度的人源样本,用线性回归方法计算两组结果的相关系数(r)不小于0.990;[0.1,1.0]g/L 区间内,线性绝对偏差不超过±0.2g/L;(1.0,5.0]g/L区间内,线性相对偏差不超过±10%。

免疫球蛋白M测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清中免疫球蛋白M的含量。
1.1 包装规格表1 包装规格试剂1:2×50ml、试剂2:2×10ml试剂1:4×50ml、试剂2:2×20ml试剂1:30×4.3ml、试剂2:6×4.3ml试剂1:30×3.8ml、试剂2:6×3.8ml试剂1:1×60ml、试剂2:1×12ml试剂1:1×25ml、试剂2:1×5ml480测试/盒(试剂1:2×50ml、试剂2:2×10ml)600测试/盒(试剂1:2×50ml、试剂2:2×10ml)720测试/盒(试剂1:2×50ml、试剂2:2×10ml)校准品(液体,1水平):1×1ml质控品(液体,水平1):3×1ml;1×1ml质控品(液体,水平2):3×1ml;1×1ml质控品(液体,水平3):3×1ml;1×1ml 1.2 主要组成成分表2 主要组成成分试剂成分浓度试剂1:18.16 mmol/L三羟甲基氨基甲烷缓冲液pH7.6氯化钠聚乙二醇防腐剂123.20 mmol/L试剂2:三羟甲基氨基甲烷缓冲液pH7.6IgM抗体防腐剂18.16mmol/L校准品:人血清基质免疫球蛋白M≥50% 180~300 mg/dl质控品:人血清基质免疫球蛋白M≥50%水平1:40~150 mg/dl 水平2:120~250 mg/dl 水平3:200~400 mg/dl2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色到淡黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色或浅黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色或浅黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。

免疫球蛋白AIgA测定免疫比浊法1.原理分析原理是液相免疫沉淀散射比浊终点测定法。
抗血清用缓冲液稀释后加到一份病人血清中,经过孵育后可以测定抗原抗体复合物产生的散射光。
散射光结果和血清中的IgA浓度成正比。
2.标本采集:2.1标本采集前病人准备:受检者空腹2.2标本种类:血清或血浆2.3标本要求:取被检者静脉血2ml,室温放置不超过4小时,分离血清备用。
3.标本储存:待测标本在2-8℃存放不超过24小时,-20℃不超过三个月,-70℃长期保存。
避免反复冻融。
4.标本运输:室温运输5.标本拒收标准:细菌污染、溶血、脂血不能作测定。
6.试剂6.1试剂名称:免疫球蛋白A检测试剂盒6.2试剂生产厂家:芬兰Orion诊断试剂公司6.3包装规格:60Test/kit6.4试剂盒组成:缓冲液30ml空白缓冲液30ml抗血清试剂0.5ml定标液0.5ml磁卡1张7.仪器设备:7.1仪器名称:OrionTurboxRplus特定蛋白分析仪7.2仪器厂家:芬兰Orion集团公司7.3仪器型号:Turboxplus8.操作步骤:8.1试剂配制:8.1.1抗血清应用液准备:吸取500ul抗血清加到反应缓冲液中,轻轻混匀,应用液2-8℃可保存12个星期。
8.1.2空白缓冲液:液体待用。
8.1.3定标液:用0.9%NaCL进行1:51稀释。
定标液根据IFCC提供的材料CRM470进行标定。
收集与处理样品:样品用0.9%Nacl进行1:51稀释。
为每一份样本测定准备一份样品空白,同样,为定标液另外准备一份定标液空白。
准备两份定标液测定(定标完成后,标准曲线数据存储在磁卡内。
下次检测如使用同批试剂,可以不必做定标而直接使用磁卡上的定标信息)。
如下准备各比色管:轻轻摇动混匀,室温18-25℃放置30±5分钟。
仪器测试步骤:参见TurboxR特定蛋白分析仪作业指导书。
9.结果计算:仪器直接计算并打印结果。
10.临床意义:IgA分为血清型和分泌型两种。

免疫球蛋白A测定试剂盒(免疫比浊法)
组成:
试剂1(R1)主要成分:Tris缓冲液(pH 6.0~9.0)4mmol/L;
试剂2(R2)主要成分:抗IgA抗血清适量。
适用范围:用于体外定量检测人血清中免疫球蛋白A的浓度。
2.1 外观
外包装完整无破损,标签清晰;试剂1应为无色透明溶液;试剂2应为无色透明溶液。
2.2 净含量
应不低于试剂瓶标示装量。
2.3 试剂空白
在340nm处测定试剂空白吸光度,应≤0.20。
2.4 分析灵敏度
测定浓度为450mg/dl的样品,吸光度变化(ΔA)应不低于0.15。
2.5 线性
2.5.1在[18.0,621.0]mg/dl范围内,线性回归的相关系数应不低于0.990;
2.5.2测试浓度[50.0,621.0]mg/dl的样品,相对偏差应不超过±15%;测试浓度[18.0,50.0)mg/dl的样品,绝对偏差应不超过±7.5mg/dl。
2.6 重复性
2.6.1 批内重复性
变异系数(CV)应不超过5%。
2.6.2 批间差
对同一份样品进行重复测定,相对极差(R)应不超过10%。
2.7 准确度
回收率应在85%~115% 范围内。
2.8空白限
试剂空白限为18mg/dL。
2.9 稳定性
原包装试剂在2℃~8℃条件下有效期为18个月,取到效期后6个月内的试剂盒检测,应符合本技术要求2.1、2.3、2.4、2.5、2.6.1、2.7、2.8之规定。
医疗器械产品技术要求编号:免疫球蛋白(IgG、IgA、IgM)检测试剂盒(免疫比浊法)1.产品型号/规格及其划分说明序号规格12×200Tests2R1:2×80ml、R2:2×20ml3R1:2×60ml、R2:2×15ml4R1:2×40ml、R2:2×10ml5R1:2×50ml、R2:1×25ml6校准品(选配):1×1ml2.性能指标2.1外观试剂R1溶液应无色、无颗粒、无杂质、无沉淀和悬浮物;试剂R2溶液应呈淡黄色、无颗粒、无杂质、无沉淀和悬浮物;校准品为米白色至浅黄色冻干粉末。
2.2净含量试剂盒各试剂装量应不小于标示值。
2.3试剂空白吸光度应为≤0.4,IgA、用蒸馏水作为样品加入试剂测试,IgG试剂空白吸光度A570nm应为≤0.4。
IgM试剂空白吸光度A340nm2.4分析灵敏度测试IgG:4.85g/L、IgA:0.94g/L、IgM:0.47g/L被测物时,吸光度差值(△A)IgG应不小于0.20、IgA应不小于0.20、IgM应不小于0.05。
2.5线性范围IgG:在(0~35.0)g/L范围内,其线性相关系数r≥0.990;浓度≥5.0g/L 时,相对偏差≤20%;浓度<5.0g/L时,绝对偏差≤1.0g/L。
IgA:在(0~8.0)g/L范围内,其线性相关系数r≥0.990;浓度≥1.3g/L 时,相对偏差≤20%;浓度<1.3g/L时,绝对偏差≤0.4g/L。
IgM:在(0~4.8)g/L范围内,其线性相关系数r≥0.990;浓度≥0.4g/L时,相对偏差≤20%;浓度<0.4g/L时,绝对偏差≤0.2g/L。
2.6测量精密度2.6.1重复性用控制血清重复测试所得结果的重复性(变异系数,CV)应≤6.0%。
2.6.2批间差批间差应≤10.0%。
2.7准确度用参考物质进行测试,其相对偏差应≤20.0%。
免疫球蛋白G测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清中免疫球蛋白G的含量。
1.1 包装规格表1 包装规格试剂1:2×50ml、试剂2:2×10ml试剂1:4×50ml、试剂2:2×20ml试剂1:4×20ml、试剂2:4×20ml试剂1:30×4.3ml、试剂2:6×4.3ml试剂1:30×3.8ml、试剂2:6×3.8ml试剂1:1×60ml、试剂2:1×12ml试剂1:1×25ml、试剂2:1×5ml480测试/盒(试剂1:2×50ml、试剂2:2×10ml)600测试/盒(试剂1:2×50ml、试剂2:2×10ml)720测试/盒(试剂1:2×50ml、试剂2:2×10ml)校准品(液体,1水平):1×1ml质控品(液体,水平1):3×1ml;1×1ml质控品(液体,水平2):3×1ml;1×1ml质控品(液体,水平3):3×1ml;1×1ml 1.2 主要组成成分表2 主要组成成分试剂成分浓度试剂1:三羟甲基氨基甲烷缓冲液pH7.6 氯化钠聚乙二醇防腐剂18.16 mmol/L 123.20 mmol/L试剂2:三羟甲基氨基甲烷缓冲液pH7.618.16mmol/LIgG抗体防腐剂校准品:人血清基质免疫球蛋白G≥50% 20~30 g/L质控品:人血清基质免疫球蛋白G≥50%水平1:5~10 g/L 水平2:10~18 g/L 水平3:15~28 g/L2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色到淡黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色或浅黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色或浅黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
免疫球蛋白A(IGA)测定试剂盒(免疫比浊法)
适用范围:本产品用于体外定量测定人血清中免疫球蛋白A的含量。
1.1规格
试剂1(R1):2×60mL,试剂2(R2): 2×12mL;
试剂1(R1):4×95mL,试剂2(R2): 3×10mL;
试剂1(R1):1×60mL,试剂2(R2): 1×12mL;
试剂1(R1):1×20mL,试剂2(R2): 1×6mL。
1.2产品组成
1.2.1试剂组成
试剂1(R1)(以下简称R1):无色液体,试剂2(R2)(以下简称R2):浅黄色液体。
R1:PEG4 缓冲液:
包含高分子强化剂的磷酸盐缓冲液,含有0.095%的叠氮化钠。
R2:IgA抗血清,含0.095%的叠氮化钠。
2.1 外观
液体双试剂:R1为无色澄清液体,R2为浅黄色澄清液体。
2.2 净含量
液体试剂的净含量不得低于标示体积。
2.3 空白吸光度
在37℃、340 nm波长、1cm光径条件下,试剂空白吸光度应<0.15 ABS。
2.4 分析灵敏度
浓度为70mg/dL时,吸光度变化范围在(0.08- 0.50)之间。
2.5 线性范围
在[40-560]mg/dL线性范围内,线性相关系数r2≥0.995。
在(100-560]mg/dL,范围内的相对偏差≤10%;测定结果[40-100]mg/dL时绝对偏差≤10mg/dL。
2.6 精密度
试剂盒测试项目精密度 CV< 5 %。
2.7 批间差
不同批号之间测定结果的相对偏差应< 6 %。
2.8 准确度
相对偏差:用参考物质作为样本进行检测,其测量结果的相对偏差应不超过±10%。
2.9稳定性
原包装试剂,在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其线性和准确度,试验结果满足2.5、2.8的要求。