蛋白质的分子结构
- 格式:ppt
- 大小:6.90 MB
- 文档页数:58



蛋白质的分子结构考点总结
●一级结构
●蛋白质中氨基酸的种类和数量以及氨基酸在多肽链中的排列顺序
●肽键、二硫键
●二级结构
●多肽链主链骨架中的若干肽段各自沿某个轴盘旋转或折叠,并以氢键维持从而形成
具有规律的构象或结构
●氢键
●α-螺旋β-折叠β-转角无规则卷曲
●每隔3.6个氨基酸残基上升一圈,螺距0.54nm
●超二级结构
●蛋白质分子中由若干相邻的二级结构单元(α-螺旋、β-折叠、β-转角等)组合在一
起,彼此相互靠近,形成在空间上能辨认的、有规则的二级结构组合体。
●疏水键
●三级结构
●整个多肽链在三维空间上的构象成为球状蛋白质分子。
●氢键、疏水键、离子键、范德华力
●四级结构
●数条具有独立的三级结构和多肽链通过非共价键相互连接而成的聚合体结构
●疏水键(主要)、氢键、范德华力、离子键。





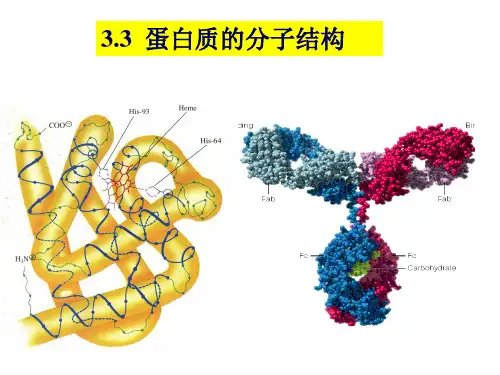
三、蛋白质的分子结构蛋白质的分子结构(一)一级结构(线性结构、基本结构)蛋白质的一级结构(primary structure ) 指它的氨基酸序列 。
比喻:珍珠项链1954年英国生物化学家Sanger 报道了胰岛素(insulin )的一级结构(参见教材P7),这是世界上第一个被确定一级结构的蛋白质。
A 链:21个AA ,B 链:30个AA ,A 、B 两链通过两个二硫键相连,A 链本身第6及11位两个半胱氨酸形成一个链内二硫键。
1960年Moore 和Stein 测出了牛胰核糖核酸酶的一级结构,含124个AA ,链内有4个二硫键。
蛋白质的一级结构是决定其空间结构的基础,而空间结构则是其实现生物学功能的基础。
(二)空间结构(又称构象)定义:是指蛋白质分子内各原子围绕某些共价键的旋转而形成的各种空间排布及相互关系。
Pr 构象:主链构象、侧链构象两者相互依赖,相互影响一般根据蛋白质构象的范围和复杂程度,人为地将Pr 的空间结构分为:二级、三级和四级结构。
1.1.二级结构二级结构二级结构::蛋白质多肽链主链原子的局部空间排布。
(1) 形成二级结构的基础肽键平面:肽键中的C 、H 、O 、N 、四个原子和与它们相邻的两个α碳原子都处在同一个平面上,这个平面称为~。
多肽链=通过可旋转的α-碳原子连接的酰胺平面链提问:影响蛋白质构象的作用力有哪些?内力(内因):蛋白质分子内各原子间作用力外力(外因):与溶剂及其他溶质作用力内因为主,外因通过改变内因起作用(2)基本形式:包括α-螺旋、β-折叠、β-转角、不规则卷曲(自由回转或松散肽段)四种方式。
A. α-螺旋(蛋白质最常见的二级结构形式)天然蛋白质大部分为右手螺旋(顺时针)几个数值:螺旋一周3.6个AA,螺距0.54nm,每个残基跨距为0.15nm作用力:氢键—相邻螺旋之间通过肽键上的酰基氧与亚氨基氢形成。
B.β折叠:是多肽链的折叠形式平行肽链间以氢键从侧面连接的构象维持β-折叠的作用力也是肽键衍生出的氢键:平行式、反平行式C.β转角作用力——同样是肽键衍生来的氢键但由于只有这一个氢键,只形成β—转角结构。

蛋白质分子结构蛋白质结构是指蛋白质分子的空间结构。
蛋白质主要由碳、氢、氧、氮等化学元素组成,是一类重要的生物大分子,所有蛋白质都是由20种不同氨基酸连接形成的多聚体,在形成蛋白质后,这些氨基酸又被称为残基。
蛋白质和多肽之间的界限并不是很清晰,有人基于发挥功能性作用的结构域所需的残基数认为,若残基数少于40,就称之为多肽或肽。
要发挥生物学功能,蛋白质需要正确折叠为一个特定构型,主要是通过大量的非共价相互作用(如氢键,离子键,范德华力和疏水作用)来实现;此外,在一些蛋白质(特别是分泌性蛋白质)折叠中,二硫键也起到关键作用。
为了从分子水平上了解蛋白质的作用机制,常常需要测定蛋白质的三维结构。
由研究蛋白质结构而发展起来了结构生物学,采用了包括X射线晶体学、核磁共振等技术来解析蛋白质结构。
一定数量的残基对于发挥某一生物化学功能是必要的;40-50个残基通常是一个功能性结构域大小的下限。
蛋白质大小的范围可以从这样一个下限一直到数千个残基。
估计的蛋白质的平均长度在不同的物种中有所区别,一般约为200-380个残基,而真核生物的蛋白质平均长度比原核生物长约55%。
更大的蛋白质聚合体可以通过许多蛋白质亚基形成;如由数千个肌动蛋白分子聚合形成蛋白纤维。
蛋白质的分子结构可划分为四级,以描述其不同的方面:一级结构:组成蛋白质多肽链的线性氨基酸序列。
二级结构:依靠不同氨基酸之间的c=o和n-h基团间的氢键形成的稳定结构,主要为α螺旋和β折叠。
三级结构:通过多个二级结构元素在三维空间的排列所形成的一个蛋白质分子的三维结构。
四级结构:用于描述由不同多肽链(亚基)间相互作用形成具有功能的蛋白质复合物分子。
扩展资料:蛋白质的物理性质包括:1、水解性:蛋白质经水解后为氨基酸。
有的蛋白质能溶于水,如鸡蛋白,有的难溶于水,如丝、毛等。
2、盐析性:蛋白质的盐析性一般是可逆的,也就是说,蛋白质经过盐析并没有丧失生物活性。
在蛋白质溶液中加入(NH4)2SO4有沉淀生成,加入水后沉淀有消失,这就是一个盐析的过程。

蛋白质的分子结构一、蛋白质分子的结构层次二、稳定各级结构的作用力一级结构:肽键、二硫键共价键二级结构:氢键(主要作用力)超二级结构疏水相互作用结构域范德华力(引力与斥力)非共价键 三级结构离子键四级结构配位键三、蛋白质的一级结构1.定义:蛋白质的一级结构指多肽链中氨基酸的排列顺序,包括二硫键位置。
2.主要的化学键:肽键,有些蛋白质还包括二硫键。
3.一级结构是蛋白质空间构象和特异生物学功能的基础。
四、蛋白质的二级结构1.定义:多肽链主链沿一定方向折叠盘绕,通过氢键作用形成的局部空间构象。
2.主要的化学键:氢键。
3.基本类型:a-螺旋1 3.6个氨基酸残基上升一圈,螺距0.54nm,每个aa上升0.15nm,右手螺旋。
2氢键:螺旋3.613。
3二面角:φ=-57°,ψ=-47°4R-基团分布于螺旋外侧。
5影响因素:1.同性电荷aa相斥。
2.侧链较大。
3.Gly二面角广泛。
4.Pro形不成氢键。
β-折叠①两条或多条几乎完全伸展的肽链平行排列,通过链间氢键交联形成。
主链呈锯齿状构象。
②相邻aa的轴心距0.35nm。
③侧链R交替分布在片层平面的上、下方。
④分平行式和反平行式。
β-转角1.定义:蛋白质多肽链上的180°回折结构,也称发夹结构。
2.特点:a.一般由4个连续的aa组成。
b.G1y和Pro易出现在β-转角。
c.第1个aa残基C=0与第4个aa残基N-H之间形成氢键。
无规则卷曲:指没有确定规律性的肽链结构,靠氢键维系。
五、蛋白质的超二级结构1.定义:若干相邻的二级结构单元组合在一起,相互作用,形成有规则的(在空间上可辨认的)二级结构组合体。
2.常见类型:aa、βββ、βaβ。
六、蛋白质的结构域1.定义:是球状蛋白质的折叠单位。
在超二级结构基础上,多肽链进一步绕曲折叠成1个或多个(空间可以区分的)近似球状的局部三维实体。
七、蛋白质的三级结构1.定义:在二级结构、超二级结构和结构域的基础上,多肽链进一步盘绕、折叠形成更为复杂的球状分子结构。