影响水电离的因素(定稿)
- 格式:ppt
- 大小:195.00 KB
- 文档页数:19

水溶液中的电离平衡一、电解质和非电解质 1、概念⑴电解质:在水溶液里或熔融状态下能导电的化合物非电解质:在水溶液里和熔融状态下都不能导电的化合物 ⑵强电解质:溶于水或熔融状态下几乎完全电离的电解质 弱电解质:溶于水或熔融状态下只有部分电离的电解质①电解质的强弱与化学键有关,但不由化学键类型决定。
强电解质含有离子键或强极性键,但含有强极性键的不一定都是强电解质,如H 2O 、HF 等都是弱电解质。
②电解质的强弱与溶解度无关。
如BaSO 4、CaCO 3等 ③电解质的强弱与溶液的导电能力没有必然联系。
2、如何判断强弱电解质 (1)物质类别判断:强电解质:强酸、强碱、多数盐、部分金属氧化物 弱电解质:弱酸、弱碱、少数盐和水非电解质:非金属氧化物、氢化物(酸除外)、多数有机物 单质和混合物(不是电解质也不是非电解质) (2)性质判断:熔融导电:强电解质(离子化合物) 均不导电:非电解质(必须是化合物) (3)实验判断:①测一定浓度溶液pH②测对应盐溶液pH③一定pH 溶液稀释测pH 变化 ④同等条件下测导电性3、电解质溶液的导电性和导电能力⑴电解质不一定导电(如NaCl 晶体、无水醋酸),导电物质不一定是电解质(如石墨),非电解质不导电,但不导电的物质不一定是非电解质。
⑵强电解质溶液导电性不一定比弱电解质强。
饱和强电解质溶液导电性不一定比弱电解质强。
二、弱电解质的电离平衡 1、定义和特征 ⑴电离平衡的含义在一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率与离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态。
任何弱电解质在水溶液中都存在电离平衡,达到平衡时,弱电解质具有该条件下的最大电离程度。
⑵电离平衡的特征 ①逆 ②等 ③动 ④定 ⑤变导电性强弱离子浓度 离子所带电荷溶液浓度电离程度2、影响电离平衡的因素⑴浓度:越稀越电离在醋酸的电离平衡CH3COOH CH3COO-+H+加水稀释,平衡向右移动,电离程度变大,但c(CH3COOH)、c(H+)、c(CH3COO-)变小加入少量冰醋酸,平衡向右移动,c(CH3COOH)、c(H+)、c(CH3COO-)增大,但电离程度变小⑵温度:T越高,电离程度越大⑶同离子效应加入与弱电解质具有相同离子的电解质时,使电离平衡向逆反应方向移动。

高中化学学习材料唐玲出品2、影响水的电离平衡的因素(1)温度:升高温度(促进或抑制)水的电离,水的离子积(增大、不变或减小)。
(2)酸或碱:加入酸或碱(促进或抑制)水的电离,水的离子积(增大、不变或减小)。
(3)活泼金属:加入活泼金属(如金属钠)(促进或抑制)水的电离,水的离子积(增大、不变或减小)。
【例1】水的电离过程为H2O H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。
则下列叙述正确的是()A.c(H+)随着温度的升高而降低 B.在35℃时,c(H+)>c(OH-)C.水的电离度α(25℃)>α(35℃) D.水的电离是吸热过程【例2】下列物质加入水中,能够抑制水的电离的是()A.NaCl B.Na C.NaOH D.NaHSO43、Kw的应用:计算酸溶液或碱溶液中氢离子或氢氧根离子的浓度【例3】常温下,在0.01mol·L-1的NaOH溶液中,由水电离出的氢离子浓度为()A.1×10-7 mol·L-1 B.1×10-2 mol·L-1 C.1×10-12 mol·L-1 D.1×10-5 mol·L-1【例4】当温度为95℃时,纯水中H+的物质的量浓度为10—6mol/L。
若将0.01mol的NaOH固体溶解在95℃的水中配成1L的溶液,则溶液中由水电离出的H+的浓度为()A.10—6mol/L B.10—10mol/L C.10—8mol/L D.10—12mol/L【针对练习】1.常温下,在0.1 mol·L-1的CH3COOH溶液中,水的离子积是()A.1×10-14 B.1×10-13 C.1.32×10-14 D.1.32×10-152.常温下,某溶液由水电离出的c(OH-)=1×10-13 mol·L-1,对该溶液叙述正确的是()A.溶液一定显酸性B.溶液一定显碱性C.溶液一定不显中性 D.可能呈酸性,也可能呈碱性3.将纯水加热至较高温度,下列叙述正确的是()A.水的离子积变大,呈酸性 B.水的离子积不变,呈中性C.水的离子积变小,呈碱性 D.水的离子积变大,呈中性4.常温下,某溶液中由水电离产生的c(H+)、c(OH—)满足c(OH—)×c(H+)=1×10—24,则下列各组离子在该溶液中一定可以大量共存的是()A.K+、Na+、AlO2—、Cl—B.Na+、Cl—、SO42—、HCO3—C.NH4+、Na+、NO3—、SO42— D.Ba2+、Na+、NO3—、Cl—5.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是()A.向水中投入一小块金属钠B.将水加热煮沸C.向水中通入二氧化碳气体D.向水中加食盐晶体6.与纯水的电离相似,液氨中也存在着微弱的电离:2NH3NH2-+NH4+,据此,判断以下叙述中错误的是()A.液氨中含NH3、NH4+、NH2-等微粒B.一定温度下,液氨中c(NH4+)与c(NH2-)的乘积为一定值C.液氨的电离达平衡时,c(NH3)=c(NH4+)=c(NH2-)D.不添加任何物质时,c(NH4+)=c(NH2-)7.电导仪测得液态BrF3具有微弱的导电性,若液态BrF3具有类似于水的电离方程式:H2O+H2O H3O++OH-,则液态BrF3中存在的阳、阴离子是()A.Br+和F- B.BrF+2和BrF-4C.BrF+4和BrF-2D.BrF+3和BrF-38.已知水分子间会通过分子间作用力形成“缔合分子”,如nH2O(H2O)n,下列关于水的说法中错误的是()A.25℃时,纯水中c(H+)=10-7mol/L B.温度升高时,水分子间的缔合作用会减弱C.加入CaO,平衡向左移动,水分子数目增加 D.水是一种难电离的弱电解质9.向纯水中加入少量NaHSO4晶体,若温度不变,则溶液中()A.水电离出的H+浓度大于水电离出的OH—浓度 B.c(H+)、c(OH—)乘积增大C.酸性增强 D.OH—浓度减小。


《水的电离》知识清单一、水的电离平衡水是一种极弱的电解质,能微弱地电离:H₂O ⇌ H⁺+ OH⁻在一定温度下,水的电离达到平衡状态,此时电离出的氢离子浓度与氢氧根离子浓度的乘积是一个常数,叫做水的离子积常数,用 Kw 表示。
Kw = c(H⁺)·c(OH⁻)。
需要注意的是,Kw 只与温度有关,温度升高,Kw 增大。
例如,常温(25℃)时,Kw = 10×10⁻¹⁴;100℃时,Kw = 55×10⁻¹³。
二、影响水的电离平衡的因素1、温度升高温度,水的电离平衡向右移动,电离程度增大,Kw 增大;降低温度,水的电离平衡向左移动,电离程度减小,Kw 减小。
2、酸或碱向水中加入酸,增大了氢离子浓度,水的电离平衡向左移动,抑制水的电离;向水中加入碱,增大了氢氧根离子浓度,水的电离平衡向左移动,同样抑制水的电离。
3、盐(1)强酸强碱盐强酸强碱盐对水的电离平衡无影响。
(2)强酸弱碱盐强酸弱碱盐中的弱碱阳离子能与水电离出的氢氧根离子结合生成弱碱,从而促进水的电离。
(3)强碱弱酸盐强碱弱酸盐中的弱酸根离子能与水电离出的氢离子结合生成弱酸,从而促进水的电离。
(4)弱酸弱碱盐弱酸弱碱盐的阴阳离子都能与水电离出的氢离子或氢氧根离子结合,其水解程度较大,对水的电离的促进作用也较大。
4、活泼金属活泼金属(如钠)与水反应,消耗水电离出的氢离子,使水的电离平衡向右移动,促进水的电离。
三、溶液的酸碱性与 pH1、溶液的酸碱性溶液的酸碱性取决于溶液中氢离子浓度和氢氧根离子浓度的相对大小。
c(H⁺)> c(OH⁻),溶液呈酸性;c(H⁺)= c(OH⁻),溶液呈中性;c(H⁺)< c(OH⁻),溶液呈碱性。
2、 pH(1)定义:pH 是氢离子浓度的负对数,即 pH = lgc(H⁺)。
(2)pH 的范围:通常情况下,pH 的范围是 0 ~ 14。
(3)pH 的测定方法① pH 试纸:将一小片 pH 试纸放在表面皿上,用玻璃棒蘸取待测液点在 pH 试纸上,然后与标准比色卡对照读出 pH。
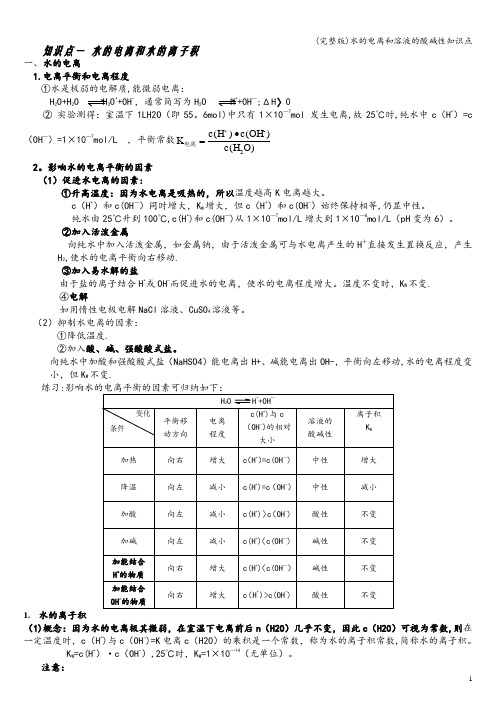
(完整版)水的电离和溶液的酸碱性知识点知识点一 水的电离和水的离子积一、水的电离1.电离平衡和电离程度①水是极弱的电解质,能微弱电离:H 2O+H 2O H 3O ++OH -,通常简写为H 2O H ++OH —;ΔH 〉0② 实验测得:室温下1LH2O (即55。
6mol)中只有1×10—7mol 发生电离,故25℃时,纯水中c (H +)=c (OH —)=1×10—7mol/L ,平衡常数O)c(H )c(OH )c(H K 2-•=+电离2。
影响水的电离平衡的因素 (1)促进水电离的因素:①升高温度:因为水电离是吸热的,所以温度越高K 电离越大。
c (H +)和c(OH —)同时增大,K W 增大,但c (H +)和c(OH -)始终保持相等,仍显中性。
纯水由25℃升到100℃,c(H +)和c(OH —)从1×10—7mol/L 增大到1×10—6mol/L (pH 变为6)。
②加入活泼金属向纯水中加入活泼金属,如金属钠,由于活泼金属可与水电离产生的H +直接发生置换反应,产生H 2,使水的电离平衡向右移动. ③加入易水解的盐由于盐的离子结合H +或OH -而促进水的电离,使水的电离程度增大。
温度不变时,K W 不变.④电解如用惰性电极电解NaCl 溶液、CuSO 4溶液等。
(2)抑制水电离的因素: ①降低温度.②加入酸、碱、强酸酸式盐。
向纯水中加酸和强酸酸式盐(NaHSO4)能电离出H+、碱能电离出OH-,平衡向左移动,水的电离程度变小,但K W 不变.练习:1. 水的离子积(1)概念:因为水的电离极其微弱,在室温下电离前后n (H2O )几乎不变,因此c (H2O )可视为常数,则在一定温度时,c (H +)与c (OH -)=K 电离c (H2O )的乘积是一个常数,称为水的离子积常数,简称水的离子积。
K W =c(H +)·c(OH -),25℃时,K W =1×10—14(无单位)。

水电离的影响因素
(1)酸、碱均抑制水的电离,完全电离或电离程度大于水解程度的酸式盐也抑制水的电离
(2)温度升高可促进水的电离
(3)凡是易水解的盐可促进水的电离
(4)活泼金属与水电离出来的H+反应,促进水的电离
导电性(单质、溶液、熔融状态导电)
(1)自由电子的定向移动;如金属;阴阳离子的定向移动;如氯化钠溶液;半导体的空穴导电和电子导电
(2)共价化合物,在液态条件下,共价键不发生断裂,不能形成自由移动的带电离子,因此不能导电。
如:液态H2SO4、液态HCl、液氨等。
但是,它们虽然液态不能导电,在水溶液中,由于水分子的影响,共价键被破坏,形成阴阳离子,能够导电。
离子化合物在液态下(熔融状态)和在水溶液中,离子键被破坏,形成自由移动的离子,因此都能导电。
所以离子化合物在水溶液中和熔融状态下都能导电,而共价化合物只有在水溶液中才导电。
水的电离平衡
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。
25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
导电能力的强弱与什么有关
1.首先离子浓度,如果离子浓度越大的话,导电能力就越强,传递的电量也就越大。
2.第二,离子所带有的电荷数当离子电荷越高,导电的能力也就越高越频繁。
与之相反,导电的能力就越差。
3.第三,物质中自由移动的电子越高的话,那么导电性就越强。
比如,塑料的电子数不高,导电性差;而铁的电子数高,导电性就高。
水的电离反应水的电离反应是指水分子在适当的条件下发生自身的离子化过程。
这个过程可以通过下面的方程式来表示:H2O ⇌ H+ + OH-在这个方程式中,H2O代表水分子,H+代表氢离子,OH-代表氢氧离子。
水的电离反应是一个平衡反应,可以向前或向后进行。
水的电离反应是一个重要的化学概念,对于理解酸碱性、pH值等概念有着深远的影响。
以下将深入探讨水的电离反应的原理、影响因素以及应用。
一、水的电离反应的原理水的电离反应是基于水分子的结构和化学键的性质。
水分子由一个氧原子和两个氢原子组成,氧原子与两个氢原子之间通过共价键相连。
在水分子中,氧原子的电负性比氢原子大,在共价键中,氧原子带有部分负电荷,氢原子带有部分正电荷。
这使得水分子变得极性,具有极性分子的特性。
由于极性分子的特性,水分子在适当的条件下可以发生电离反应。
在电离反应中,一个水分子会失去一个氢离子(H+离子),变成氢离子(H+),同时剩余的部分会形成氢氧离子(OH-)。
这个过程是可逆的,氢离子和氢氧离子可以重新结合形成水分子。
二、影响水的电离反应的因素水的电离反应受到温度、浓度和压力等因素的影响。
1. 温度:温度对水的电离反应有明显的影响。
通常情况下,温度越高,水的电离度越高,电离反应向右方向进行的速率越快。
反之,温度越低,电离度越低。
2. 浓度:水的电离度与水溶液中H+和OH-离子的浓度有直接关系。
当H+或OH-离子的浓度增加时,电离度也相应增加。
在纯水中,H+和OH-离子的浓度非常低,几乎可以忽略不计。
3. 压力:压力对水的电离反应影响极小,因为水的压力变化对水的电离度几乎没有影响。
三、水的电离反应的应用水的电离反应在许多领域得到了应用。
1. 酸碱性:水的电离反应直接决定了溶液的酸碱性。
当溶液中H+离子的浓度高于OH-离子时,溶液呈酸性;当H+离子和OH-离子的浓度相等时,溶液呈中性;当OH-离子的浓度高于H+离子时,溶液呈碱性。
2. pH值:pH值是描述溶液酸碱性强弱的指标,pH= -log[H+]。
水的电离方程式影响水电离的因素水是一种既能释放质子也能接受质子的两性物质。
水在一定程度上也微弱地离解,质子从一个水分子转移给另一个水分子,形成H3O+和OH-。
通常将水合氢离子H3O+简写为H+,其电离方程式为:H2O+H2O≒H3O++ OH-,简写为H2O≒H++ OH-,是一个吸热过程。
水的电离方程式水是一种既能释放质子也能接受质子的两性物质。
水在一定程度上也微弱地离解,质子从一个水分子转移给另一个水分子,形成H3O+和OH-。
通常将水合氢离子H3O+简写为H+,其电离方程式为:H2O+H2O≒H3O++ OH-,简写为H2O≒H++ OH-,是一个吸热过程。
水的电离是吸热的过程,因此升高温度水的电离平衡向正移动。
影响水电离的因素1.温度:升温总是促进水的电离。
2.酸和碱总是抑制水的电离。
3.能水解的盐,盐类(除酸式盐之外)总是促进水的电离。
4.活泼金属:因为活泼金属总是与水电离出的氢离子反应,使氢离子浓度减小,所以总是促进水的电离。
(升温促电离,稀释促电离,水解促电离)水的物理性质水的物理性质:水是一种无色、无味、无毒、透明的液体,可饮用,纯净的水不易导电。
1、水是生命的源泉。
活细胞中绝大多数化学反应是在水环境中进行的。
水在许多生物化学反应中是一个活泼的参与者,而且是大分子性质的重要决定因素。
水之所以成为生命活动中最重要的溶剂,是由它的物理化学性质所决定的,而它的物理化学性质取决于它的分子结构,即水是一个带有氢键的极性分子。
2、水的介电常数是溶液中最高的,这就意味着按单位容积计算,没有任何溶剂能比水溶解更多种类和数量的溶质,所以水成为最理想的生物溶剂。
3、水的表面张力可以维持植物导管中水流的连续性。
细胞的含水量与其生理活动是否活跃常常是密切相关的。
当细胞含水量充足时其生理活动常较活跃,而当含水量降低时细胞的生命活动也会减弱。
植物细胞所具有的膨压也是通过水分的平衡建立起来的。
《水的电离》知识清单一、水的电离平衡水是一种极弱的电解质,能发生微弱的电离。
水分子在液态时会发生自偶电离,电离方程式为:H₂O + H₂O ⇌H₃O⁺+ OH⁻。
通常简写成:H₂O ⇌ H⁺+ OH⁻。
在一定温度下,水的电离达到平衡状态时,电离出的氢离子浓度与氢氧根离子浓度的乘积是一个常数,叫做水的离子积常数,用 Kw 表示。
Kw = c(H⁺)·c(OH⁻)。
二、影响水的电离平衡的因素1、温度水的电离是吸热过程,升高温度会促进水的电离,Kw 增大;降低温度则抑制水的电离,Kw 减小。
例如,在常温(25℃)下,Kw = 1×10⁻¹⁴;在 100℃时,Kw =1×10⁻¹²。
2、酸或碱向水中加入酸或碱,会增大氢离子或氢氧根离子的浓度,从而抑制水的电离。
比如,向水中加入盐酸,溶液中的氢离子浓度增大,水的电离平衡向左移动。
3、盐(1)强酸弱碱盐这类盐中的阳离子能与水电离出的氢氧根离子结合,从而促进水的电离。
(2)强碱弱酸盐盐中的阴离子能与水电离出的氢离子结合,促进水的电离。
(3)强酸强碱盐对水的电离无影响。
4、活泼金属活泼金属与水反应,消耗水电离出的氢离子,促进水的电离。
三、溶液中氢离子和氢氧根离子浓度的计算1、纯水在纯水中,c(H⁺)= c(OH⁻)。
例如,在 25℃时,Kw = 1×10⁻¹⁴,所以 c(H⁺)= c(OH⁻)=1×10⁻⁷ mol/L 。
2、酸溶液在酸溶液中,氢离子主要来自酸的电离,氢氧根离子来自水的电离。
先根据酸的浓度和电离程度计算出氢离子浓度,再根据 Kw 计算氢氧根离子浓度。
3、碱溶液在碱溶液中,氢氧根离子主要来自碱的电离,氢离子来自水的电离。
先根据碱的浓度和电离程度计算出氢氧根离子浓度,再根据 Kw 计算氢离子浓度。
4、盐溶液(1)强酸弱碱盐氢离子来自水的电离,可根据水解平衡计算。
《水的电离》讲义一、水的电离概述在化学世界中,水是一种极其重要的物质。
而水的电离则是一个关键的概念,它对于理解许多化学现象和反应都具有重要意义。
水是一种弱电解质,能够发生微弱的电离。
其电离方程式可以表示为:H₂O ⇌ H⁺+ OH⁻。
这个过程是可逆的,并且在一定条件下达到动态平衡。
要理解水的电离,首先得明确,虽然水的电离程度很小,但却是无处不在的。
哪怕是在看似纯净的水中,也存在着氢离子(H⁺)和氢氧根离子(OH⁻)。
二、影响水的电离的因素1、温度温度对水的电离有着显著的影响。
一般来说,温度升高,水的电离程度增大。
这是因为温度升高,分子的热运动加剧,更多的水分子有足够的能量来克服电离过程中的能量障碍,从而使电离平衡向电离的方向移动。
例如,在 25℃时,水的离子积常数 Kw = 10×10⁻¹⁴;而在 100℃时,Kw = 55×10⁻¹³。
2、酸和碱向水中加入酸或碱,会抑制水的电离。
酸会提供大量的 H⁺,使平衡向左移动;碱会提供大量的 OH⁻,同样使平衡向左移动。
例如,在盐酸溶液中,由于盐酸完全电离出 H⁺,使得溶液中的 H⁺浓度大大增加,从而抑制了水的电离。
3、盐类盐类对水的电离的影响较为复杂。
有些盐类(如强酸强碱盐)对水的电离无影响;而有些盐类(如强酸弱碱盐、强碱弱酸盐)会促进水的电离。
以氯化铵(NH₄Cl)为例,NH₄⁺会与水电离出的OH⁻结合,生成弱电解质一水合氨(NH₃·H₂O),从而促进水的电离。
三、水的离子积常数水的离子积常数 Kw 是一个重要的概念,它表示在一定温度下,水溶液中 H⁺和 OH⁻浓度的乘积是一个常数。
Kw = H⁺·OH⁻。
在 25℃时,Kw 的值约为 10×10⁻¹⁴。
需要注意的是,Kw 只与温度有关,与溶液的酸碱性无关。
无论是在酸性溶液、碱性溶液还是中性溶液中,在某一温度下,Kw 的值都是固定的。