氧氟沙星标准
- 格式:doc
- 大小:46.50 KB
- 文档页数:3
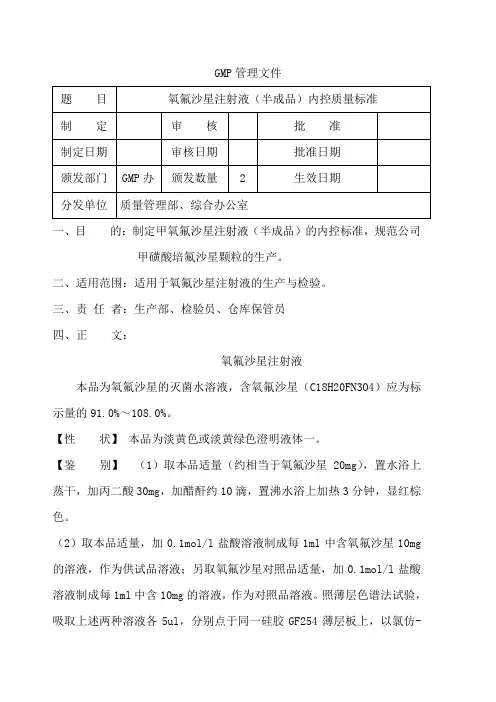
GMP管理文件一、目的:制定甲氧氟沙星注射液(半成品)的内控标准,规范公司甲磺酸培氟沙星颗粒的生产。
二、适用范围:适用于氧氟沙星注射液的生产与检验。
三、责任者:生产部、检验员、仓库保管员四、正文:氧氟沙星注射液本品为氧氟沙星的灭菌水溶液,含氧氟沙星(C18H20FN3O4)应为标示量的91.0%~108.0%。
【性状】本品为淡黄色或淡黄绿色澄明液体一。
【鉴别】(1)取本品适量(约相当于氧氟沙星20mg),置水浴上蒸干,加丙二酸30mg,加醋酐约10滴,置沸水浴上加热3分钟,显红棕色。
(2)取本品适量,加0.1mol/l盐酸溶液制成每1ml中含氧氟沙星10mg 的溶液,作为供试品溶液;另取氧氟沙星对照品适量,加0.1mol/l盐酸溶液制成每1ml中含10mg的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各5ul,分别点于同一硅胶GF254薄层板上,以氯仿-甲醇-氨溶液(4→100)(10:5:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的颜色和位置应与对照品溶液的主斑点相同。
(3)取含量测定项下的溶液,照分光光度法测定,在294nm波长处有最大吸收。
【检查】 PH值应为3.5~5.0。
颜色取本品,加水稀释成每1ml中含2mg的溶液,与黄色5号或黄绿色5号标准比色液比较,不得更深。
热原取本品,加灭菌注射用水制成每1ml中含氧氟沙星10mg的溶液,依法检查,剂量按家兔每1kg体重注射2ml,应符合规定。
其他应符合注射剂项下有关的各项规定。
【含量测定】精密量取本品适量(约相当于氧氟水沙星60mg),置200ml 量瓶中,加0.1mol/l盐溶液稀释至刻度,摇匀;精密量取2ml,置100ml 量瓶中,用0.1mol/l盐酸溶液稀释至刻度,摇匀,照分光光度法,在294nm 波长处测定吸收度;另取在105℃干燥至恒重的氧氟沙星对照品约60mg,同法测定;计算,即得。

氧氟沙星YangfushaxingOfloxacinC18H20FN3O4 361.38本品为(±)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧代-7H-吡啶并[ 1,2,3-de]-[1,4]苯并噁嗪-6-羧酸。
按干燥品计算,含C18H20FN3O4不得少于98.5%。
【性状】本品为白色或微黄色结晶性粉末;无臭、味苦;遇光渐变色。
本品在氯仿中略溶,在甲醇中微溶,在冰醋酸中易溶,在稀酸及0.1mol/L 氢氧化钠溶液中略溶。
比旋度取本品,精密称定,加三氯甲烷溶解并定量制成每1ml中约含10mg 的溶液,依法测定(附录ⅥE),比旋度为-1°至+1°。
【鉴别】(1)取本品适量,加0.1mol/L盐酸溶液制成每1ml中约含0.12mg的溶液,作为供试品溶液,另取氧氟沙星对照品适量,同法制备,作为对照品溶液。
照有关物质项下的色谱条件,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集1003图)一致。
【检查】溶液的澄清度取本品5份,各0.5g,加氢氧化钠试液10ml溶解后,溶液应澄清;如显浑浊,与2号浊度标准液(附录Ⅸ B)比较,不得更浓。
吸光度取本品0.1g,加氢氧化钠试液10ml溶解后,照紫外-可见分光光度法(附录Ⅳ A),在450nm的波长处测定吸收度,不得过0.25。
有关物质取本品适量,精密称定,加0.1mol/L盐酸溶液溶解并制成每1ml 中含1.2mg的溶液,作为供试品溶液;精密量取适量,加0.1mol/L盐酸溶液稀释成每1ml中含2.4μg的溶液,作为对照溶液。
照高效液相色谱法(附录Ⅴ D)测定,用十八烷基硅烷键合硅胶为填充剂;以醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节PH值至2.2)-乙腈(85:15)为流动相;检测波长为294nm。

氧氟沙星滴耳液的说明书五官疾病属于高发疾病之一,五官具体的分为耳鼻喉眼以及脖颈以上的区域,这些区域属于外科当中的五官科范畴,治疗五官类疾病大多数患者都喜欢使用药物进行治疗。
目前治疗药物比较多,患者选择起来比较迷茫。
今天,我们为您推荐一种叫做氧氟沙星滴耳液的药物,它能有效治愈五官类疾病。
【药品名称】通用名称:氧氟沙星滴耳液商品名称:氧氟沙星滴耳液拼音全码:yangfushaxingdierye【主要成份】本品主要成分为氧氟沙星。
【性状】本品为淡黄绿色澄明液体。
【适应症/功能主治】用于治疗敏感菌引起的中耳炎、外耳道炎、鼓膜炎。
【规格型号】5ml:15mg【用法用量】滴耳.成年人一次6~10滴,一日2~3次.滴耳后进行约10分钟耳浴.根据症状适当增减滴耳次数.对小儿滴数酌减。
【不良反应】尚不明确。
【禁忌】尚不明确。
【注意事项】1.只用于点耳。
2.本品一般适用于中耳炎局限在中耳粘膜部位的局部治疗.若炎症已漫及鼓室周围时,除局部治疗外,应同时服用口服制剂。
3.使用本品时若药温过低,可能会引起眩晕.因此,使用温度应接近体温。
4.出现过敏症状时应立即停用。
5.使用本品的疗程以4周为限.若继续给药时,应慎用。
【儿童用药】尚不明确。
【老年患者用药】尚不明确。
【孕妇及哺乳期妇女用药】尚不明确。
【药物相互作用】如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。
【药物过量】尚不明确。
【药理毒理】尚不明确。
【药代动力学】尚不明确。
【贮藏】遮光,密闭保存。
【包装】5ml/瓶。
【有效期】36 月【执行标准】中国药典2010年版二部【批准文号】国药准字H41021439【生产企业】郑州卓峰制药有限公司看了上述的文字简介,您对于氧氟沙星滴耳液这种药物是否有了一个比较清晰的了解了呢?五官科是目前患病率比较高的一个科室,五官是人的脸面,五官的健康与否能直接表现出这个人的整体精神面貌,因此治疗刻不容缓。

甲磺酸左氧氟沙星质量标准甲磺酸左氧氟沙星是一种广谱喹诺酮类抗生素,具有优良的抗菌活性,广泛用于临床治疗疾病。
为了确保甲磺酸左氧氟沙星在生产、储存和使用过程中的质量稳定性和安全性,制定了一系列的质量标准,以保证其合规生产和使用。
下面,我们将探讨甲磺酸左氧氟沙星的质量标准,包括物理性状、化学性质、纯度检测、微生物限度、残留溶剂等方面的要求和检测方法。
一、物理性状甲磺酸左氧氟沙星应为白色或类白色结晶性粉末,应具有良好的溶解性和稳定性。
在质量标准中通常包括粉末的外观、颗粒度、密度、溶解度等要求。
粉末的外观应均匀无结块,颗粒度应符合规定范围,密度应在一定的标准值范围内,溶解度应符合特定的溶剂中的要求。
二、化学性质甲磺酸左氧氟沙星在化学性质方面的质量标准一般包括化学结构、化学纯度和相关物质的要求。
化学结构应符合国际或行业标准,化学纯度一般包括杂质和同分异构体的限度要求,相关物质的含量应符合限定的范围。
三、纯度检测甲磺酸左氧氟沙星的纯度检测主要包括含量测定、杂质测定和同分异构体测定等。
含量测定可以采用高效液相色谱法、气相色谱法等进行,杂质测定通常包括有机杂质和无机杂质的检测,同分异构体测定一般采用质谱法或核磁共振法进行。
四、微生物限度甲磺酸左氧氟沙星作为药品,微生物限度是非常重要的指标。
其质量标准中通常包括细菌总数、大肠杆菌、霉菌和酵母菌等微生物的限度要求,检测方法包括菌落总数法、大肠埃希菌检测法等。
五、残留溶剂在生产过程中,甲磺酸左氧氟沙星可能会残留一些有机溶剂,因此在质量标准中通常包括残留溶剂的限度要求。
常见的残留溶剂包括丙酮、甲醇、乙酸乙酯等,限度要求根据药典标准进行限定,检测方法一般采用气相色谱法或液相色谱法。
甲磺酸左氧氟沙星的质量标准是保证药品质量安全、有效的重要保障。
生产企业应严格按照药典标准进行生产,并通过严格的质量控制体系保证产品的合格。
临床使用单位和药品监管部门也应加强对甲磺酸左氧氟沙星质量的监督检查,保障患者的用药安全。

乳酸左氧氟沙星氯化钠注射液质量标准一、概述乳酸左氧氟沙星氯化钠注射液是一种广泛应用于临床的抗菌药物,具有广谱、高效、低毒副作用等特点,是临床上治疗严重感染症状的重要药物之一。
为了确保乳酸左氧氟沙星氯化钠注射液在临床使用中的安全性和有效性,有必要对其质量标准进行严格管理和监控,以保证药品质量符合要求。
二、质量标准内容1. 外观乳酸左氧氟沙星氯化钠注射液应为无色或微黄色透明液体,无悬浮物和沉淀。
2. pH值药液的pH值需符合规定范围,一般为5.0~8.0。
3. 水分乳酸左氧氟沙星氯化钠注射液的水分含量应符合国家药典规定,一般不超过5.0。
4. 含量测定乳酸左氧氟沙星氯化钠注射液中乳酸左氧氟沙星的含量应符合国家药典规定,一般不低于90.0。
5. 溶解度乳酸左氧氟沙星氯化钠注射液的溶解度应符合国家药典规定,可以通过适当的方法进行测定。
6. 细菌限度乳酸左氧氟沙星氯化钠注射液应符合微生物限度试验要求,无细菌产生。
7. 稳定性乳酸左氧氟沙星氯化钠注射液应在规定的储存条件下,其稳定性应符合国家药典规定。
三、质量标准的重要性严格管理乳酸左氧氟沙星氯化钠注射液的质量标准具有重要意义。
1. 保障临床用药安全乳酸左氧氟沙星氯化钠注射液作为用于治疗严重感染的药物,其质量直接关系到患者的安全和治疗效果。
对其质量标准的严格管理,可以保障临床用药的安全性。
2. 保证治疗效果药品质量差异可能影响其治疗效果,严格的质量标准管理可以确保药品的治疗效果符合临床需求,提高治疗成功率。
3. 维护制药企业声誉严格遵守质量标准可以有效维护制药企业的声誉,提升企业形象,增强患者对药品的信任度。
四、质量标准的监控对乳酸左氧氟沙星氯化钠注射液质量标准的监控需要从原材料采购、生产工艺控制、产品检验评定等环节进行严格管理。
1. 原材料采购选用符合GMP要求的优质原材料,保障产品质量源头。
2. 生产工艺控制建立并严格执行标准的生产工艺流程,确保产品的稳定性和一致性。

乳酸左氧氟沙星注射液质量标准乳酸左氧氟沙星注射液质量标准在医疗领域中,药物质量标准是极为重要的,它直接关系到病人的生命安全。
乳酸左氧氟沙星注射液作为一种抗菌药物,其质量标准更是需要严格把关。
在这篇文章中,我们将深入探讨乳酸左氧氟沙星注射液质量标准的相关知识,以及对其个人观点和理解。
1. 乳酸左氧氟沙星注射液的基本概念乳酸左氧氟沙星注射液是一种广谱抗菌药物,对革兰氏阳性菌和阴性菌均有良好的抑制作用。
它常用于严重感染的治疗,比如呼吸道感染、腹膜腔内感染等。
因其治疗效果显著,逐渐成为临床上的常用药物。
然而,药物的质量标准与否直接关系到其疗效和安全性,下面我们将就乳酸左氧氟沙星注射液的质量标准进行更深入的探讨。
2. 乳酸左氧氟沙星注射液质量标准的相关要求根据国家药典规定,乳酸左氧氟沙星注射液的质量标准应包括外观、溶解度、PH值、有关物质、细菌菌落总数、霉菌和酵母菌数量等多个方面。
这些方面的严格要求是确保药物质量的重要保障。
外观的清澈透明度直接关系到药物的纯净度;PH值的稳定性则关系到药物的稳定性和安全性。
这些标准的制定对于确保药物的质量至关重要。
药品生产企业也要严格按照这些标准进行生产,确保每一批药物都符合规定的质量标准。
3. 我的观点和理解在我看来,药物质量标准的制定和执行是至关重要的。
特别是对于像乳酸左氧氟沙星注射液这样的抗菌药物,其质量标准更应该得到严格的执行。
只有在确保药物质量的前提下,才能保证病人的用药安全和疗效。
相关部门应该加强对药物质量标准的监督和检查,确保其真正得到执行。
药品生产企业也应该加强自身的质量管理,确保生产的药物能够达到规定的质量标准,保障病人的用药安全。
4. 总结通过对乳酸左氧氟沙星注射液质量标准的探讨,我们可以看到,药物质量标准的重要性不言而喻。
只有通过严格的质量标准,才能保证药物的疗效和安全性。
我们也要高度重视药品生产企业自身的质量管理,确保药物质量标准得到有效执行。
希望在未来的医疗领域中,相关部门和企业能够更加重视药物质量标准,共同为病人的用药安全保驾护航。

左氧氟沙星质量标准左氧氟沙星是一种广谱抗生素,常用于治疗呼吸道、泌尿道、肠道和皮肤软组织感染。
作为一种重要的药物,左氧氟沙星的质量标准显得尤为重要。
质量标准是评价药物质量优劣的重要标准,合理的质量标准可以保证药物的疗效和安全性,因此,左氧氟沙星的质量标准应受到重视。
首先,左氧氟沙星的理化性质是确定其质量标准的重要依据。
理化性质包括外观、溶解性、熔点、纯度等指标,这些指标直接关系到药物的质量。
例如,左氧氟沙星的外观应为白色或类白色结晶性粉末,溶于水,几乎不溶于乙醇。
此外,左氧氟沙星的熔点、纯度也是质量标准的重要指标。
只有合格的理化性质,才能保证药物的质量。
其次,左氧氟沙星的药效和安全性是质量标准的核心内容。
药效和安全性是药物的基本属性,直接关系到患者的治疗效果和用药安全。
因此,左氧氟沙星的质量标准应包括对药效和安全性的要求。
药效方面,左氧氟沙星应具有较强的抗菌活性,对感染病原体有较好的杀菌作用。
安全性方面,左氧氟沙星应具有较低的毒副作用,对人体的损害较小。
只有具备良好的药效和安全性,才能保证左氧氟沙星的质量标准。
最后,左氧氟沙星的生产工艺和质量控制是保证质量标准的重要保障。
生产工艺直接关系到药物的质量,合理的生产工艺可以保证药物的稳定性和纯度。
质量控制是对生产过程中各个环节的监控,包括原料药的采购、生产工艺的控制、成品药的检验等。
只有严格执行生产工艺和质量控制要求,才能保证左氧氟沙星的质量标准。
综上所述,左氧氟沙星的质量标准是一个综合性的评价体系,包括理化性质、药效和安全性、生产工艺和质量控制等多个方面。
只有全面考虑,合理确定质量标准,才能保证左氧氟沙星的质量,为患者的治疗提供有效的保障。
希望生产企业和监管部门能够加强对左氧氟沙星质量标准的管理,共同维护药物市场的良好秩序,保障患者的用药安全和疗效。

氧氟沙星水产养殖使用规范1 范围本标准规定了氟喹诺酮类药物氧氟沙星在水产养殖中的作用与用途、使用原则、用法与用量、注意事项和休药期。
本标准适用于水产养殖中细菌性败血症、肠炎病、赤皮病、打印病、白皮病、白头白嘴病、烂鳃病等相关细菌性疾病的治疗。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
NY5071-2002 无公害食品渔用药物使用准则中华人民共和国国务院令第404号《兽药管理条例》中华人民共和国农业部公告第168号《饲料药物添加剂使用规范》3 术语和定义下列术语和定义适用于本标准。
3.1休药期withdrawal time停止给药日至水产品作为安全食品上市时所间隔的时间。
4 作用与用途氧氟沙星属杀菌型抗菌药物,杀菌机理抑制细菌的DNA旋转酶,阻断DNA的合成。
在最低抑菌浓度时,即出现溶菌现象,具有抗菌谱广、抗菌活性强、口服吸收迅速、血药浓度高而持久、渗透性强、体内分布广、与抗生素无交叉耐药性等特点,可广泛应用于细菌性疾病和支原体感染的治疗。
对气单胞菌、假单胞菌、弧菌、屈挠杆菌、链球菌、爱德华菌等大多数鱼类病原菌均具有良好的抗菌活性。
主要用于治疗鱼类细菌出血性性败血症、烂鳃病、赤皮病、肠炎病、白头白嘴病、打印病、表皮溃烂病、赤鳍病、弧菌病等细菌性疾病。
5 使用原则5.1 经临床和实验室确诊后,允许在技术人员指导下或按照产品使用说明书,使用本药物对相应疾病进行及时治疗。
5.2 所用药物必须来自具有《兽药生产许可证》和产品批准文号的生产企业,或者具有《进口兽药许可证》的供应商。
所用兽药的标签应符合《兽药管理条例》的规定。
5.3 药物的使用应遵循《饲料药物添加剂使用规范》、NY5071-2002 《无公害食品渔用药物使用准则》规定。
原料药不得直接加入饲料中使用,必须制成预混剂后方可添加到饲料中。

氧氟沙星注射液质量标准氧氟沙星注射液是一种广泛应用于临床的抗菌药物,具有广谱、强效、耐受性好等特点。
为了确保氧氟沙星注射液的质量安全,保障患者用药的有效性和安全性,制定了相应的质量标准。
一、外观和性状。
氧氟沙星注射液应为无色或微黄色透明液体,无异物悬浮物和沉淀物,有特有的氟味。
在光线下应无色淡黄色沉淀。
二、主要成分。
氧氟沙星注射液的主要成分是氧氟沙星,其化学名称为(6S)-6-氟-1-[(2S)-2-环丙基]-7-(3-氨基-1-环丙基)-1,4-二氢喹啉-4-酮。
每支注射液含有氧氟沙星200mg。
三、规格。
氧氟沙星注射液的规格为每支2ml,每盒10支。
四、质量控制。
1. 氧氟沙星注射液的生产应符合《药品生产质量管理规范》中有关注射剂的相关要求。
2. 原料药应符合国家药典规定的质量标准,严格把关原料药的采购和质量控制。
3. 生产过程中应严格按照标准操作规程进行,确保生产过程的严谨和规范。
4. 对成品进行严格的质量检验,确保每批产品符合国家药典规定的质量标准。
五、贮存。
氧氟沙星注射液应存放在阴凉干燥处,避免阳光直射。
贮存期内,应避免冻结和高温,保持温度在15-25摄氏度之间。
六、包装。
氧氟沙星注射液应采用无菌玻璃制品包装,每支注射液应独立包装,包装完好,无破损。
七、使用。
使用氧氟沙星注射液前应先检查包装是否完好,观察外观和性状是否符合要求。
使用时应严格按照医嘱用药,避免过量使用或长期使用。
八、注意事项。
1. 使用氧氟沙星注射液时,应注意过敏史和禁忌症,避免不必要的风险。
2. 使用过程中如出现不良反应,应及时就医并停止使用氧氟沙星注射液。
总结,氧氟沙星注射液作为一种重要的抗菌药物,在临床应用中具有重要意义。
为了确保其质量安全和有效性,制定了相应的质量标准,包括外观和性状、主要成分、规格、质量控制、贮存、包装、使用和注意事项等方面。
只有严格按照这些标准要求进行生产、贮存和使用,才能保证患者用药的安全有效。

氧氟沙星OfloxacinC18H20FN3O4 361.38(±)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-哌嗪)-7-氧-7H-吡哆[1,2,3- 去]-1,4-苯并恶嗪-6-羧酸 [82419-36-1]氧氟沙星按干燥品计算,C18H20FN3O4含量应为98.5% ~101.5%。
包装与贮藏:密封避光25℃保存;允许温度偏差15℃~30℃。
美国药典参比标准品<11>_——USP氧氟沙星参比标准品。
USP氧氟沙星有关物质A参比标准品鉴别——A: 红外吸收 <197K>。
B:紫外吸收 <197U> -溶液:6.7µg /mL。
介质:0.1N盐酸。
比旋度<781S>:+1°至 -1°之间。
供试溶液:10 mg/ mL,氯仿溶液。
干燥失重<731> ——在105°下干燥4小时:减失的重量不大于0.2%。
炽灼残渣<281> :不得超过0.1%。
砷,方法Ⅱ <211> :1 µg/g。
重金属,方法Ⅱ <231>: 0.001%。
色谱纯度——稀释液—水和乙腈(6:1)的混合液流动相——将4.0g醋酸铵和7.0g高氯酸钠溶解于1300ml水中,用磷酸调节pH值至2.2,混合均匀。
准备过滤,脱气过的此混合液和240ml乙腈。
可根据需要调整(见色谱<621> 中系统适应性)。
系统适应性标准溶液——取10.0mg USP氧氟沙星有关物质A参比标准品和10.0mg USP氧氟沙星对照品到100ml容量瓶, 稀释液溶解稀释,用稀释液稀释10.0ml此溶液到50.0ml,用稀释液稀释1.0ml此溶液到50.0ml。
标准溶液——精确称量USP氧氟沙星对照品,溶解于稀释液中,配制成约0.0004 mg/ ml的溶液。
供试溶液——精确称量本品,溶解于稀释液中,配制成约0.2 mg/ ml的溶液。
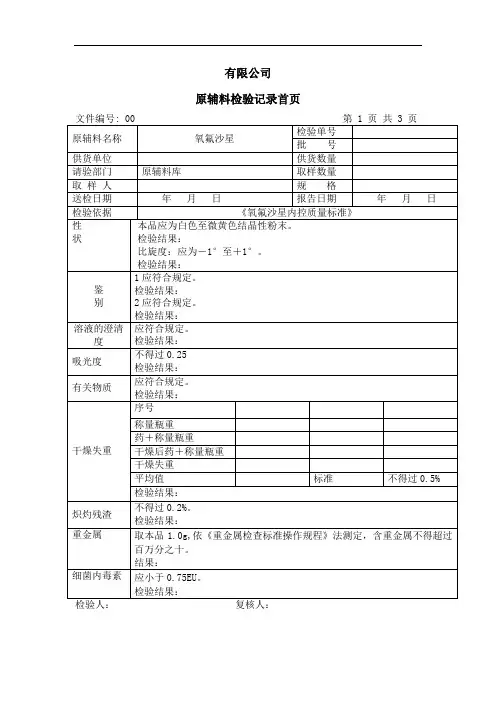
甲磺酸左氧氟沙星质量标准甲磺酸左氧氟沙星是一种广谱抗生素,常用于治疗感染疾病。
为了确保药物质量的稳定和安全性,制定和遵守质量标准是至关重要的。
本文将介绍甲磺酸左氧氟沙星的质量标准,并阐述其相关要求。
1. 总述甲磺酸左氧氟沙星的质量标准是根据国家法规和药品标准制定的。
质量标准规定了药物的理化性质、纯度、微生物限度、残留溶剂、重金属含量等指标,以确保药物的质量稳定和安全性。
2. 外观性状甲磺酸左氧氟沙星应当为白色或类白色结晶性粉末,无异味。
在质量标准中规定了药物外观的要求,例如颜色、形状、气味等,以保证其可辨识性和一致性。
3. 理化性质甲磺酸左氧氟沙星的质量标准对其理化性质进行了详细规定。
其中包括药物的溶解性、比旋光度、熔点、红外光谱等指标。
这些性质的测定有助于确保药物的纯度和稳定性。
4. 纯度甲磺酸左氧氟沙星的质量标准要求药物纯度达到一定的要求。
常规的纯度检测方法包括高效液相色谱法、气相色谱法和红外光谱法等。
这些方法可以检测杂质的存在和含量,确保药物的纯度满足相关要求。
5. 微生物限度药物的微生物限度是衡量其是否符合规定标准的重要指标之一。
甲磺酸左氧氟沙星的质量标准规定了其细菌总数、大肠杆菌、黄金色葡萄球菌等微生物的限度要求。
这些限度值的设定有助于确保药物在使用过程中不引起细菌感染。
6. 残留溶剂甲磺酸左氧氟沙星的质量标准还规定了药物中残留有机溶剂的限度。
相关的溶剂包括甲苯、二氯甲烷、乙醇等。
质量标准对这些溶剂的含量做出了严格的规定,以确保药物的安全性和无毒性。
7. 重金属含量质量标准还要求测定药物中重金属的含量,如铅、砷、汞等。
重金属是一类有毒物质,其超标可能对人体健康造成严重危害。
因此,质量标准针对这些重金属设定了限度值,以确保药物的安全性。
8. 不合格品处理质量标准中也规定了对不合规药物的处理办法。
如果甲磺酸左氧氟沙星的理化性质、纯度、微生物限度等指标超出质量标准规定的范围,该批次药物视为不合格品,需要根据相关法规和标准进行处理,以保障患者用药安全。
左氧氟沙星标准用法左氧氟沙星是一种广谱抗菌药物,常用于治疗各种感染性疾病。
在使用左氧氟沙星时,必须严格按照标准用法使用,以确保药物的疗效和安全性。
下面将介绍左氧氟沙星的标准用法,希望能对大家有所帮助。
首先,左氧氟沙星的用法包括药物剂量、给药途径和给药频率。
一般情况下,成人每次口服左氧氟沙星的剂量为200-400毫克,每日2次。
对于严重感染或特殊情况,剂量可适当增加,但需在医生指导下使用。
儿童的用药剂量通常根据体重进行计算,具体剂量需遵医嘱。
左氧氟沙星可口服或静脉注射,但一般情况下口服即可满足治疗需要。
在给药期间,需保持药物血浆浓度稳定,因此需严格按照医嘱的给药频率进行用药。
其次,左氧氟沙星的用药时机也是非常重要的。
一般情况下,左氧氟沙星应在饭前或饭后2小时内进行口服,以避免食物对药物的吸收产生影响。
如果因特殊原因需要空腹服药,应在医生的指导下进行。
同时,左氧氟沙星的用药时机还需避免与其他药物同时使用,以免影响药物的吸收和代谢。
此外,左氧氟沙星的疗程也需要严格控制。
一般情况下,左氧氟沙星的疗程为5-14天,具体疗程需根据患者的病情和医生的建议确定。
在用药期间,患者需按时按量完成用药,不得随意中止或延长疗程,以免影响疗效和导致药物耐药。
最后,左氧氟沙星的用药注意事项也需引起重视。
在使用左氧氟沙星的过程中,患者需密切关注自身的身体反应,如出现过敏反应、消化道不适等症状,应及时就医。
同时,患者需避免饮酒、吸烟和进食刺激性食物,以免影响药物的疗效和安全性。
综上所述,左氧氟沙星是一种重要的抗菌药物,正确的使用方法对于治疗感染性疾病至关重要。
在使用左氧氟沙星时,患者需严格按照医生的建议进行用药,不得擅自更改剂量、给药频率和疗程。
希望大家能够重视左氧氟沙星的标准用法,确保药物的疗效和安全性。
蜂蜜氧氟沙星判定标准
根据国家药品监督管理局发布的《药品临床研究质量管理规范》,蜂蜜氧氟沙星(Honey floxacin)是一种广谱抗生素,用于治疗感染疾病。
以下是对蜂蜜氧氟沙星判定的一般标准:
1. 经过正规临床试验,蜂蜜氧氟沙星应具有较好的疗效和安全性。
2. 符合相关药物质量标准,如外观、溶解度、含量和微生物限度等要求。
3. 在临床试验中,蜂蜜氧氟沙星的疗效应显著优于安慰剂或其他对照药物。
4. 蜂蜜氧氟沙星的不良反应应在可接受的范围内,比如胃肠道症状、皮疹、过敏等。
5. 药物的用法、用量和疗程等应按照药品说明书和临床实践指南进行合理应用。
6. 基于严格的药品安全监管和药物不良反应监测系统,对蜂蜜氧氟沙星应进行长期的监测和评估,及时发现和解决相关的安全问题。
需要注意的是,以上仅为一般的判定标准,具体的判定还需要参考相关药品监管部门的规定和指南。
在使用蜂蜜氧氟沙星或其他药物之前,建议咨询医师或药师的指导。
鱼肉中氧氟沙星、培氟沙星和洛美沙星检测国标鱼肉作为一种美味佳肴,在我们的餐桌上备受欢迎。
然而,近年来鱼肉中的药物残留问题越来越受到人们的关注。
其中,氧氟沙星、培氟沙星和洛美沙星这三种抗生素已成为我们检测的重点。
为了确保我们食用的鱼肉安全无虞,国家制定了相关的检测标准。
氧氟沙星是一种广谱的抗生素,常用于治疗各种细菌感染。
然而,若久期滥用会导致抗生素的残留,进而对人体健康造成潜在威胁。
国标对鱼肉中的氧氟沙星残留限量为不超过0.01毫克/千克。
这个标准的制定充分考虑了人体对氧氟沙星的摄入限制,确保了鱼肉在食用过程中的安全性。
培氟沙星是一种广谱喹诺酮类抗生素,常用于预防和治疗鱼类感染疾病。
然而,若滥用或超量使用,会导致培氟沙星在鱼肉中的残留,从而对人体健康造成危害。
根据国标规定,鱼肉中的培氟沙星残留限量为不超过0.01毫克/千克。
这个标准的制定严格把控了培氟沙星的使用量,从而保障了鱼肉产品的质量和食用的安全性。
洛美沙星是一种广谱的喹诺酮类抗生素,常被用于鱼类病害的治疗。
不同于人用药的洛美沙星,兽用药残留在鱼肉中却存在食品安全风险。
根据国标规定,鱼肉中的洛美沙星残留限量为不超过0.01毫克/千克,以确保鱼肉在食用过程中不会对人体健康造成潜在风险。
这些国标的制定不仅是为了维护我们食品安全的大门,也是为了加强对饲料和兽药的合理使用。
同时,也提醒了从事养殖和捕捞业的生产者,合理选择、使用抗生素,并监测抗生素的残留情况。
只有这样,我们才能够放心品尝鱼肉的美味,享受健康生活。
总之,鱼肉中氧氟沙星、培氟沙星和洛美沙星的残留是食品安全的重要问题。
国标的制定为我们提供了一个保护自身健康的安全屏障。
生产者应该合理使用抗生素,确保养殖和捕捞过程符合国标的规定。
而我们作为消费者,也应该关注鱼肉的安全问题,选择合格的产品,让我们的餐桌更加美味和健康。
GMP管理文件一.目的:为规定氧氟沙星的检查方法和操作要求,特制定此标准。
二.适用范围:适用于本公司氧氟沙星的质量检测。
三.责任者:检验员四.正文【检品名称】氧氟沙星【引用标准】氧氟沙星内控质量标准【使用仪器】电位滴定仪高效液相色谱仪【操作内容】【性状】本品为白色至微黄色结晶性粉末;无臭、味苦;遇光渐变色。
本品在三氯甲烷中略溶,在甲醇中微溶,在冰醋酸中易溶,在稀盐酸或0.1mol/L氢氧化钠溶液中略溶。
比旋度取本品,精密称定,加三氯甲烷溶解并定量制成每1ml含10mg的溶液,依法测定,比旋度应为-1°至+1°。
【鉴别】(1)取本品适量,加0.1mol/L盐酸溶液制成每1ml中约含0.12mg的溶液,作为供试品溶液。
照有关物质项下的色谱条件,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱一致。
【检查】溶液的澄清度取本品5份,各0.5g,加氢氧化钠试液10ml溶解后,溶液应澄清;如显浑浊,与2号浊度标准液比较,均不得更深。
吸光度取本品0.1g,加氢氧化钠试液10ml溶解后,照紫外-可见分光光度法,在450nm的波长处测定吸光度,不得过0.25。
有关物质取本品适量,精密称定,加0.1mol/L盐酸溶液溶解并制成每1ml中含1.2mg的溶液,作为供试品溶液;精密量取适量,加0.1mol/L盐酸溶液稀释制成每1ml中含2.4ug的溶液,作为对照品溶液,照高效液相色谱法测定,用十八烷基硅烷键合硅胶为填充剂;以醋酸铵高氯酸钠溶液-乙腈(85:15)为流动相,检测波长为294nm。
取氧氟沙星适量,用0.1mol/L 盐酸溶液溶解并稀释制成,每1ml中约含1mg的溶液,置紫外光灯下照射4小时以上,取10ul注入液相色谱仪,理论板数按氧氟沙星峰计算不低于5000,紧邻氧氟沙星峰前的杂质峰与氧氟沙星的分离度应符合要求,取对照溶液10ul注入液相色谱仪,调节测试灵敏度,使主成分色谱峰的峰高为满量程的20%~25%,精密量取供试品溶液与对照品溶液个10ul,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2.5倍。
一、目的:制定氧氟沙星原料企业内控质量标准,确保氧氟沙星原料完全符合质量要求。
二、适用范围:适用于氧氟沙星原料的质量检验。
三、责任者:质管部、质检中心、质检员。
四、正文:
氧氟沙星
Yangfushaxing
Ofloxacin
本品为(±)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧代
-7H-吡啶并[1,2,3-de]-1,4-苯并噁嗪-6-羧酸。
按干燥品计算,含C
18H
20
FN
3
O
4
不
得少于97.5%。
【性状】本品为白色或微黄色结晶性粉末;无臭、味苦;遇光渐变色。
本品在三氯甲烷中略溶,在水或甲醇中微溶或极微溶解;在冰醋酸或氢氧化钠试液中易溶,在0.1mol/L 盐酸溶液中溶解。
比旋度取本品,精密称定,加三氯甲烷溶解并定量稀释制成每1ml中约含10mg 的溶液,依法测定(附录Ⅵ E),比旋度为-1°至+1°。
【鉴别】(1)取本品与氧氟沙星对照品适量,加0.1mol/L盐酸溶液适量,(每5mg氧氟沙星加0.1mol/L盐酸溶液1ml)使溶解,用乙醇稀释制成每1ml 中约含1mg的溶液,作为供试品溶液与对照品溶液;取氧氟沙星对照品与环丙沙星对照品适量,加0.1mol/L盐酸溶液适量(每5mg氧氟沙星加0.1mol/L盐酸溶液1ml)使溶解,用乙醇稀释制成每1ml中约含氧氟沙星1mg与环丙沙星1mg 的溶液,作为系统适用性试验溶液,照薄层色谱法(附录VB)试验,吸取上述三种溶液各2µl,分别点于同一硅胶GF
254
薄层板上,以乙酸乙酯-甲醇-浓氨溶液(5:6:2)为展开剂,展开,取出,晾干,置紫外光灯(254nm或365nm)下检视。
系统适用性试验溶液应显两个完全分离的斑点。
供试品溶液所显主斑点的位置和颜色应与对照品溶液主斑点的位置和颜色相同。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集1003图)一致。
以上(1)、(2)两项可选做一项。
【检查】溶液的澄清度取本品5份,各0.5g,分别用氢氧化钠试液10ml 溶解后,溶液应澄清;如显浑浊,与2号浊度标准液(附录Ⅸ B)比较,均不得更浓。
吸光度取本品0.1g,精密称定,精密加氢氧化钠试液10ml溶解后,照紫外-可见分光光度法 (附录Ⅳ A),在450nm的波长处测定吸收度,不得过0.25。
有关物质取本品适量,精密称定,加0.1mol/L盐酸溶液溶解并定量稀释制成每1ml 中约含1.2mg的溶液,作为供试品溶液,精密量取适量,用0.1mol/L 盐酸溶液定量稀释制成每1ml中含2.4μg的溶液,作为对照溶液。
另精密称取杂质A对照品约18mg,置100ml量瓶中,加6mol/L氨溶液1ml与水适量使溶解,用水稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,用水稀释至刻度,摇匀,作为杂质A对照品溶液。
照高效液相色谱法(附录Ⅴ D) 测定,用十八烷基硅烷键合硅胶为填充剂;以醋酸铵高氯酸钠溶液(取醋酸铵 4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节PH值至2.2)-乙腈(85: 15)为流动相A, 乙腈为流动相B;按下表进行线性梯度洗脱。
柱温为40℃;流速为每分钟1nm,称取氧氟沙星对照品、环丙沙星对照品和杂质E对照品各适量,加0.1mol/L 盐酸溶液溶解并稀释制成每1ml中约含氧氟沙星1.2mg、环丙沙星和杂质E各6μg的混合溶液,取10µl注入液相色谱仪,以294nm为检测波长,记录色谱图,氧氟沙星峰的保留时间约为15分钟,氧氟沙星峰与杂质E峰和氧氟沙星峰与环丙沙星峰的分离度应分别大于2.0与2.5.取对照溶液10µl注入液相色谱仪,以294nm为检测波长,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%。
精密量取供试品液、对照溶液和杂质A对照品溶液各10µl,分别注入液相色谱仪,以294nm和238nm为检测波长,记录色谱图。
供试品溶液色谱图中如有杂质峰,杂质A(238nm检测)按外标法以峰面积计算,不得过0.3%,其他单个杂质(294nm检测)峰面积不得大于对照溶液主峰面积(0.2%),其他各杂质峰面积的和(294nm检测)不得大于对照溶液主峰面积的2.5倍(0.5%)。
供试品溶液色谱图中任何小于对照溶液主峰面积0.1倍的峰可忽略不计。
时间(分钟)流动相A(%)流动相B(%)
0 100 0
18 100 0
25 70 30
39 70 30
40 100 0
50 100 0
干燥失重取本品,在105℃干燥至恒重,减失重量不得过0.5%(附录Ⅷ L)。
炽灼残渣取本品1.0g,置铂坩埚中,依法检查(附录ⅧN),遗留残渣不得过0.2%。
重金属取炽灼残渣项下遗留的残渣,依法检查(附录Ⅷ H 第二法),含重金属不得过
百万分之十。
细菌内毒素取本品,依法检查(附录Ⅺ E),每1mg氧氟沙星中含内毒素的量应小于0.75EU(供注射用)。
【含量测定】照高效液相色谱法(附录V D)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH值至2.2)-乙腈(85:15)为流动相:检测波长为294nm。
称取氧氟沙星对照品、环丙沙星对照品和杂质E对照品各适量,加0.1mol/L盐酸溶液溶解并稀释制成每1ml中约含氧氟沙星0.12mg,环丙沙星和杂质E各6μg的混合溶液,取10µl注入液相色谱仪,记录色谱图。
氧氟沙星峰的保留时间约为15分钟,氧氟沙星峰与杂质E峰和氧氟沙星峰与环丙沙星峰的分离度应分别大于 2.0与2.5。
测定法取本品约60mg,精密称定,置50ml量瓶中,加0.1mol/L盐酸溶液溶解并稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用0.1mol/L盐酸溶液稀释至刻度,摇匀,精密量取10µl注入液相色谱仪,记录色谱图;另取氧氟沙星对照品适量,同法测定,按外标法以峰面积计算,即得。
【类别】喹诺酮类抗菌药
【贮藏】遮光,密封保存
【制剂】(1)氧氟沙星片(2)氧氟沙星胶囊(3)氧氟沙星眼膏 (4)氧氟沙星氯化钠注射液(5)氧氟沙星滴耳液(6)氧氟沙星滴眼液
附:
杂质A:(±)9.10-二氟-3-甲基-7-氧代-2,3-二氢-7H-吡啶并[1.2.3-de]-1.4-苯并噁唑-6-羧酸
杂质E:(±)9-氟-3-甲基-7-氧代-10-(1-哌嗪基)-2,3-二氢-7H-吡啶并[1.2.3-de]-1.4-苯并噁唑-6-羧酸。