2019-2020年人教版化学选修4 第一章第二节 燃烧热 能源教案
- 格式:docx
- 大小:21.96 KB
- 文档页数:5


《燃烧热能源》教案一、教材内容分析内容:本节位于《化学反应原理》第一章第二节,本节分为两部分,第一部分简单介绍了燃烧热,其中突出了对燃烧热定义的介绍,并引导学生从诸多因素出发讨论选择燃料的标准,培养学生综合考虑问题的能力;第二部分,结合燃烧热的利用介绍了能源的开发与利用,特别是化石燃料的利弊以及能源与人类生存和发展的关系。
二、教学目标1.了解燃烧热概念,并能进行简单的计算。
2.知道化学反应中能量转化的原因,能说出常见的能量转化形式。
3.通过查阅资料说明能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。
知道节约能源、提高能量利用效率的实际意义。
三、教学重难点燃烧热概念及相关计算四、教学过程(一)预习检查,检查学生的预习情况,统计学生对该知识点的了解情况,然后进行教学过程。
(若有预习检测,就利用其来检验学生的预习情况,根据学生的情况来进行上课精讲部分的调整。
)(二)情景导入,展示目标列举一部分燃烧反应,要求学生观察其热化学方程式是否正确,然后从中提出燃烧热的概念。
(复习上节课学习的热化学方程式的书写,并引入本节课的重难点——燃烧热)[板书] 第二节燃烧热能源一、燃烧热1.定义:在 25 ℃、101 kPa时,lmol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
[问题] 解释H2的燃烧热为285.8 kJ / mol所表示的含义:H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8kJ/mol实验测得25ºC,101kPa时1molH2完全燃烧生成液态水放出285.8 kJ的热量。
[讨论]你是如何理解燃烧热的定义的?(5’)(1)条件:25 ℃、101 kPa(2)可燃物的用量:lmol(3)生成稳定的氧化物:如C完全燃烧应生成CO2(g), H2燃烧生成H2O(l),S生成SO2(4)单位:kJ / mol(5)书写燃烧热的热化学方程式时,以1mol可燃物为配平标准,其余可出现分数。


第二节《燃烧热能源》
一、燃烧热
1、定义:
[引入] H2(g)+½O2(g)=H2O(g) ∆H=-285.8kJ/mol
2H2(g)+O2(g)=2H2O(g) ∆H=-571.6kJ/mol
H2(g)+ ½O2(g)=H2O(l) ∆H=-241.8kJ/mol
哪一个是H2的燃烧热?
[分析](1)可燃物1mol;(2)生成稳定化合物
H2O(g)=H2O(l) ∆H=-44.01kJ/mol
C→CO→CO2
[练习] 乙炔燃烧的反应热
2、注意
(1)特殊条件下的反应热
(2)放热∆H<0
(3)以1mol可燃物为标准配平,其余可出现分数
(4)物质在O2中燃烧
3、应用
[思考](1) 参考表1-1,比较H2、CH4谁的热值高?
(2)比较CH4和C2H5OH谁更环保?
(3)为什么我国使用乙醇汽油作为汽油的代用品?
二、节能
[常识回顾] 常规能源、新能源
[目前我国能耗情况]1、炼钢能耗是国际水平1.6倍
2、纵能耗比日本高4倍,比美国高2倍,比印度高1倍
[课后习题] P9. 5
[热点话题]中国是否应该大力发展私人轿车工业还是开展公共交通建设?
[辩论] 甲方:应该大力发展汽车工业
乙方:发展公共交通建设
建议论点从环保、能源、经济入手。
三、科学视野
[科学论文] 今年8月份我国提出建设“节约型社会”的口号,请你从互联网、报章、书籍等各方面收取信息,结合本节书内容,形成论文,论
述“节约型中国”的现实意义。

第二节 燃烧热 能源[学习目标定位] 1.正确认识燃烧热的概念,学会利用燃烧热进行相关的计算。
2.知道能源是人类生存和社会发展的重要基础,知道使用化石燃料的利弊和新能源的开发。
一 燃烧热1.反应热是化学反应过程中吸收或放出的热量,常用符号ΔH 表示。
燃烧反应都是放热反应,其反应热为负值。
已知4 g 硫粉完全燃烧放出37 kJ 热量,则该反应的热化学方程式是S(s)+O2(g)===SO2(g) ΔH =-296 kJ ·mol -1。
2.1.00 L 1.00 mol ·L -1 H2SO4溶液与2.00 L 1.00 mol ·L -1 NaOH 溶液完全反应,放出114.6 kJ 热量,该反应的中和热为57.3 kJ ·mol -1,表示其中和热的化学方程式是12H2SO4(aq)+NaOH(aq)===12Na2SO4(aq)+H2O(l) ΔH =-57.3 kJ ·mol -1。
3.已知2H2(g)+O2(g)===2H2O(l) ΔH =-571.6 kJ ·mol -1,该反应中ΔH 表示的意义是燃烧2 mol H2生成液态H2O ,放出571.6 kJ 的热量。
若燃烧1 mol 氢气生成液态水时的反应热为ΔH1, 生成气态水时的反应热为ΔH2,则ΔH1和ΔH2的大小关系是ΔH1<ΔH2;ΔH1=-285.8 kJ·mol-1,表示的意义是1 mol H2完全燃烧生成稳定的液态水,放出285.8 kJ的热量。
4.燃烧热的概念及其计算(1)燃烧热的概念是25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
燃烧热的单位是kJ·mol-1。
(2)燃烧热的意义:甲烷的燃烧热为890.31 kJ·mol-1,或ΔH=-890.31 kJ·mol-1,它表示25 ℃、101 kPa时,1 mol CH4完全燃烧生成CO2和液态H2O时放出890.31 kJ的热量。

第一章化学反应与能源第二节燃烧热能源教学目标:知识与能力:1.掌握燃烧热、热中和热相关概念和计算2.掌握热化学方程式的书写3.了解能源的相关问题过程与方法:通过化学反应的实质的回顾,逐步探究引起反应热效应内在原因的方法,引起学生在学习过程中主动探索化学原理的学习方法,通过讨论、分析、对比的方法,培养学生的分析能力和主动探究能力情感态度价值观:激发学生的学习兴趣,培养学生从微观的角度理解化学反应,培养学生尊重科学、严谨求学、勤于思考的态度,树立透过现象看本质的唯物主义观点。
教学重点:燃烧热和热化学方程式的书写教学难点:燃烧热和热化学方程式的书写教学过程:复习引入第二节燃烧热能源一、燃烧热25℃、101KPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,单位KJ/mol。
(一)、反应热1、概念:在化学反应过程中放出或吸收的热量,通常叫做反应热。
反应热用符号△H表示,单位一般采用kJ/mol2、放热反应和吸热反应的比较。
(二)热化学方程式1、概念:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
2、表示意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
例如:;△H=-241.8kJ/mol表示1mol气态H2与(1/2)mol气态O2反应生成1mol水蒸气,放出241.8kJ的热量。
(三)燃烧热1、概念:在101kPa时,1mol物质燃烧生成稳定的氧化物的时所放出的热量,叫做该物质的燃烧热。
燃烧热的单位一般用kJ/mol表示。
2、注意:必须以1mol可燃物燃烧为标准;可燃物必须完全燃烧,生成稳定化合物。
例如:1mol碳燃烧生成CO时放出的热不是燃烧热,CO不稳定,可继续燃烧生成CO2。
C的燃烧热为393.5kJ/mol而不是110.5kJ/mol。
3、表示的意义:例如C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。

教学过程教师活动学生活动【讲述】在之前的课程中,我们学习了一类重要的反应热——中和热。
今天我们要学习的是另外一种值得研究的反应热——燃烧热。
【投影】问题思考:我们知道物质燃烧都会放出热量,那么是不是物质燃烧所放出的热量就叫燃烧热呢?给出三个热化学方程式,都是H2与O2化合生成水。
哪一个才是H2的燃烧热呢?请阅读课本p7燃烧热的概念,根据自己的理解划出关键词。
【板书】第一章第二节燃烧热能源一、燃烧热1.定义【投影】定义:在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
关键词:25℃、101kPa——研究的条件1mol纯物质——燃烧物的量,而且是纯物质完全燃烧——反应程度(比方说C有不完全燃烧)稳定的化合物——生成物(C元素或单质 -- CO2(g)S – SO2(g)(不是 SO3)H(元素或单质)– H2O(l))因此,刚刚给出的三个热化学方程式中只有第2个表示的是H2的燃烧热。
【投影】值得注意的三点问题:1.燃烧热的单位为kJ/mol,△H<0,但是在叙述时用正值。
2.燃烧热通常可由实验测得。
3.燃烧物的物质的量:1 mol。
【提问】燃烧热的热化学方程式如何配平?可以类比中和热听讲,理解思考,看书,划出关键词思考,第2个是【回答】以1mol可燃物质为标准配平其它反应物、生成物的化学计量数(整数或分数)。
练习1:H2的燃烧热为285.8 kJ / mol所表示的含义是什么?【再次强调】燃烧热在表述的时候为正值,不带正负号。
热量的单位用的kJ。
练习2已知:2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=一11036kJ/mol 【回答】表示在25℃、101kPa时,1molH2完全燃烧生成1molH2O(l)放出285.8kJ的热量。
【回答】△H=-5518kJ/molC8H18的燃烧热是多少?【强调】C8H18(辛烷)燃烧,有机物在热化学方程式中我们写的是分子式(今天的课后作业涉及到了),用等号不用箭头。
第一章化学反应与能量第二节燃烧热能源教学目标:1.了解燃烧热概念,并能进行简单的计算。
2.知道化学反应中能量转化的原因,能说出常见的能量转化形式。
3.通过查阅资料说明能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。
知道节约能源、提高能量利用效率的实际意义。
教学重点、难点:燃烧热概念及相关计算。
探究建议:①调查与交流:家庭使用的煤气、液化石油气、煤炉等的热能利用效率,提出提高能源利用率的合理化建议。
②查阅资料:人类社会所面临的能源危机以及未来新型能源。
③讨论:太阳能储存和利用的多种途径。
④查阅资料并交流:“化学暖炉”、“热敷袋”、的构造和发热原理。
⑤讨论:选择燃料的依据。
⑥查阅资料并交流:火箭推进剂的主要成分和燃烧热。
课时划分:一课时。
教学过程:[引言]复习热化学方程式的意义,书写热化学方程式的注意事项,引入新课。
[[板书]第二节燃烧热能源一、燃烧热[讲述]反应热种类:燃烧热、中和热、溶解热等[板书]1.定义:在 101 kPa时,lmol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
[学生讨论、归纳概念要点](1)在101 kPa时,生成稳定的氧化物。
如C完全燃烧应生成CO2(g),而生成CO(g)属于不完全燃烧。
又如H2燃烧生成液态 H2O,而不是气态水蒸气。
(2)燃烧热通常是由实验测得的。
(3)可燃物以lmol作为标准进行测量。
(4)计算燃烧热时,热化学方程式常以分数表示。
例:H2(g)十O2 (g)=H2O(l);△H=-285.8kJ/mol[板书]2.研究物质燃烧热的意义了解化学反应完成时产生热量的多少,以便更好地控制反应条件,充分利用能源。
[投影][思考与交流]应根据什么标准来选择燃料?[汇报]1、根据物质的燃烧热、燃料的储量、开采、储存的条件、价格、对生态环境的影响等综合考虑。
2、表中较理想的燃料是:氢气、甲烷、甲醇等。
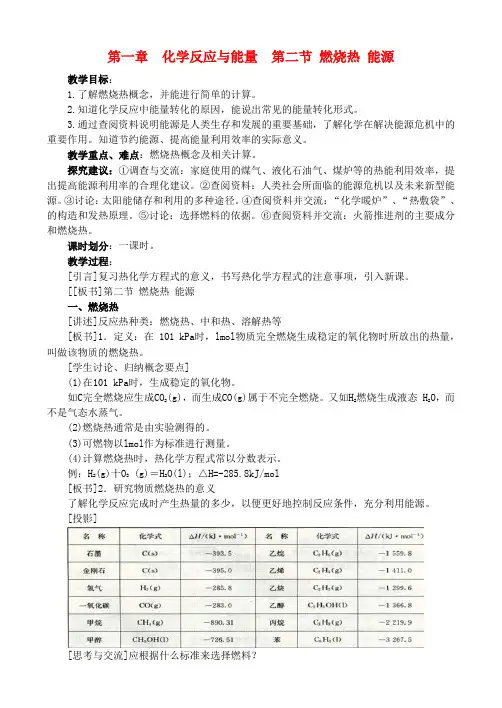
[板书]3.有关燃烧热的计算[投影]例:10 g硫磺在 O2中完全燃烧生成气态地,放出的热量能使 500 g H2O温度由18℃升至62.4℃,则硫磺的燃烧热为,热化学方程式为。

《燃烧热能源》人教版高中化学选修四化学反应原理第一章第二节《燃烧热能源》,主要讲述了两大部分的内容:第一部分是关于燃烧热的问题,主要是介绍了燃烧热的化学定义,为本章有关反应热的相关内容做准备,另外燃烧热的还是描述能源物质的重要物理量,可以为我们选择合适的能源提供有用的数据。
第二部分是关于能源,介绍了能源的主要种类如化石燃料阳光风力流水潮汐以及柴草等。
另外就我国的能源现状进行了介绍,能源利用中的相关问题,以及为了解决能源危机而采取的相关措施。
这一部分中还介绍了部分新能源,如风能太阳能氢能地热能。
【知识与能力目标】1.掌握燃烧热、热中和热相关概念和计算;2.掌握热化学方程式的书写;3.了解能源的相关问题。
【过程与方法目标】通过化学反应的实质的回顾,逐步探究引起反应热效应内在原因的方法,引起学生在学习过程中主动探索化学原理的学习方法,通过讨论、分析、对比的方法,培养学生的分析能力和主动探究能力。
【情感态度价值观目标】激发学生的学习兴趣,培养学生从微观的角度理解化学反应,培养学生尊重科学、严谨求学、勤于思考的态度,树立透过现象看本质的唯物主义观点。
【教学重点】燃烧热和热化学方程式的书写。
【教学难点】燃烧热和热化学方程式的书写。
多媒体课件。
热气球的动力就是燃烧器,没有方向舵,它的运动方向必须是随风而行。
不同高度、不同时间、不同地点,风向都是不一样的,想调整方向就需寻找不同的风层。
热气球的升和降与球体内气温有关,球体内气温高,气球浮力增大,气球就上升;球体内气温下降,球体产生的浮力小于球体自身重量和载重,气球就开始下降。
热气球燃烧器的燃料通常为石油液化气,其成分为丙烷和丁烷,已知每摩尔丙烷完全燃烧生成液态水放出2 221.5 kJ的热量,你能写出丙烷燃烧的热化学方程式吗?C3H8(g)+5O2(g) = 3CO2(g)+4H2O(l)ΔH=-2 221.5 kJ·mol-1。
预习1.燃烧热(1)定义:101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。

第二节燃烧热能源●课标要求1.通过查阅资料说明能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。
2.知道节约能源,提高能量利用率的实际意义。
●课标解读1.理解燃烧热的概念,并掌握有关燃烧热的计算。
2.了解能源的重要性及化学在解决能源危机的重要作用。
3.了解如何节约能源,并提高能源的利用率。
●教学地位本节第一部分是关于燃烧热的问题,主要是介绍了燃烧热的化学定义,为本章有关反应热的相关内容做准备,另外燃烧热还是描述能源物质的重要物理量,可以为我们选择合适的能源提供有用的数据。
第二部分是关于能源,介绍了能源的主要种类如化石燃料、阳光、风力、流水、潮汐以及柴草等。
另外就我国的能源现状进行了介绍,能源利用中的相关问题,以及为了解决能源危机而采取的相关措施。
这一部分中还介绍了部分新能源,如风能、太阳能、氢能、地热能。
●新课导入建议热气球的动力就是燃烧器,没有方向舵,它的运动方向必须是随风而行。
不同高度、不同时间、不同地点,风向都是不一样的,想调整方向就需寻找不同的风层。
热气球的升和降与球体内气温有关,球体内气温升高,气球浮力增大,气球就上升;球体内气温下降,球体产生的浮力小于球体自身重量和载重,气球就开始下降。
热气球燃烧器的燃料通常为石油液化气,其成分为丙烷和丁烷,已知每摩尔丙烷完全燃烧生成液态水放出 2 221.5 kJ的热量,你能写出丙烷燃烧的热化学方程式吗?【提示】C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2 221.5 kJ·mol-1。
●教学流程设计课前预习安排:(1)看教材P7页填写【课前自主导学】中的“知识1,燃烧热”,并完成【思考交流1】。
(2)看教材P8页填写【课前自主导学】中的“知识2,能源”,并完成【思考交流2】。
⇒步骤1:导入新课、本课时的教材地位分析。
⇒步骤2:建议对【思考交流】1、2多提问几个学生,使80%以上的学生都能掌握该内容,以利于下一步对该重点知识的探究。

燃烧热能源1.理解燃烧热的定义及燃烧热的化学方程式的书写。
2.知道能源是人类生存和社会发展的重要基础,知道使用化石燃料的利弊和新能源的开发。
1.燃烧热(1)定义:101 kPa时,1_mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
(2)单位:kJ·mol-1。
(3)表示的意义如CH4的燃烧热为890.3 kJ·mol-1含义:25_℃、101_kPa时,1_mol_CH4完全燃烧放出890.3_kJ的能量。
2.能源(1)能源就是能提供能量的自然资源,包括化石燃料(煤、石油、天然气)、阳光、风力、流水、潮汐以及柴草等。
(2)解决能源的办法是开源节流,即开发新的能源和节约现有的能源,提高能源的利用率。
(3)分析教材中资料卡片并阅读教材讨论我国能源的现状:①目前使用的主要能源是化石燃料。
②我国的人均能源拥有量:少 (填“多”或“少”)。
③近年来我国能源的利用率:低(填“高”或“低”)。
(4)现在探索开发的新能源有太阳能、氢能、风能、地热能、海洋能和生物质能等,新能源的主要优势是资源丰富,可以再生,没有污染或很少污染。
[新知探究]1.如何理解碳的燃烧热概念中”稳定氧化物”的含义?指出C、H的稳定氧化物分别是什么?提示:完全燃烧生成稳定氧化物是指单质或化合物燃烧后变为最稳定的化合物。
所谓稳定,包含两层意思:①不能再燃烧②状态稳定,如C(s)―→CO 2(g)而不是CO(g),H 2(g)―→H 2O(l)而不是H 2O(g)。
2.表示燃烧热的热化学方程式与普通的热化学方程式有何区别? 提示:表示燃烧热的热化学方程式,可燃物的物质的量必须是1 mol 。
[名师点拨]1.燃烧热的三要素燃烧热⎩⎪⎨⎪⎧条件:101 kPa标准:可燃物用量是1 mol结果⎩⎨⎧可燃物:完全燃烧生成物:稳定的氧化物⎩⎪⎨⎪⎧ C 元素→CO 2(g)H 元素→H 2O(l)S 元素→SO 2(g)2.表示燃烧热的热化学方程式的书写燃烧热是以1 mol 纯物质完全燃烧所放出的热量来定义的,因此在书写表示燃烧热的热化学方程式时,应以 1 mol 可燃物为标准来配平其余物质的化学计量数,故在表示燃烧热的热化学方程式中常出现分数。
高中化学人教版选修4第一章第2课《燃烧热能源》优质课公开课教案教师资格证面试试讲教案
1教学目标
①理解燃烧燃烧的含义
③掌握表示燃烧热的热化学方程式的写法和有关燃烧热的简单的计算
通过结我国的能源现状的认识过程,培养学生的节能意识
2学情分析
学生已经学习了反应热概念以及热化学方程式的书写。
3重点难点
教学重点:表示燃烧热的热化学方程式的写法和有关燃烧热的简单的计算
教学难点:表示燃烧热的热化学方程式的写法
4教学过程
教学活动
1【讲授】教学过程
1、燃烧热
什么是燃烧热?是不是物质燃烧放出的热量就叫燃烧热呢?
1)定义:在25℃,101 kPa时,1 mol 物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
燃烧热通常可由实验测得。
2)在理解物质燃烧热的定义时,要注意以下几点:
①研究条件: 25℃ ,101 kPa
②反应程度:完全燃烧,产物是稳定的氧化物。
③燃烧物的物质的量:1 mol
④研究内容:放出的热量。
(ΔH<0,单位kJ/mol)
⑤在未有特别说明的情况下,外界压强一般指25℃ ,101 kPa.所谓完全燃烧也是完全氧化,它是指物质中的下列元素完全转变成对应的稳定物。
如: C→CO2(g)、H → H2O(l)、S →SO2 (g)。
第二节燃烧热能源【课标要求】1、通过查阅资料说明能源是人类生存和发展的重要基础;2、了解化学在解决能源危机中的重要作用;3、知道节约能源、提高能量利用效率的实际意义。
【教学目标】1、了解燃烧热的涵义,能准确地书写出物质燃烧的热化学方程式。
2、了解有关燃烧热的计算。
3、知道中和热的概念及中和反应反应热的测定。
4、了解怎样合理利用化石燃烧及开发新能源。
【教学重点、难点】重点:燃烧热的概念,能源的概念及其范畴。
难点:燃烧热的概念【教学内容】【学生自主学习】自主学习教材P7~9,完成下列填空。
一、燃烧热1、概念:在条件下,mol 物质生成的化合物时所的热量,叫做燃烧热。
单位:。
2、对燃烧热概念的理解(1)研究条件:。
(2)燃烧物的量:1mol纯物质是指1mol纯净物(单质或化合物)。
(3)反应程度:。
如:C→,H→,S→,P→等。
(4)物质燃烧的反应都是热反应,所以△H 0。
(5)燃烧热是以1mol物质完全燃烧所放出的热量来定义的,因此在书写热化学方程式时,应以燃烧1mol物质为标准来配平其他物质的化学计量数。
二、中和热附:必修2教材P34“思考与交流”:酸与碱发生中和反应生成1mol水时所释放的热量称为中和热。
如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学讨论、交流。
1、概念:。
2、理解时应注意:(1)中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离的吸热所伴随的热效应。
(2)中和反应的实质是H+和OH-反应生成水,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
3、强酸和强碱反应的中和热的表示:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol4、中和热的测定[阅读]教材P4~6,中和反应反应热的测定。
三、能源1、定义:能源是。
2、范畴:能源包括等。
3、目前我国能源的利用情况:(1)我国目前主要使用的燃烧是,这种燃料的特点是。
2019-2020年高中化学选修4 1-2燃烧热能源教学设计(2)目前使用最多的常规能源化石燃料是不可再生能源,且利用效率较低。
新能源的开发利用是今后人类生存和社会持续发展的热点问题之一。
[活学活用]3.能源是人类生存和发展的重要支撑因素。
常规能源(煤、石油、天然气等)日益减少,促使人们去研究能源的利用率和新能源(如太阳能、氢能、核能等)的开发。
(1)我国目前最主要的能源品种是________,能源利用中存在的主要问题有____________________________________________。
(2)为减少污染,提高燃料利用率,下列措施可以达到目的的是________(填序号)。
①将城市居民燃煤改为使用气体燃料②若将原来烧天然气的灶具改烧石油液化气,应增大空气进入量或减少液化气的进入量 ③在农村大力发展沼气(3)某些科学家对以下3个化学反应很感兴趣: ①3FeCl 2+4H 2O(g)=====500 ℃Fe 3O 4+6HCl +H 2; ②2Fe 3O 4+3Cl 2+12HCl===6FeCl 3+6H 2O +O 2; ③6FeCl 3=====300 ℃6FeCl 2+3Cl 2。
科学家想利用上述反应来制取的一种很有意义的物质是________,该物质作为燃料的优点有________________、__________、____________。
答案 (1)煤 人均能源占有量小,能源利用率低,单位产值能耗高(答案合理即可) (2)①②③ (3)H 2 燃烧热值高 无污染 来源丰富当堂检测1.下列说法不正确的是( )A .化石燃料在任何条件下都能充分燃烧B .化石燃料在燃烧过程中能产生污染环境的CO 、SO 2等有害气体。
2019-2020年人教版化学选修4第一章第二节燃烧热能源教案
一学习目标:燃烧热,中和热,能源
二学习过程1、燃烧热
什么是燃烧热?是不是物质燃烧放出的热量就叫燃烧热呢?1)定义:在25℃,101 kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
燃烧热通常可由实验测得。
2)在理解物质燃烧热的定义时,要注意以下几点:
•①研究条件:25℃,101 kPa
•②反应程度:完全燃烧,产物是稳定的氧化物。
•③燃烧物的物质的量:1 mol
•④研究内容:放出的热量。
(ΔH<0,单位kJ/mol)
•⑤在未有特别说明的情况下,外界压强一般指25℃,101kPa.所谓完全燃烧也是完全氧化,它是指物质中的下列元素完全转变成对应的稳定物。
如:C→CO
2(g)、H→H
2O(l)、S→SO
2(g)
[练习1]分析以下几个热化学方程式,哪个是表示固态碳和气态氢气燃烧时的燃烧热的?为什么?
A.C(s)+O
2(g)===CO(g);ΔH=110.5 kJ/mol
B.C(s)+O
2(g)===CO
2(g);ΔH=-393.5 kJ/mol
C.2H
2(g)+O
2(g)===2H
2O(l);ΔH=-571.6 kJ/mol
D.H
2(g)+
2(g)===H
2O(g);ΔH=-241.8 kJ/mol
你能根据题中信息写出表示H
2燃烧热的热化学方程式吗?
由于计算燃烧热时,可燃物质是以1 mol作为标准来计算的,所以热化学方程式的化学计量系数常出现分数。
2、燃烧热的计算及应用[例题]1.在101 kPa时,1 mol CH
4完全燃烧生成CO
2和液态H
2O,放出890.3 kJ的热量,CH
4的燃烧热为多少?1000 L CH
4(标准状况)燃烧后所产生的热量为多少?CH
4的燃烧热为890.3kJ/mol,1000LCH
4(标准状况)完全燃烧产生的热量为3.97×104
kJ
2.葡萄糖是人体所需能量的重要来源之一。
葡萄糖燃烧的热化学方程式为:C
6H
12O
6(s)+6O
2(g)===6CO
2(g)+6H
2O(l)ΔH=-2800kJ/mol葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。
计算100 g葡萄糖在人体中完全氧化时所产生的热量。
2、中和热
1)定义:在稀溶液中,酸跟碱发生中和反应,生成1mol水时的反应热叫做中和热。
2)中和热的表示:H+
(aq)+OH-
(aq)=H
2O (l);△H=-57.3kJ/mol。
3)要点
①条件:稀溶液。
稀溶液是指溶于大量水的离子。
②反应物:(强)酸与(强)碱。
中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。
③生成1mol水,中和反应的实质是H+
和OH-
化合生成H
20,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
④放出的热量:57.3kJ/mol
例:已知H+
(aq)+OH-
(aq)=H
2O(l);△H=-57.3kJ/mol,求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反应放出____________ kJ的热量。
(2)用2molH
2SO
4配稀溶液跟足量稀NaOH反应,放出____________kJ的热量。
3燃烧热和中和热的区别与联系
4、能源1)什么是能源?能源的作用?
就是能提供能量的自然资源,包括化石燃料(煤、石油、天然气)、阳光、风力、流水、潮汐以及柴草等。
•能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平。
2)当今世界上重要的能源是什么?怎样解决能源枯竭问题?节约能源的重要措施是什么?什么是新能源?化石燃料:煤、石油、天然气解决的办法:开源节流;即开发新能源,节约现有能源,提高能源的利用率。
措施:科学地控制燃烧反应,使燃料充分燃烧,提高能源的利用率。
新能源:太阳能、氢能、风能、地热能、海洋能和生物能。
3)相关思考题∶燃料充分燃烧的条件是什么?.燃料燃烧时,若空气过量或不足,会造成什么后果?为什么固体燃料要粉碎后使用?
煤在直接燃烧时会产生SO
2、氮氧化物及烟尘等,严重影响空气质量且易导致酸雨、温室效应等,从而使环境受到严重污染,故通过清洁煤技术(如煤的液化和气化,以及实行烟气净化脱硫等),大大减少燃煤对环境造成的污染,势在必行。
提高煤燃烧的热利用率、开发新的能源也是大势所趋。