极性分子和分子的极性
- 格式:pptx
- 大小:455.35 KB
- 文档页数:23
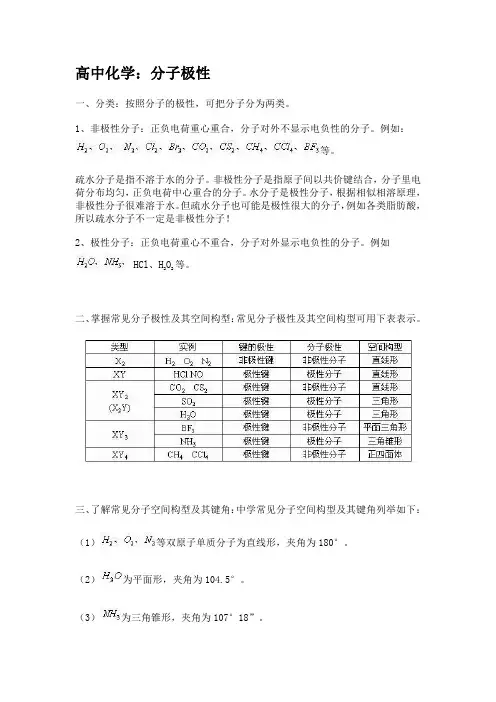
高中化学:分子极性一、分类:按照分子的极性,可把分子分为两类。
1、非极性分子:正负电荷重心重合,分子对外不显示电负性的分子。
例如:等。
疏水分子是指不溶于水的分子。
非极性分子是指原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子。
水分子是极性分子,根据相似相溶原理,非极性分子很难溶于水。
但疏水分子也可能是极性很大的分子,例如各类脂肪酸,所以疏水分子不一定是非极性分子!2、极性分子:正负电荷重心不重合,分子对外显示电负性的分子。
例如HCl、H2O2等。
二、掌握常见分子极性及其空间构型:常见分子极性及其空间构型可用下表表示。
三、了解常见分子空间构型及其键角:中学常见分子空间构型及其键角列举如下:(1)等双原子单质分子为直线形,夹角为180°。
(2)为平面形,夹角为104.5°。
(3)为三角锥形,夹角为107°18”。
(4)S为平面形,夹角为92°。
(5)为正四面体形,夹角为109°28”。
(6)为四面体形,夹角不确定。
(7)为直线形,夹角为180°。
(8)为平面形,夹角为120°。
(9)为平面形,夹角为60°。
(10)为正四面体形,夹角为109°28”。
(11)为直线形,夹角为180°。
(12)为平面形,夹角为120°。
②③④⑤注意:中学常见的四面体物质有①CH4⑥⑦⑧⑨等。
其中是正四面体的有①、⑤、⑥、⑦、⑧、⑨共6种。
四、分子极性判断规律。
①双原子单质分子都是非极性分子。
如等。
②双原子化合物分子都是极性分子。
如HCl、HBr、HI等。
③多原子分子极性要看空间构型是否对称,对称的是非极性分子,否则是极性分O、等是极性分子;子。
如H2等是非极性分子。
④形分子极性判断:若A原子的最外层电子全部参与成键,这种分子一般为非极性分子。
如等。
若A原子的最外层电子没有全部参与成键,这种分子一般为极性分子。



化学键的极性与性质极性对物质性质的影响化学键的极性是指电子在化学结合中的相对分布和性质。
化学键极性的不同会对物质的性质产生重要的影响。
本文将探讨化学键的极性与性质极性对物质性质的影响,并分析其在实际应用中的重要性。
一、化学键的极性化学键的极性是指化合物中所形成的化学键在电子分布上的不均匀性。
根据电子云的分布,化学键可以分为极性化学键和非极性化学键。
1. 极性化学键:当两个原子之间的电负性不同,即一个原子相对另一个原子具有更强的电子亲和力时,就会形成极性化学键。
在极性化学键中,电子会更倾向于围绕电负性较大的原子,导致电子云在空间上不均匀分布。
2. 非极性化学键:当两个原子之间的电负性差异较小或相等时,就会形成非极性化学键。
在非极性化学键中,电子会均匀地分布在化学键的两侧。
二、性质极性对物质性质的影响化学键极性与物质的性质密切相关。
不同的化学键极性会导致物质在化学反应和物理性质方面表现出不同的特性。
1. 溶解性:极性物质更容易溶解于极性溶剂。
这是因为在极性物质中,化学键中电子的极性会和溶剂相互作用,从而更容易被溶解。
2. 沸点和熔点:极性物质通常具有较高的沸点和熔点。
由于极性化学键中存在强烈的相互作用力,需要相对较高的能量才能打破这些化学键,因此具有较高的沸点和熔点。
3. 导电性:在溶液中,极性物质可以导电。
这是因为极性溶剂可以在溶解过程中分离极性化学键(例如离子键),导致带电离子的产生。
4. 分子极性:具有极性化学键的分子通常是极性分子。
这导致分子在电子分布上不均匀,产生极性分子间相互作用。
极性分子间的相互作用可以影响物质的热力学性质,如溶解度、沸点和熔点。
三、化学键极性的应用化学键的极性在实际应用中非常重要,特别是在化学合成、药物设计和材料科学等领域。
1. 化学合成:根据化学键的极性,可以预测化学反应的速率和方向。
极性化学键通常会促进化学反应的进行,为有机合成提供了一种重要的反应选择方法。
2. 药物设计:药物分子通常需要与目标分子发生特定的相互作用,以产生治疗效果。

浅谈共价键的极性和分子的极性判断共价键是化学中一种常见的化学键类型,常见于非金属元素之间的化合物中。
在共价键中,两个原子共享一对电子以形成化学键。
由于原子中的电子在不同程度上被吸引到原子核,因此共价键并非总是非极性的。
有些共价键是非极性的,有些是极性的。
而分子的极性则与其中的原子之间的共价键的极性密切相关。
在本篇文章中,我们将就共价键的极性和分子的极性进行一番浅谈。
让我们回顾一下共价键的极性。
共价键的极性取决于相互作用的原子的电负性差异。
电负性是原子倾向于吸引共享电子对的能力,根据元素周期表的位置来确定。
通常来说,原子的电负性与位置的靠近程度成正比。
在化学键中,如果两个原子的电负性差异较小,那么它们共享的电子对就会均匀地分布在两个原子之间,形成非极性共价键。
如果两个原子的电负性差异较大,那么共享的电子对就会更多地偏向电负性较高的原子,形成极性共价键。
以氢氟化氢(HF)为例,氢原子的电负性为2.20,氟原子的电负性为3.98,二者的电负性差异较大。
在HF分子中,由氢和氟原子形成的共价键是极性的。
氢原子的电子密度会更多地偏向氟原子,形成部分正电荷和部分负电荷,从而使得整个分子具有极性。
极性共价键的极性程度还可以通过测量分子中键的偶极矩大小来了解。
偶极矩是用来描述分子极性程度的物理量,它是由分子中所有极性共价键的偶极矩矢量之和得到的。
偶极矩的方向指向带有部分负电荷的原子。
通过测量偶极矩的大小和方向,可以判断分子的极性程度。
接下来,让我们谈一谈如何通过共价键的极性来判断分子的极性。
在一个分子中,如果存在一个或多个极性共价键,那么就需要考虑这些极性共价键对整个分子的影响。
在大部分情况下,分子的极性可以从其构成的共价键的极性推断出来。
如果一个分子中所有的共价键都是非极性的,那么这个分子就是非极性的。
二氧化碳(CO2)分子中,碳和氧之间形成的是非极性共价键。
整个二氧化碳分子是非极性的。
另外一个例子是甲烷(CH4)分子,其中碳与氢之间形成的也是非极性共价键,因此整个甲烷分子也是非极性的。


浅谈共价键的极性和分子的极性判断【摘要】本文主要讨论了共价键的极性和分子的极性判断。
在介绍了共价键的概念、极性共价键的定义以及分子极性的影响因素。
在正文中,详细探讨了共价键极性的判断方法、如何判断分子的极性、共价键极性和分子的极性关系,列举了常见的极性分子和非极性分子的特点。
在结论中,强调了共价键极性和分子极性的重要性,并通过实际例子分析了极性和非极性分子的性质,提出了极性分子在化学反应和生物过程中的作用。
通过本文的探讨,读者可以更好地理解共价键的极性和分子的极性判断方法,加深对化学领域中极性和非极性分子的认识。
【关键词】共价键、极性、分子、判断方法、影响因素、关系、极性分子、非极性分子、重要性、性质、化学反应、生物过程、实际例子。
1. 引言1.1 共价键的概念共价键是指两个原子之间通过共享电子对而形成的化学键。
在形成共价键的过程中,原子之间会共享电子以使得它们的原子层电子填满,从而达到稳定状态。
共价键是一种常见的化学键类型,它通常由非金属原子之间形成。
共价键的形成是由原子之间的电负性差异所决定的。
电负性是原子吸引和保持共享电子对的能力的度量,原子的电负性差异越大,则共价键中电子对的偏移性越强,这种共价键称为极性共价键。
在极性共价键中,由于原子之间的电负性不同,电子对会倾向于偏向电负性较强的原子。
相对而言,电负性相近的原子形成的共价键则是非极性的。
共价键的概念在化学中具有重要意义,它不仅决定了分子的性质,还影响了化学反应的进行。
了解共价键的概念有助于我们更好地理解化学物质之间的相互作用,为我们进一步探讨分子极性和相关性质奠定基础。
1.2 极性共价键的定义极性共价键是指其中一个原子吸引共享电子对的能力强于另一个原子的情况下形成的共价键。
在极性共价键中,电子对会偏向性地靠近较电负的原子,导致共价键两端带有一定电荷分布不均匀的性质。
极性共价键的特点包括电负性差异较大的原子结合形成、极性键中间会存在电子云的移动、极性键两端形成部分正负电荷分布等。

极性分子非极性极性分子指的是拥有极性的分子,它们具有一个或多个不同电荷的原子组成,而非极性分子则指的是没有极性的分子,这些分子具有相同电荷的原子组成。
极性分子通常拥有不对称的结构,它们有一个或多个极性中心,各自有一个或多个不同的电荷。
这种不对称的结构使得这些分子能够以两种不同的方向被电磁场滑入一起,从而形成复杂的化学结构。
例如,水分子中有两个氧原子,其中一个原子拥有负电荷,另一个原子拥有正电荷,这被认为是极性分子的极性中心,产生了电磁相互作用,使得它们能够结合在一起。
非极性分子具有平衡的结构,它们不具有极性中心。
它们由相同电荷的原子组成,不会产生电磁力。
此外,由于它们没有电磁相互作用,因此它们也不会结合成复杂的化学结构。
例如,氢气分子是非极性分子的一个典型例子,它由两个氢原子组成,每个原子都有一个负电荷,由于它们没有极性中心,因此不存在电磁相互作用产生。
极性分子和非极性分子有着本质的区别,这些不同之处在于它们气体的极性结构以及极性中心的存在与否。
极性分子具有极性中心,而非极性分子则没有极性中心,因而它们不具有电磁相互作用。
而且,极性分子可以形成更复杂的结构,而非极性分子则不会形成复杂的结构。
极性分子和非极性分子的另一个主要区别在于它们的溶解性。
极性分子具有良好的溶解性,通常能够被水溶解,而非极性分子则很难被水溶解。
极性分子可以通过电荷的相互作用,与水分子形成可溶解的络合物,而非极性分子则无法与水分子形成可溶解的络合物,因此其被溶解的能力很低。
极性分子和非极性分子的最终结果也有很大的不同,极性分子可以与其他极性分子形成络合物,从而产生新的物质,而非极性分子则无法形成复杂的结构,所以它们也无法形成新的物质。
总之,极性分子和非极性分子都有不同的特性,这些不同的特性使得它们在化学领域有着不同的应用,这是很有意义的。
因此,在化学实验中,极性分子和非极性分子都需要特别识别,以确保实验结果的可靠性和准确性。



分子的极性及其判断是中学化学的一个难点,首先我们要了解极性分子和非极性分子都是针对共价化合物的。
对于该难点,可以从以下3点来探讨。
一. 分子的分类按照分子的极性,可把分子分为两类:1. 极性分子电荷在分子中的分布不对称。
如HF、H2O、NH3、SO2等。
2. 非极性分子电荷在分子中的分布对称。
如H2、N2 、O2、Cl2、Br2、I2、CO2、CS2、BF3、SO3、 CH4等。
二. 分子极性的判断规律1. 双原子单质分子都是非极性分子。
如H2、N2 、O2、Cl2、Br2、I2等。
2. 双原子化合物分子都是极性分子。
如HF、HI、HBr、CO、NO等。
3. 多原子分子的极性要看其空间构型是否对称,对称的是非极性分子,否则是极性分子。
如H2O、NH3、H2O2、CH3Cl、CH2Cl2、CHCl3等是极性分子;CO2、CS2、BF3、SO3、CH4等是非极性分子。
这里的对称主要看电荷分布是否对称,如水分子是V型,也符合轴对称,但是电荷分布不对称。
水分子电子构型不对称4. 判断ABn型分子的极性的一个巧妙的方法:价态电子法。
首先确定中心原子A的化合价和A原子的最外层电子数,然后根据两者是否相等进行判断。
如果A的化合价等于A原子的最外层电子数,则该分子为非极性分子;如果A的化合价不等于A原子的最外层电子数,则该分子为极性分子。
如P 的最外层有5个电子,则PCl3不是非极性分子,因为此时磷的化合价是+3与中心P最外层电子数5不相等。
根据条件PCl5是非极性分子。
5、电子对法,判断多原子分子ABn的极性,可以通过中心A原子周围有无孤电子对,没有孤电子对的是非极性分子,有孤电子对的是极性分子。
如CCl4的中心碳原子电子都与氯原子形成共价键,没有孤电子对,非极性分子。
NH3的中心电子周围4对电子,有3对与氢共用,还剩一对孤电子,故属于极性分子。
分子极性与极性分子的溶解性溶解性是指一种物质在另一种物质中溶解的能力。
其中,分子极性是影响溶解性的一个重要因素。
本文将探讨分子极性和极性分子的溶解性之间的关系,并从分子结构和相互作用力的角度进行解析。
一、分子极性的定义和性质分子的极性是指分子内部正、负电荷分布不均衡的程度。
正负电荷的差异使得分子呈现极性。
根据分子极性的强弱,分子可分为两类:极性分子和非极性分子。
极性分子:极性分子的正、负电荷分布不均衡,因此具有正负极性。
典型的极性分子包括水(H2O)、氨(NH3)和乙醇(C2H5OH)等。
这些分子通常具有一个或多个极性键(如氧氢键或氮氢键),正极和负极分别位于分子的不同位置,使得分子具有独特的化学性质。
非极性分子:非极性分子由于内部正负电荷分布均衡,因此整体呈电荷中性。
一些常见的非极性分子有二氧化碳(CO2)、氧气(O2)和甲烷(CH4)等。
这些分子通常由于键的对称性导致整体呈现非极性。
二、极性分子的溶解性极性分子与溶剂分子之间的相互作用力决定了极性分子的溶解性。
根据“相似溶剂溶解相似物质”的规律,极性溶剂通常能够溶解极性分子。
1. 极性溶剂和极性分子的溶解性当极性分子溶解在极性溶剂中时,两者之间会发生相互作用,如溶剂分子与极性分子之间的氢键或疏水作用。
这些相互作用力有助于分子间的吸引,并克服溶质分子间的相互吸引力,从而使极性分子能够均匀分散在溶剂中。
例如,水(极性溶剂)能够溶解钠氯化物(NaCl,极性离子化合物)。
在水中,氯离子和钠离子会被水分子中的氢键所吸引,并与水分子形成水合物。
这使得NaCl分子能够成功溶解在水中。
2. 极性溶剂和非极性分子的溶解性虽然非极性分子不具有极性,但它们与极性溶剂之间仍然存在一定的作用力。
这种作用力通常被称为范德华力或分子间力。
范德华力是由于电子的运动而产生的瞬时和感应的电荷分布不均引起的相互作用力。
当非极性分子溶解在极性溶剂中时,溶剂分子会通过范德华力与非极性分子发生相互作用,从而促使溶质分子均匀分散在溶剂中。
分子概述 如果分子的构型不对称,则分子为极性分子。
如:氨气分子,HCl分子等。
区分极性分子和非极性分子的方法: 非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法: 组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法: 若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、非极性分子: 同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了! 高中阶段知道以下的就够了: 极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH 非极性分子:Cl2,H2,O2,N2,CO2,CS2,BF3,P4,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5,汽油 简单判断方法 对于AnBm型 n=1 m>1 若A化合价等于主族数 则为非极性有机极性判断弱极矩μ 有机化合作大多难溶于水,易溶于汽油、苯、酒精等有机溶剂。
原因何在?中学课本、大学课本均对此进行了解释。
尽管措词不同,但中心内容不外乎是:有机化 合物一般是非极性或弱极性的,它们难溶于极性较强的水,易溶于非极性的汽油或弱极性的酒精等有机溶剂。
汽油的极性在课本中均未做详细说明,故而在教学中常 常做如下解释:所有的烷烃,由于其中的O键的极性极小,以及结构是对称的,所以其分子的偶极矩为零,它是一非极性分子。
烷烃易溶于非极性溶剂,如碳氢化合 物、四氯化碳等。
以烷烃为主要成分的汽油也就不具有极性了。
确切而言,上述说法是不够严格的。
我们知道,分子的极性(永久烷极)是由其中正、负电荷的“重心”是否重合所引起的。
根据其分子在空间是否绝对对称来判定极性,化学键极性的向量和——弱极 矩μ则是其极性大小的客观标度.分析1 常见烷烃中,CH4、C2H6分子无极性,C3H8是 折线型分子,键的极性不能相互完全抵消,其μ≠为0.084D。
分子极性判断方法分子极性是指分子中原子间的化学键的极性决定的。
极性分子是指分子中存在极性成键的化合物,分子中存在部分正电荷和负电荷的分部。
分子的极性判断方法主要有以下几种:1.电负性差异法电负性是指原子核吸引电子对的能力。
根据普尔特表,氧、氮、氟的电负性较大,而碳、氢、硫的电负性较小。
如果分子中含有不同的原子,且电负性差异较大,则该分子具有极性成键,因而是极性分子。
例如,HCl分子中氯电负性较大,与氢原子成键,所以HCl是极性分子。
2.分子几何形状法分子的几何形状可以决定分子的极性。
当分子中存在非对称的极性键时,即使分子中的原子电负性相同,也会形成极性分子。
例如,CO2分子中的碳氧键是极性键,但由于CO2呈线性分子结构,所以整个分子是非极性的。
3.分子对称性法分子的对称性也可以决定分子的极性。
当分子的几何结构呈球对称形状时,即使分子中存在极性键,整个分子仍然是非极性的。
例如,四氯化碳分子是四面体结构,由于结构的球对称性,所以整个分子是非极性的。
4.分子的电荷分布法通过计算分子中的电荷分布,可以判断分子的极性。
常用的方法有分子轨道理论和量子化学计算方法。
分子轨道理论通过计算分子中电子的轨道分布情况来确定分子的电荷分布和极性。
量子化学计算方法如密度泛函理论(DFT)等,通过计算分子的电子密度来确定分子的极性。
需要注意的是,以上方法只是判断分子极性的一些常用方法,实际情况中可能会存在复杂的分子结构,需要综合运用多种方法来判断分子的极性性质。
同时,分子的极性也会受到温度、压力和溶剂等因素的影响,所以在实验中还需要考虑这些因素对分子极性的影响。
极性分子的定义极性分子是指由多个原子组成的分子,其电荷分布不均匀,即该分子具有极性的分子。
极性分子可以进一步分为两个类:氢键极性分子和非氢键极性分子。
氢键极性分子是指由一个电子对结合在一起而形成的极性分子,因为其由一个原子拥有多余的电子,而另一个原子拥有不足的电子,导致其电荷分布不均匀,从而具有极性。
而非氢键极性分子是指原子间引力的不均衡所造成的极性分子,其原子间远力可以是氢键或分子引力,但因为各个原子电荷的分布不均衡,也就形成了极性分子。
极性分子的定义是根据其电荷的分布情况来定义的,电荷的分布越偏向某一端,则该分子就越极性化,也就是说极性分子的定义是由其电荷分布来定义的。
极性分子可以分为两类有机分子和无机分子。
有机分子指的是由碳原子、氢原子和氧原子组成的分子,有机分子的形状可以是球形、棒状或其他任何形状,只要有机分子中的电荷分布不均匀,就可以被定义为极性分子。
无机分子指的是由金属、硫、氧或氮等元素组成的分子,其电荷分布也会随着原子的分布而不均匀,从而形成极性分子。
极性分子的定义不仅受到电荷的分布的影响,还受到原子的分布的影响。
例如,在一个分子中,如果某些原子的数量较多,而另一些原子的数量较少,那么这种分子就具有极性的特性,其电荷分布也会不均匀。
此外,原子的排列方式也会影响极性分子的定义,如果某个原子排列得比较散乱,则会形成极性分子。
极性分子在日常生活中扮演着重要的角色。
例如,极性分子存在于水中,因为水分子中的氢原子和氧原子分布不均,一侧拥有多余的电子,而另一侧拥有不足的电子,使得水分子具有极性的特性,从而使其可以相互吸引。
此外,极性分子还吸引着其它非极性分子,即引力和斥力能够影响极性分子之间的互动,从而影响到有机物质的性质。
因此,极性分子的定义是由其电荷分布和原子的分布情况来定义的,而它们在日常生活中也扮演着重要的角色。
极性分子可以有效地吸引其它非极性分子,从而影响物质的性质。