非极性分子和极性分子
- 格式:ppt
- 大小:5.06 MB
- 文档页数:38

如果分子中所有的化学键都是非极性的,那么价电子就被键合原子相等地共用。
因而,在分子中电子是呈对称均匀分布的。
这种均匀分布的发生与化学键的数目和它们在空间的伸展方向无关。
具有这种特性的分子叫做非极性分子。
如H2,Cl2,N2,O2等。
像HCl和HBr这类双原子分子只有一对电子形成化学键,并且是极性键。
其电子云分布是不对称、不均衡的,被叫做极性分子。
如果分子含有多个极性键,从分子的整体来看,它可能是极性的,也可能是非极性的,这取决于分子中化学键的空间排布。
如果分子中的极性键都相同,从分子的极性的总体来说,它只取决于化学键的空间排布。
以上的看法可以从用带静电荷的棒来靠近细水流及四氯化碳流所发生的现象来证实,细的水流受到吸引而四氯化碳流不受影响。
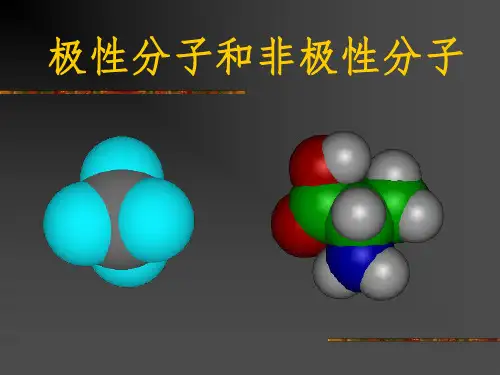
可以说明水分子是极性分子,而四氯化碳分子尽管是由4个极性键构成但因为其排布均匀,就其总体来说是非极性分子,具有类似结构的还有CH4、C2H6等。

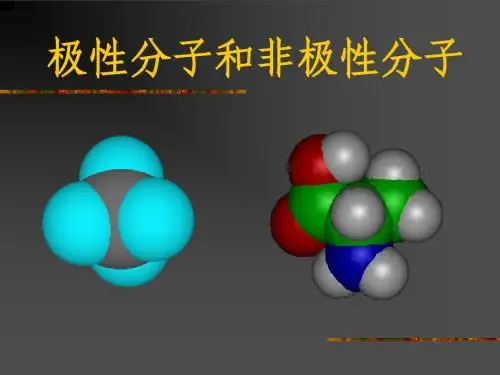



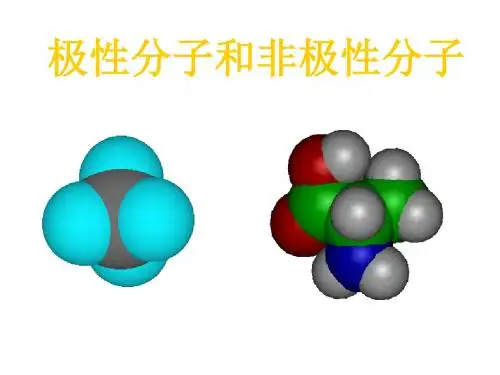



极性分子非极性极性分子指的是拥有极性的分子,它们具有一个或多个不同电荷的原子组成,而非极性分子则指的是没有极性的分子,这些分子具有相同电荷的原子组成。
极性分子通常拥有不对称的结构,它们有一个或多个极性中心,各自有一个或多个不同的电荷。
这种不对称的结构使得这些分子能够以两种不同的方向被电磁场滑入一起,从而形成复杂的化学结构。
例如,水分子中有两个氧原子,其中一个原子拥有负电荷,另一个原子拥有正电荷,这被认为是极性分子的极性中心,产生了电磁相互作用,使得它们能够结合在一起。
非极性分子具有平衡的结构,它们不具有极性中心。
它们由相同电荷的原子组成,不会产生电磁力。
此外,由于它们没有电磁相互作用,因此它们也不会结合成复杂的化学结构。
例如,氢气分子是非极性分子的一个典型例子,它由两个氢原子组成,每个原子都有一个负电荷,由于它们没有极性中心,因此不存在电磁相互作用产生。
极性分子和非极性分子有着本质的区别,这些不同之处在于它们气体的极性结构以及极性中心的存在与否。
极性分子具有极性中心,而非极性分子则没有极性中心,因而它们不具有电磁相互作用。
而且,极性分子可以形成更复杂的结构,而非极性分子则不会形成复杂的结构。
极性分子和非极性分子的另一个主要区别在于它们的溶解性。
极性分子具有良好的溶解性,通常能够被水溶解,而非极性分子则很难被水溶解。
极性分子可以通过电荷的相互作用,与水分子形成可溶解的络合物,而非极性分子则无法与水分子形成可溶解的络合物,因此其被溶解的能力很低。
极性分子和非极性分子的最终结果也有很大的不同,极性分子可以与其他极性分子形成络合物,从而产生新的物质,而非极性分子则无法形成复杂的结构,所以它们也无法形成新的物质。
总之,极性分子和非极性分子都有不同的特性,这些不同的特性使得它们在化学领域有着不同的应用,这是很有意义的。
因此,在化学实验中,极性分子和非极性分子都需要特别识别,以确保实验结果的可靠性和准确性。
极性分子与非极性分子一、极性分子与非极性分子在任何一个分子中,都可以找到一个正电荷重心和一个负电荷重心。
如果分子中正电荷重心与负电荷重心相重合,这种分子叫做非极性分子;如果分子中正电荷重心与负电荷重心不重合,则分子就因显正负两极而形成偶极,这种分子叫做极性分子。
如果正负电荷重心分离得很远,这种分子就属于离子型分子。
下图简略地表示了各种类型分子的电荷分布情况,图中“+”和“-”表示正负电荷重心的相对位置,也就是分子的极性。
二、分子极性的判断方法分子的极性由共价键的极性和分子的空间构型两方面共同决定。
⒈只含非极性键的分子:都是非极性分子。
单质分子即属此类,如:H2、O3、P4、C60……⒉以极性键结合而形成的异核双原子分子:都是极性分子。
即:A-B型分子,如HCl、CO……均为极性分子。
⒊以极性键结合而形成的多原子分子:空间构型为中心对称的分子,是非极性分子。
空间构型非中心对称的分子,是极性分子。
例析如下:电子式示意图键角空间构型分子极性CO2180°直线型非极性BF3120°平面三角型非极性CH4109°28′正四面体非极性H2O 104.5°V型极性NH3107°18′三角锥形极性⒋判断ABn型分子极性的经验规律:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。
如:分子式中心原子分子极性元素符号化合价绝对值所在主族序数CO2C 4 Ⅳ非极性BF3B 3 Ⅲ非极性CH4C 4 Ⅳ非极性H2O O 2 Ⅵ极性NH3N 3 Ⅴ极性SO2S 4 Ⅵ极性SO3S 6 Ⅵ非极性PCl3P 3 Ⅴ极性PCl5P 5 Ⅴ非极性三、常见的极性分子和非极性分子分子实例空间构型键角键对称性键的极性非极H2、O3、P4、C60非极性CO2、CS2直线型180°对称极性。
第五节非性极分子和极性分子[教学目标]1、知识目标:.使学生了解极性键和非性极键、极性分子和非性极分子的概念。
通过对简单的极性分子与非性极分子构造的分析,了解化学键的极性与分子极性的关系。
使学生初步了解分子间作用力的概念2、能力目标:培养学生分析问题和解决问题的能力。
3、情感目标:结合教学培养学生认真仔细、一丝不苟的学习精神。
[重点难点]非极性键、极性键、非极性分子、极性分子的概念键的极性、分子构造与分子极性的关系[预习思考]1、非金属元素的原子在通过共用电子对形成共价键时,原子是吸引共用电子对的能力是否一样?由此可把共价键分成哪两类?2、HCl、NH3气体易溶于水,而I2、CCl4却难溶于水的原因是什么?3、干冰气化时,二氧化碳分子内的共价键有没有被破坏?干冰气化时,克制的作用力是什么?4、分子间作用力是化学键吗?它与化学键有哪些重要区别?5、稀有气体在常温常压为什么都呈气态呢?[教学过程]一、非极性键和极性键2、规律〔1〕由形成共价键的两原子是否是同种元素的原子来判断键的极性。
由同种元素的原子间形成的共价键是;由不同种元素的原子间形成的共价键是键。
〔2〕判断极性共价键的强弱,即判断成键的两原子间共用电子对的程度大小,如:H—Cl键,H—Br键,由于原子半径ClBr,吸引共用电子对能力ClBr,所以键的极性由强到弱的顺序为H—Cl键H—Br键。
思考:〔1〕将共价键划分为非极性键、极性键的标准是什么?〔2〕非极性键是否只存在于双原子单质分子,为什么?〔3〕只存在于化合物中的化学键有哪些?〔4〕请说说非极性键、极性键、离子键间的相互关系。
二、非极性分子和极性分子1、极性分子和极性分子的比拟类型非极性分子极性分子概念键的类别判断依据实例2、规律⑴、一般说来,分子的极性是由的极性产生的。
⑵、全部以非极性键组成的分子是分子。
以极性键组成的分子,如果分子的构造能造成键的极性互相抵消的,就形成分子;如果整个分子的构造不能造成键的极性互相抵消,就形成分子。
极性和非极性怎么判断
文/董玉莹
极性分子:正电中心和负电中心不重合,键的向量和不为0。
非极性
分子:正电中心和负电中心重合,键的向量和为0。
共价键看作用力,不
同共价键看作不等的作用力,根据力的合成与分解,看中心原子受力是否
平衡,如平衡则为非极性分子;否则为极性分子。
判断方法
①双原子分子:取决于成键原子之间的共价键是否有极性。
A-B型分子(HCl):异核双原子分子都是极性分子;A-A型分子(Cl2):同核双原子分子是非极性分子
同核多原子分子也有非极性分子,如:P4,C60、S8、B12,特别注意:O3(V型)是极性分子。
②多原子分子(ABm型):取决于分子的空间构型和共价键的极性。
化合价法:当中心原子的化合价的绝对值等于该元素的价电子数时,
该分子为非极性分子;否则为极性分子。
物理模型法:共价键看作作用力,不同共价键看作不等的作用力,根
据力的合成与分解,看中心原子受力是否平衡,如平衡则为非极性分子;
否则为极性分子。
例:CO2直线型,两个C=O键对称,键极性互相抵消(F合=0),H2O
折线型,两个O-H键的极性不能抵消(F合≠0)。