极性分子和非极性分子
- 格式:ppt
- 大小:617.50 KB
- 文档页数:12



非极性分子和极性分子学习目标1.了解非极性键、极性键、非极性分子和极性分子的概念。
2.通过对简单的非极性分子、极性分子结构的分析,了解化学键的极性与分子极性的关系。
重点、难点重点:非极性分子和极性分子难点:分子结构与分子极性的关系。
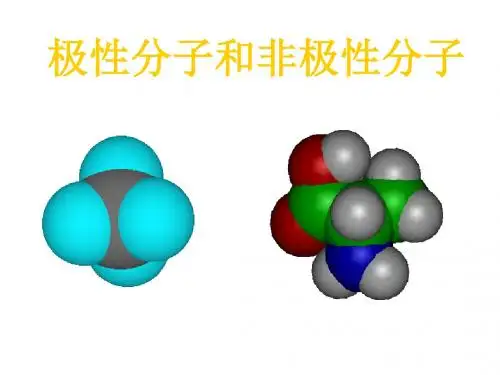
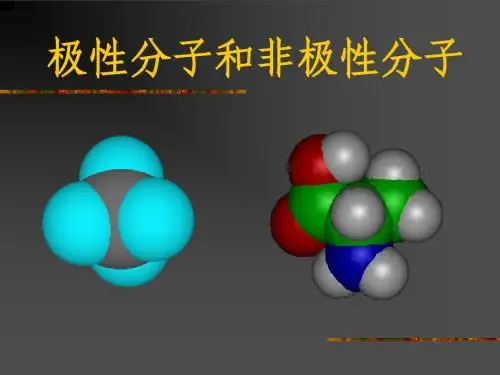
电子云分布均匀、对称,分子中正电荷中心与负电荷中心重合在一起的是非极性分子。
电子云分布不均匀、不对称,分子中正电荷中心与负电荷中心不能重合在一起的是极性分子。
前面我们已经研究过键的极性,对于双原子分子来说,键的极性与分子的极性是一致的。
如HCl分子,由于Cl的电负性比H大,它对电子的吸引能力大于H,则HCl分子中的共用电子对偏向于Cl,结果在HCl分子中Cl这一端显负电性,H这一端显正电性。
但是,并非所有只以极性键组成的分子都是极性分子。
例如,在AB2型化合物中CO2就是非极性分子,而H2O、SO3等分子就是极性分子。
这是由于尽管CO2分子中C = O键是极性键,但是CO2分子是直线型对称分布(O = C = O),两个C = O键的极性正好抵消,其正负电荷中心重合在一起,因此,CO2分子是非极性分子。
而H2O分子和SO2分子为V型结构,正负电荷中心不可能重合在一起,因此H2O分子和SO2分子为极性分子。
极性分子组成的溶剂称极性溶剂,非极性分子组成的溶剂称非极性溶剂。
在通常情况下,极性分子和离子化合物易溶于极性溶剂中,而非极性分子易溶于非极性溶剂中。
如:Br2、I2等非极性分子易溶于CCl4、苯等非极性溶剂中,HCl、HBr、NH3等极性分子易溶于极性溶剂中。
重点、难点、疑点知识1.非极性键和极性键(1) 非极性键:同种原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,电荷在两个原子核附近对称地分布,因此成键的原子都不显电性。
这样的共价键称为非极性键。
判断方法:由相同元素的原子形成的共价键是非极性键。
如单质分子(X n,n > 1,如H2、Cl2、O3、P4等)和某些共价化合物(如C2H2、C2H4、CH3CH2OH等)、某些离子化合物(如Na2O2、CaC2等)含有非极性键。



极性分子非极性极性分子指的是拥有极性的分子,它们具有一个或多个不同电荷的原子组成,而非极性分子则指的是没有极性的分子,这些分子具有相同电荷的原子组成。
极性分子通常拥有不对称的结构,它们有一个或多个极性中心,各自有一个或多个不同的电荷。
这种不对称的结构使得这些分子能够以两种不同的方向被电磁场滑入一起,从而形成复杂的化学结构。
例如,水分子中有两个氧原子,其中一个原子拥有负电荷,另一个原子拥有正电荷,这被认为是极性分子的极性中心,产生了电磁相互作用,使得它们能够结合在一起。
非极性分子具有平衡的结构,它们不具有极性中心。
它们由相同电荷的原子组成,不会产生电磁力。
此外,由于它们没有电磁相互作用,因此它们也不会结合成复杂的化学结构。
例如,氢气分子是非极性分子的一个典型例子,它由两个氢原子组成,每个原子都有一个负电荷,由于它们没有极性中心,因此不存在电磁相互作用产生。
极性分子和非极性分子有着本质的区别,这些不同之处在于它们气体的极性结构以及极性中心的存在与否。
极性分子具有极性中心,而非极性分子则没有极性中心,因而它们不具有电磁相互作用。
而且,极性分子可以形成更复杂的结构,而非极性分子则不会形成复杂的结构。
极性分子和非极性分子的另一个主要区别在于它们的溶解性。
极性分子具有良好的溶解性,通常能够被水溶解,而非极性分子则很难被水溶解。
极性分子可以通过电荷的相互作用,与水分子形成可溶解的络合物,而非极性分子则无法与水分子形成可溶解的络合物,因此其被溶解的能力很低。
极性分子和非极性分子的最终结果也有很大的不同,极性分子可以与其他极性分子形成络合物,从而产生新的物质,而非极性分子则无法形成复杂的结构,所以它们也无法形成新的物质。
总之,极性分子和非极性分子都有不同的特性,这些不同的特性使得它们在化学领域有着不同的应用,这是很有意义的。
因此,在化学实验中,极性分子和非极性分子都需要特别识别,以确保实验结果的可靠性和准确性。


极性分子与非极性分子一、极性分子与非极性分子在任何一个分子中,都可以找到一个正电荷重心和一个负电荷重心。
如果分子中正电荷重心与负电荷重心相重合,这种分子叫做非极性分子;如果分子中正电荷重心与负电荷重心不重合,则分子就因显正负两极而形成偶极,这种分子叫做极性分子。
如果正负电荷重心分离得很远,这种分子就属于离子型分子。
下图简略地表示了各种类型分子的电荷分布情况,图中“+”和“-”表示正负电荷重心的相对位置,也就是分子的极性。
二、分子极性的判断方法分子的极性由共价键的极性和分子的空间构型两方面共同决定。
⒈只含非极性键的分子:都是非极性分子。
单质分子即属此类,如:H2、O3、P4、C60……⒉以极性键结合而形成的异核双原子分子:都是极性分子。
即:A-B型分子,如HCl、CO……均为极性分子。
⒊以极性键结合而形成的多原子分子:空间构型为中心对称的分子,是非极性分子。
空间构型非中心对称的分子,是极性分子。
例析如下:电子式示意图键角空间构型分子极性CO2180°直线型非极性BF3120°平面三角型非极性CH4109°28′正四面体非极性H2O 104.5°V型极性NH3107°18′三角锥形极性⒋判断ABn型分子极性的经验规律:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。
如:分子式中心原子分子极性元素符号化合价绝对值所在主族序数CO2C 4 Ⅳ非极性BF3B 3 Ⅲ非极性CH4C 4 Ⅳ非极性H2O O 2 Ⅵ极性NH3N 3 Ⅴ极性SO2S 4 Ⅵ极性SO3S 6 Ⅵ非极性PCl3P 3 Ⅴ极性PCl5P 5 Ⅴ非极性三、常见的极性分子和非极性分子分子实例空间构型键角键对称性键的极性非极H2、O3、P4、C60非极性CO2、CS2直线型180°对称极性。
第五节非性极分子和极性分子[教学目标]1、知识目标:.使学生了解极性键和非性极键、极性分子和非性极分子的概念。
通过对简单的极性分子与非性极分子构造的分析,了解化学键的极性与分子极性的关系。
使学生初步了解分子间作用力的概念2、能力目标:培养学生分析问题和解决问题的能力。
3、情感目标:结合教学培养学生认真仔细、一丝不苟的学习精神。
[重点难点]非极性键、极性键、非极性分子、极性分子的概念键的极性、分子构造与分子极性的关系[预习思考]1、非金属元素的原子在通过共用电子对形成共价键时,原子是吸引共用电子对的能力是否一样?由此可把共价键分成哪两类?2、HCl、NH3气体易溶于水,而I2、CCl4却难溶于水的原因是什么?3、干冰气化时,二氧化碳分子内的共价键有没有被破坏?干冰气化时,克制的作用力是什么?4、分子间作用力是化学键吗?它与化学键有哪些重要区别?5、稀有气体在常温常压为什么都呈气态呢?[教学过程]一、非极性键和极性键2、规律〔1〕由形成共价键的两原子是否是同种元素的原子来判断键的极性。
由同种元素的原子间形成的共价键是;由不同种元素的原子间形成的共价键是键。
〔2〕判断极性共价键的强弱,即判断成键的两原子间共用电子对的程度大小,如:H—Cl键,H—Br键,由于原子半径ClBr,吸引共用电子对能力ClBr,所以键的极性由强到弱的顺序为H—Cl键H—Br键。
思考:〔1〕将共价键划分为非极性键、极性键的标准是什么?〔2〕非极性键是否只存在于双原子单质分子,为什么?〔3〕只存在于化合物中的化学键有哪些?〔4〕请说说非极性键、极性键、离子键间的相互关系。
二、非极性分子和极性分子1、极性分子和极性分子的比拟类型非极性分子极性分子概念键的类别判断依据实例2、规律⑴、一般说来,分子的极性是由的极性产生的。
⑵、全部以非极性键组成的分子是分子。
以极性键组成的分子,如果分子的构造能造成键的极性互相抵消的,就形成分子;如果整个分子的构造不能造成键的极性互相抵消,就形成分子。