重铬酸钾氧化-还原容量法
- 格式:ppt
- 大小:455.00 KB
- 文档页数:18

土壤有机质的测定(重铭酸钾容量法)土壤有机质既是植物矿质营养和有机营养的源泉,又是土壤中异养型微生物的能源物质,同时也是形成土壤结构的重要因素。
测定土壤有机质含量的多少,在一定程度上可说明土壤的肥沃程度。
因为土壤有机质直接影响着土壤的理化性状。
测定原理在加热的条件下,用过量的重格酸钾一硫酸(K202O7—H2SO4)溶液,来氧化土壤有机质中的碳,CnO方等被还原成Cr÷3,剩余的重格酸钾(K2Cr2O7)用硫酸亚铁(FeSO4)标准溶液滴定,根据消耗的重铭酸钾量计算出有机碳量,再乘以常数1.724,即为土壤有机质量。
其反应式为:重铭酸钾一硫酸溶液与有机质作用:2K2Cr2O7+3C+8H2SO4=2K2SO4+2Cr2(SO4)3÷3CO2t+8H2O硫酸亚铁滴定剩余重铭酸钾的反应:κ2cr207÷6Fes047H2SO4=K2SO4cr2(s04)3÷3Fe2(s04)3+7H20测定步骤:1.在分析天平上准确称取通过60目筛子(V0.25mm)的土壤样品0.1—0.5g(精确到0.0001g),用长条腊光纸把称取的样品全部倒入干的硬质试管中,用移液管缓缓准确加入0.136mol∕L重格酸钾一硫酸(K2Cr2O7-H2SO4)溶液10ml,(在加入约3ml时,摇动试管,以使土壤分散),然后在试管口加一小漏斗。
2.预先将液体石蜡油或植物油浴锅加热至185—190℃,将试管放入铁丝笼中,然后将铁丝笼放入油浴锅中加热,放入后温度应控制在170—180℃,待试管中液体沸腾发生气泡时开始计时,煮沸5分钟,取出试管,稍冷,擦净试管外部油液。
3.冷去后,将试管内容物小心仔细地全部洗入25Oml的三角瓶中,使瓶内总体积在60—70ml,保持其中硫酸浓度为1一L5mol∕l,此时溶液的颜色应为橙黄色或淡黄色。
然后加邻啡罗啾指示剂3—4滴,用0.2mol∕l的标准硫酸亚铁(FeSO4)溶液滴定,溶液由黄色经过绿色、淡绿色突变为棕红色即为终点。

土壤有机质的测定重铬酸钾容量法1. 前言嘿,大家好!今天咱们聊聊一个很有意思的话题——土壤有机质的测定,尤其是重铬酸钾容量法。
听起来复杂对吧?其实这背后有不少小故事,跟着我一块儿走一趟土壤的世界吧!说到土壤,有机质可谓是它的“灵魂”,好比咱们的心脏,没了它,土壤就像一块死气沉沉的石头。
那我们要怎么知道土壤里有多少有机质呢?这就得靠重铬酸钾容量法来帮忙了。
2. 什么是重铬酸钾容量法2.1 原理大揭秘重铬酸钾容量法,听名字就有点高大上,但其实它的原理简单得很。
咱们把土壤样本和重铬酸钾溶液混在一起,这个溶液能把有机质氧化,反正就像化学反应的魔法一样。
然后,咱们再加点还原剂,看看反应完后剩下多少重铬酸钾,借此计算出土壤中的有机质含量。
就像是给土壤做个体检,一查便知它的“健康状况”。
2.2 测定步骤说到步骤,咱们也来个简单明了的流程吧。
首先,取一小撮土壤样本,尽量不要弄得像捡到的干花一样,尽量新鲜。
然后,把它放到一个小烧杯里,加入预先配置好的重铬酸钾溶液。
这一步就像是在给土壤“下药”,有点小刺激哦!接下来,咱们要把它放到水浴中加热,水温就像是煮汤的火候,别太猛,也别太弱。
然后,等个十几分钟后,再加入还原剂,看看反应的结果。
这就像是在看一场小戏,最终的结果会让你有惊喜!3. 注意事项3.1 实验中的小细节实验中可得注意几件事,别小看这些细节,往往能决定成败。
比如说,重铬酸钾可不是好惹的,它可有腐蚀性,实验时要小心谨慎,别让它跟你的手碰个正着。
还有就是,实验室要保持通风,这样才能让气味尽量不那么刺鼻,毕竟我们可不想一边做实验一边捂着鼻子。
3.2 数据的分析最后,咱们得说说数据分析的事儿。
别看这些数字冰冷得很,其实它们背后藏着的是土壤的秘密。
当你拿到结果后,可得认真琢磨琢磨,土壤中的有机质含量高,说明土壤肥沃,是个好地方;要是含量低,那就得想想怎么改善土壤了,别让它饿着。
4. 结语好啦,今天的分享就到这里。
重铬酸钾容量法虽然听起来复杂,但其实操作起来并不难,咱们只要细心点,就能搞定。

1—3 土壤/植物有机碳的测定(重铬酸钾容量法)100目过筛1.原理:在加热的条件下,用过量的重铬酸钾—硫酸(K2Cr2O7-H2SO4)溶液,来氧化土壤有机质中的碳,Cr2O-27等被还原成Cr+3,剩余的重铬酸钾(K2Cr2O7)用硫酸亚铁(FeSO4)标准溶液滴定,根据消耗的重铬酸钾量计算出有机碳量,再乘以常数1.724,即为土壤有机质量。
其反应式为:重铬酸钾—硫酸溶液与有机质作用:2K2Cr2O7+3C+8H2SO4=2K2SO4+2Cr2(SO4)3+3CO2↑+8H2O硫酸亚铁滴定剩余重铬酸钾的反应:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O2 试剂2.1重铬酸钾标准溶液:0.8000mol/L,称取经150℃烘干2h的39.2248g重铬酸钾(K2Cr2O7),精确至0.0001g,加400mL水,加热溶解,冷却后,加水稀释至1000mL。
2.20.2mol/L FeSO4标准溶液。
准确称取分析纯硫酸亚铁(FeSO4·7H2O)56g或硫酸亚铁铵[Fe(NH4)2(SO4)2·6H2O]80g,溶解于蒸馏水中,加浓硫酸(H2SO4)5ml,然后加水稀释至1L,此溶液的标准浓度,可以用0.0167mol/L重铬酸钾(K2Cr2O7)标准溶液标定。
标定:吸取10.00mL重铬酸钾标准溶液置于250mL锥形瓶中,加入40mL水和10mL 硫酸,再加3滴~4滴邻菲啰啉指示剂,用硫酸亚铁铵标准溶液滴定至溶液由橙黄色经蓝绿色至棕红色为终点。
同时做空白试验。
硫酸亚铁铵标准溶液浓度按下式计算:式中:C——硫酸亚铁铵标准溶液浓度,mol/L;C1——重铬酸钾标准溶液浓度,mol/L;V1——重铬酸钾标准溶液体积,mL;V2——硫酸亚铁铵标准溶液用量,mL;V0——空白试验消耗硫酸亚铁铵标准溶液体积,mL。
2.3邻菲啰啉指示剂:称取 1.485g 邻菲啰啉(C12H8N2·H2O)和0.695g 硫酸亚铁(FeSO4·7H2O),溶于100mL水中,形成的红棕色络合物贮于棕色瓶中。

简述重铬酸钾容量法——外加热法的方法原理重铬酸钾容量法又称外加热法,是一种用于测量有机物质和有机溶剂总容量的容量分析方法,它十分有效,可以快速准确地测定产品的容量,其基本原理是将铬酸钾溶液加热至一定温度,然后将样品中的有机物放入溶液中,把铬酸钾和有机物之间的氧化还原反应中有机物转化成无机盐,从而使铬酸钾溶液中的铬离子浓度减少,溶液的铬离子浓度越低,其电导度就越大,依据电导度和标准曲线关系,就可以测定一定体积的溶液中的总有机物的含量。
外加热法的基本原理是利用有机物和铬酸钾之间的氧化还原反应,在规定的温度范围内,有机物会转化为无机盐,并且把铬酸钾溶液中的铬离子浓度降低。
为了让这种反应足够快,必须将温度控制在一定的范围内,控制温度的关键在于铬酸钾溶液中的铬离子浓度和温度之间的变化,例如,在采用标准容量方法测量有机物时,可以用热溶液将温度提高一定的值,这样,可以使铬酸钾溶液中的铬离子浓度减少,从而加速有机物和铬酸钾之间的氧化还原反应,从而更快地测出有机物的容量。
外加热法的优点在于它的测定范围很大,它通常用来测定容积浓度从很低到很高的样品,而且它能够测定非常稀释的溶液,而且由于这种方法最大的特点是铬酸钾测定容量迅速,所以用于定量分析有机物时,也有很大的优势。
此外,外加热法由于采用铬酸钾作为测定剂,因此也有毒性,如果在测定过程中不当使用,可能会导致污染环境。
所以这种容量分析要求环境严格控制,还要求使用恒温仪,以确保容量分析的准确度。
总的来说,外加热法的原理是利用有机物和铬酸钾之间的氧化还原反应,通过改变铬酸钾溶液的温度,使有机物转化为无机盐,测定其容积浓度。
这种容量分析方法不仅快速准确,而且可以测定很低浓度的溶液,但是也存在一定的风险。
所以在使用外加热法时,必须注意环境控制以及器材的安全性,以确保它能够准确地完成测定。

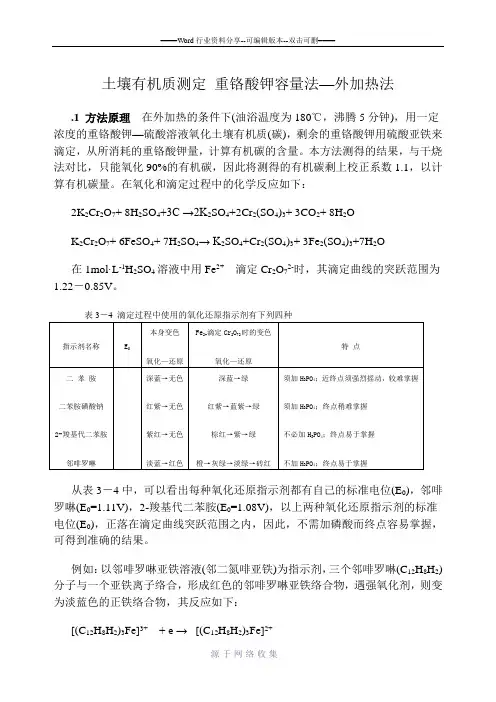
土壤有机质测定重铬酸钾容量法—外加热法.1 方法原理在外加热的条件下(油浴温度为180℃,沸腾5分钟),用一定浓度的重铬酸钾—硫酸溶液氧化土壤有机质(碳),剩余的重铬酸钾用硫酸亚铁来滴定,从所消耗的重铬酸钾量,计算有机碳的含量。
本方法测得的结果,与干烧法对比,只能氧化90%的有机碳,因此将测得的有机碳剩上校正系数1.1,以计算有机碳量。
在氧化和滴定过程中的化学反应如下:2K2Cr2O7+ 8H2SO4+3C →2K2SO4+2Cr2(SO4)3+ 3CO2+ 8H2OK2Cr2O7+ 6FeSO4+ 7H2SO4→ K2SO4+Cr2(SO4)3+ 3Fe2(SO4)3+7H2O在1mol·L-1H2SO4溶液中用Fe2+滴定Cr2O72-时,其滴定曲线的突跃范围为1.22-0.85V。
表3-4 滴定过程中使用的氧化还原指示剂有下列四种指示剂名称E0本身变色氧化—还原Fe2+滴定Cr2O72时的变色氧化—还原特点二苯胺二苯胺磺酸钠2-羧基代二苯胺邻啡罗啉深蓝→无色红紫→无色紫红→无色淡蓝→红色深蓝→绿红紫→蓝紫→绿棕红→紫→绿橙→灰绿→淡绿→砖红须加H3PO4;近终点须强烈摇动,较难掌握须加H3PO4;终点稍难掌握不必加H3PO4;终点易于掌握不加H3PO4;终点易于掌握从表3-4中,可以看出每种氧化还原指示剂都有自己的标准电位(E0),邻啡罗啉(E0=1.11V),2-羧基代二苯胺(E0=1.08V),以上两种氧化还原指示剂的标准电位(E0),正落在滴定曲线突跃范围之内,因此,不需加磷酸而终点容易掌握,可得到准确的结果。
例如:以邻啡罗啉亚铁溶液(邻二氮啡亚铁)为指示剂,三个邻啡罗啉(C12H8H2)分子与一个亚铁离子络合,形成红色的邻啡罗啉亚铁络合物,遇强氧化剂,则变为淡蓝色的正铁络合物,其反应如下:[(C12H8H2)3Fe]3++ e →[(C12H8H2)3Fe]2+淡蓝色←红色滴定开始时以重铬酸钾的橙色为主,滴定过程中渐现Cr3+的绿色,快到终点变为灰绿色,如标准亚铁溶液过量半滴,即变成砖红色,表示终点已到。

有机质重铬酸钾容量法(C)1.办法原理在加热的条件下,以过量的K2Cr2O7 H2SO4溶液氧化底质中有机碳,以FeSO4标准溶液滴定剩余的K2Cr2O7,反应式如下:2K2Cr2O7+3C+8H2SO4→2K2SO4+2Cr2(SO4)3+3CO2+8H2OK2Cr2O7+6FeSO4+7HSO4→K2SO4+2Cr2(SO4)3+3Fe2(SO4)3+7H2O 测得有机碳的含量乘上一个阅历系数1.724,即为有机质的含量。
在本办法的加热条件下,有机碳的氧化效率约为90%,故对其结果还要乘一个校正系数1.08。
2. 干扰及消退底质中含有硫化物和Fe2+等还原性物质,干扰有机质的测定,可将底质样品研细后摊成薄层,风干10d以上,使Fe2+等还原性物质充分氧化后,再举行测定。
3.仪器①玻璃试管:18mm×180mm。
②油浴锅:装甘油或石蜡作加热介质。
③铁丝笼:消解样品插玻璃试管用。
④温度计:0-300℃。
⑤全自动微量滴定管:10ml。
⑥滴定管:25ml。
4.试剂①(1/6 K2Cr2O7) =0.4mol/L的硫酸溶液:称取分析纯重铬酸钾40.00g溶于600m1水中,加水稀释至1L,置3L烧杯中。
另取分析纯浓硫酸1L,渐渐加入到重铬酸钾水溶液中,不断搅拌,冷却至室温,移入密封玻璃瓶中保存。
②(FeSO4) =0.2000mol/L标准溶液:称取FeSO4 .7H2O 56g(或(NH4)2SO4-FeSO4·H2O80g)溶于800m1水中,加浓硫酸20m1,搅拌匀称,冷至室温,稀释至1L。
此溶液易被空气氧化而使浓度降低,故用时要天天标定。
办法如下:精确移取0.2000mol/L K2Cr2O7标准溶液20.00ml,于150ml锥形瓶中;加入H2SO4 5m1,指示液2-3滴,用FeSO4溶液滴定至棕红色即为尽头,消耗FeSO4溶液V1(ml)。
CFeSO4=0.2000 ×20.0/V1 ③(1/6 K2Cr2O7) =0.200mol/L K2Cr2O7标准溶液:称取经过130℃烘2-3h的优级纯K2CrO7 9.8064g,用少量水溶解,移入1000m1容量瓶中,加水至标线,摇匀。

高温外热重铬酸钾氧化-容量法测定土壤有机质土壤有机质既是植物矿质营养和有机营养的源泉,又是土壤中异养型微生物的能源物质,同时也是形成土壤结构的重要因素。
测定土壤有机质含量的多少,在一定程度上可说明土壤的肥沃程度。
测定原理:在加热的条件下,用过量的重铬酸钾-硫酸溶液,来氧化土壤中有机质的碳,Cr2O7-2等被还原成Cr+3,剩余的重铬酸钾用硫酸亚铁标准溶液进行滴定,根据消耗的重铬酸钾量计算出有机碳量,乘以常数1.724,即为土壤有机质量。
准备工作:研磨后过100目钢筛的土壤:研磨土壤前需要把过2 mm的风干土壤样品进行进一步剔除植物根系,采用静电吸附(可以使用气球在毛绒衣物上面进行摩擦,制造静电,空气干燥时进行该工作最佳)仔细剔除细小的动植物残体,尤其是草地土壤,并且从风干土壤样品袋里面取出土壤样品前要将其再次均匀混合,确保其均匀,具有代表性。
具体步骤:称取过100目筛的风干土壤0.1 ~ 0.2 g左右(如果是泥炭土或者土壤有机质含量过高可减少土壤重量至0.1 g,实验正事开始前需要进行预实验确定合适土壤重量),精确到0.1 mg,放入干燥的平底消解管中(称量纸倒土壤到平底消解管时要快,并要轻震瓶底,确保壁上的土壤全部到达底部),然后用玻璃移液管准确加入5.00 ml重铬酸钾【105 ℃烘干后的39.2245g K2Cr2O7溶解于1L蒸馏水,c(1/6 K2Cr2O7=0.8000 mol/L】,5.00 ml的浓硫酸【H2SO4,p=1.84 g/cm3】,之后放入电解仪中,190℃持续加热16~20 min,(可以先加热一会,等温度升至190℃后开始计时,如果样品SOC含量较高需要加长消解时间或者减少土壤重量),注意每一批次加热热解时均放置2个空白(只加试剂,不加土样),然后在每个消解管上放置一个弯茎漏斗,起到冷凝作用。
消解完毕后放置于不锈钢管架上,并自然冷却至室温。
将消解后的混合液体全部转移至干净的广口三角锥形瓶中(该过程需要用装有蒸馏水的洗瓶冲洗转移,将平地瓶倾斜直接用水冲底部,可全部冲洗下来),转洗后三角瓶中的总体积在50-60 ml为宜,加2-3 滴邻菲啰啉指示剂【1.485 g邻菲啰啉(C12H8N2H2O)及0.695 g硫酸亚铁(FeSO4·7H2O)溶于100 ml水,无需烘干药品,贮存于棕色瓶中】,用硫酸亚铁溶液滴定消解反应中剩余的K2Cr2O7【硫酸亚铁溶液:56.0 g化学纯的FeSO4·7H2O(无需烘干)和15 ml浓硫酸溶于1 L蒸馏水】。

重铬酸钾容量法测定铁摘要:在盐酸溶液中,用氯化亚锡溶液将铁(Ⅲ)还原为铁(Ⅱ),然后加入氯化高汞溶液以氧化过量的氯化亚锡,用二苯胺磺酸钠为指示剂,以重铬酸钾标准溶液滴定,溶液由绿色变为蓝紫色,即为终点,以此计算样品中铁的含量关键词:氯化亚锡还原重铬酸钾氧化引言在盐酸溶液中,用氯化亚锡溶液将铁(Ⅲ)还原为铁(Ⅱ),然后加入氯化高汞溶液以氧化过量的氯化亚锡,用二苯胺磺酸钠为指示剂,以重铬酸钾标准溶液滴定。
其反应式如下:2Fe3++Sn2++6Cl-→2Fe2++SnCl62-Sn2++4Cl-+2HgCl2→SnCl62-+Hg2Cl2↓6Fe2++Cr2O72-+14H+→6Fe3++2Cr3++7H2O由于氯化亚锡能将铜(Ⅱ)还原为铜(Ⅰ),铜(Ⅰ)能被重铬酸钾氧化,同时铜离子又能促使铁(Ⅱ)被空气中的氧氧化,所以铜量高时干扰测定。
钼也能被氯化亚锡还原严重干扰测定。
钨被还原为钨蓝。
当钴、镍含量高时,由于钴、镍离子本身具有颜色,使铁(Ⅲ)还原时不易观察终点,但加入过量氨水,能使铁生成氢氧化物沉淀并与上述元素进行分离。
砷、锑均能被氯化亚锡还原,尔后又被重铬酸钾滴定,使结果偏高。
大量钒的存在能影响测定铁的准确性。
大量絮状硅酸存在,会导致结果偏低,因为铁(Ⅲ)被它们吸附和包裹,使其不易完全被氯化亚锡所还原,可用氢氟酸、硫酸处理试样。
硝酸的存在严重影响还原和滴定终点的观察,因此在分解试样后必须用硫酸将硝酸完全赶尽。
本法适用于0.5%以上铁的测定。
1 试剂配制氯化亚锡溶液:100g/L,称取10g氯化亚锡溶于10mL盐酸中,用水稀释至100mL。
氯化高汞溶液:5%,称取5g氯化高汞溶于100mL水中。
硫-磷混酸:将150mL硫酸慢慢加入500mL水中,冷却后加入150mL磷酸,用水稀释至1000mL,混匀。
重铬酸钾标准溶液:称取1.7559g预先在150℃烘干1h的重铬酸钾基准试剂于250mL烧杯中,以少量水溶解后移入1000mL容量瓶中,用水定容,摇匀。


重铬酸钾容量法测定土壤有机质阐述土壤有机质泛指土壤中来源于生命的物质,包括土壤微生物和土壤动物及其分泌物以及土壤中植物残体和植物分泌物。
土壤有机质是植物必要元素的主要来源,促进土壤的保肥能力和缓冲能力,还能络合土壤中的重金属、消去土壤中的农药残渣,所以土壤有机质的测定对环境具有重要意义。
本领域通过各方法对比研究,土壤有机质的测定中重铬酸钾容量法是最为普遍应用的方法。
现主要有油浴锅加热、电砂浴加热、烘箱加热、消化炉加热等,但这些加热法大都温度难以控制或者是对环境有污染。
本方法主要探索COD恒温加热器加热前处理土壤有机质,通过实验摸索出比较理想的控制条件。
1 原理重铬酸钾氧化——外加热法是利用外加热法,用COD恒温加热器加热条件下,加速有机质的氧化,重铬酸离子使土壤有机质中的碳氧化成二氧化碳,剩余的重铬酸钾用硫酸亚铁的标准溶液滴定,并以石英砂做试剂空白标定,根据有机碳被氧化前后重铬酸离子数量的差值,就可算出有机碳的含量,再乘以系数1.724,即为有机质的含量。
2 实验部分2.1 主要仪器与设备电子天平:感量0.0001g;调温电炉;温度计(250℃);回流装置:带圆柱形全玻璃回流装置;加热装置:JH-12型COD恒温加热器。
2.2 实验试剂2.2.1 重酸钾标准溶液[C(1/6K2Cr2O7)=0.8000mol/L]:称39.2245g重铬酸钾(K2Cr2O7,分析纯)加400mL水,加热使其溶解,冷却后用水定容至1L。
2.2.2 0.2mol/L硫酸亚铁溶液:称56.0g硫酸亚铁(FeSO4·7H2O,化学纯)或80.0g硫酸亚铁铵[Fe(NH4)2(SO4)2·6H2O,化学纯],溶解于水,加入15mL浓硫酸,用水定容至1L。
2.2.3 邻菲啰啉指示剂:1.485g邻菲啰啉(C12H8N2·H2O)及0.695g硫酸亚铁(FeSO4·7H2O)溶于100mL水,形成红棕色络合物[Fe(C12H8N2)82+],贮于棕色瓶中。
重铬酸钾容量法快速测定铁矿⽯中全铁的含量2019-04-06摘要:采⽤浓盐酸和氢氟酸分解试样,在酸性介质中,⽤氯化亚锡将⼤部分三价铁还原成⼆价铁,过量的氯化亚锡⽤⾼锰酸钾氧化,然后以钨酸钠为指⽰剂,⽤三氯化钛还原剩余的三价铁并⽣成“钨蓝”,再⽤重铬酸钾氧化⾄蓝⾊消失,加⼊硫磷混酸,以⼆苯胺磺酸钠为指⽰剂,⽤重铬酸钾标准溶液滴定⾄终点,借此测定全铁的含量。
本⽅法加快了溶解的速度,分析精确度⾼,结果满意。
关键词:容量法铁矿⽯全铁的含量近些年对铁矿⽯中全铁含量的测定普遍采⽤能够进⾏快速分析的重铬酸钾容量法。
该⽅法具有简单、快速、准确等优点,在原理上很容易理解,但是具体的操作条件却不容易掌握,在操作过程中特别容易造成操作误差。
本⽅法是在吸取原有各种⽅法的基础上对溶解试样的试剂做了⼀定改进,使试样溶解的更完全,溶解的速度更快,节省了时间和试剂,提⾼了分析的精确度。
1、实验部分1.1 试剂浓盐酸(ρ:1.19g/mL)氢氟酸(ρ:5.23g/mL)氯化亚锡溶液(10%):称取10g氯化亚锡倒⼊10mL浓盐酸中,加热溶解后,⽤蒸馏⽔稀释⾄100mL,混匀(⽤前现配)。
[1]⾼锰酸钾溶液(0.6%):称取0.6g⾼锰酸钾溶解于100mL蒸馏⽔中。
钨酸钠(25%):称取25g钨酸钠溶解于适量蒸馏⽔中,加10mL磷酸(ρ:1.70g/mL),⽤蒸馏⽔稀释⾄100mL,混匀。
三氯化钛(1+19):量取三氯化钛溶液(15%―20%)5mL,倒⼊95mL盐酸(1+18)⾥,混匀(⽤前现配)。
重铬酸钾标准溶液(0.008333mol/L):称取2.4515g预先在150℃烘⼲1h的重铬酸钾(基准试剂)溶于蒸馏⽔⾥,移⼊1000mL容量瓶中,⽤蒸馏⽔稀释⾄刻度,混匀。
硫磷混酸:将150mL浓硫酸(ρ:1.84g/mL)在搅拌下缓慢注⼊500mL蒸馏⽔中,冷却后再加⼊150mL磷酸(ρ:1.70g/mL),⽤蒸馏⽔稀释⾄1000mL,混匀。
重铬酸钾容量法稀释热法测定土壤有机质摘要:一、重铬酸钾容量法稀释热法测定土壤有机质的原理二、重铬酸钾容量法稀释热法的实验步骤三、重铬酸钾容量法稀释热法的优缺点四、重铬酸钾容量法稀释热法在土壤有机质测定中的应用正文:正文重铬酸钾容量法稀释热法是一种常用的测定土壤有机质含量的方法。
该方法基于有机质在重铬酸钾溶液中发生氧化还原反应,通过测定剩余的重铬酸钾量来计算有机质的含量。
一、重铬酸钾容量法稀释热法测定土壤有机质的原理在强酸性条件下,重铬酸钾溶液能氧化土壤中的有机质。
有机质在反应中消耗重铬酸钾,剩余的重铬酸钾用硫酸亚铁铵标准溶液滴定。
根据所消耗的重铬酸钾量,可以计算出土壤中有机质的含量。
二、重铬酸钾容量法稀释热法的实验步骤1.称取一定量的土壤样品,将其研磨过筛,得到均匀的土壤颗粒。
2.将土壤样品放入烧杯中,加入适量的水,搅拌使土壤充分吸水。
3.加入适量的重铬酸钾溶液,使土壤样品中的有机质发生氧化还原反应。
4.用硫酸亚铁铵标准溶液滴定剩余的重铬酸钾,记录所消耗的体积。
5.根据滴定数据计算土壤中有机质的含量。
三、重铬酸钾容量法稀释热法的优缺点优点:操作简便、快捷,适用于大量样品分析,是通用的常规方法。
有机质氧化程度较高,能较好地测定有机质的含量。
缺点:测定结果受土壤样品处理过程、重铬酸钾溶液浓度等因素影响较大,可能导致误差。
四、重铬酸钾容量法稀释热法在土壤有机质测定中的应用重铬酸钾容量法稀释热法在我国土壤有机质的测定中得到了广泛的应用。
由于它具有较高的准确性和可重复性,被认为是一种可靠的土壤有机质测定方法。
土壤有机质的测定重铬酸钾容量法土壤有机质是衡量土壤肥力的重要指标之一,而测定土壤有机质的方法有很多种。
其中,重铬酸钾容量法是一种常用的方法。
本文将从理论和实践两个方面对重铬酸钾容量法进行详细介绍。
一、理论基础1.1 重铬酸钾溶液的制备重铬酸钾是由重铬酸根离子和钾离子组成的盐类化合物。
在制备重铬酸钾溶液时,需要将一定量的重铬酸钾固体加入到水中,搅拌至完全溶解即可。
需要注意的是,重铬酸钾溶液的颜色会随着浓度的变化而发生变化,当浓度达到一定程度时,溶液会变成橙红色。
1.2 重铬酸钾与有机物的反应重铬酸钾溶液与有机物反应时,会发生如下化学方程式:2Cr2O7 + 3H2SO4 → 2Cr2(SO4)3 + 3H2O + SO2↑ + 2CO2↑其中,2Cr2O7代表重铬酸钾,H2SO4代表硫酸,SO2和CO2代表产生的二氧化硫和二氧化碳气体。
这个反应是一个氧化还原反应,其中的Cr元素具有一定的氧化性。
1.3 反应条件的控制为了保证实验结果的准确性,需要对反应条件进行控制。
首先是pH值的控制,一般在7-9之间比较合适;其次是温度的控制,一般在20-30°C之间比较稳定;最后是时间的控制,一般要保证反应充分进行。
二、实践操作步骤2.1 样品采集与处理首先需要采集一定量的土壤样品,并将其粉碎成细粉末状。
然后将样品放入烧杯中,加入适量的水进行搅拌混合。
接下来需要用滤纸将混合后的样品过滤一遍,以去除其中的杂质。
最后将过滤后的样品转移到干净的容器中备用。
2.2 重铬酸钾溶液的配制按照1.1节中的方法制备重铬酸钾溶液。
需要注意的是,在配制过程中要避免接触到皮肤和眼睛,以免造成伤害。
同时还要注意防止溶液溅出或泄漏,以免污染环境。
2.3 实验操作流程将适量的重铬酸钾溶液倒入已经装有土壤样品的试管中,然后立即混匀。
接着需要将试管倾斜放置一段时间(一般为5-10分钟),使溶液充分与土壤样品接触并发生反应。
最后需要记录下反应后溶液的颜色变化情况,以判断有机物质含量的大小。
土壤中有机物的测定通常包括测定土壤有机质,这是指土壤中各种动植物残体以及微生物及其生命活动的各种有机产物的总和。
以下是几种常用的测定方法:
TOC分析法:通过高温(1100度)灼烧土壤样品中的有机碳,使其释放出二氧化碳。
然后使用高灵敏检测器收集并转化为样品的TOC值。
最后,将TOC值乘以1.724系数,即可得到土壤中有机质含量。
重铬酸钾容量法:在170~180℃的油浴中,使加有重铬酸钾氧化剂和硫酸的土壤溶液沸腾5分钟。
此过程中,土壤有机质中的碳被重铬酸钾氧化为二氧化碳,而重铬酸钾中的六价铬被还原成三价铬。
然后,用二价铁的标准溶液滴定剩余的重铬酸钾。
根据有机碳被氧化前后重铬酸钾消耗硫酸亚铁的量,可以计算出有机碳的含量,进而换算出土壤有机质含量。
水合热比色法:在土壤样品中直接加入K2Cr2O7和浓硫酸,利用它们迅速混合所产生的热(温度在120℃左右)来氧化土壤中的有机碳。
通过观察土壤溶液中被还原后产生的绿色铬离子(Cr3+)或者剩余的重铬酸钾橙色的变化,可以确定土壤有机碳含量。
进一步通过测定溶液中有机酸盐的浓度,可以计算出有机质含量。
此外,还有其他一些方法,如燃烧法、碱解法、酸碱滴定法、紫外分光光度法和土壤呼吸法等,这些方法各有优缺点,选择使用哪种方法取决于实际情况、样品特性以及分析要求。
重铬酸钾容量法测定地质样品中的有机碳李振;夏彬涵;韩敏;陈冲科【期刊名称】《中国无机分析化学》【年(卷),期】2024(14)3【摘要】目前,地质样品中有机碳的测定方法有干烧法(高温电炉灼烧)和湿烧法(重铬酸钾氧化)两大类。
干烧法要求实验条件苛刻、操作繁琐、不易掌握、受碳酸盐的干扰,湿烧法虽然操作比较简单,但方法受样品中还原性物质的干扰,如氯根、亚铁等,通过优化熔矿温度、熔矿时间、熔剂浓度的选择,考察氯离子的干扰实验。
结果表明,样品中含氯化物低的样品通过加入0.1 g硫酸银消除干扰,样品中含氯化物高的样品通过高温灼烧减量消除干扰。
氧化指示剂选用邻菲啰啉或苯二氨基苯甲酸。
方法的相对标准偏差(RSD)在0.80%~4.4%,准确度(RE)在-3.2%~1.2%,方法适用于土壤、水系沉积物、岩石等地质调查样品中有机碳的测定。
通过标准物质验证,方法技术指标满足地质行业规范(DZ/T 0130.4—2006)中有机碳的分析要求,建立了一种简单、快捷、经济、准确的测定地质样品中有机碳的测定方法,满足地球化学调查批量样品生产的需要。
【总页数】7页(P330-336)【作者】李振;夏彬涵;韩敏;陈冲科【作者单位】河南省地质局地质灾害防治中心;自然资源部贵金属分析与勘查技术重点实验室;河南地矿职业学院【正文语种】中文【中图分类】O655.1【相关文献】1.重铬酸钾氧化-还原容量法测定海洋沉积物中有机碳的不确定度评定2.重铬酸钾滴定法测定地质样品中氧化亚铁结果的不确定度评定3.重铬酸钾氧化-外加热法测定化探土壤样品中有机碳含量4.硫酸预加热-容量法测定含氯地质样品中的有机碳5.重铬酸钾容量法测定盐碱土中有机碳因版权原因,仅展示原文概要,查看原文内容请购买。