可逆过程与可逆过程体积功
- 格式:ppt
- 大小:1.22 MB
- 文档页数:32
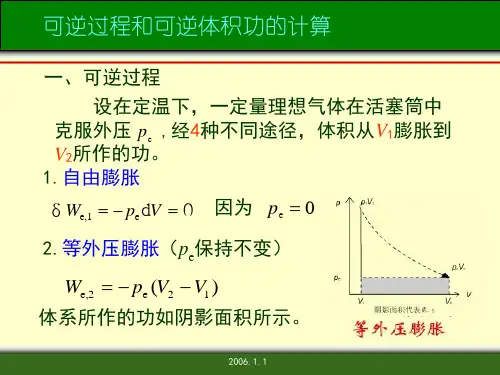








热力学第一定律△U=Q+W 或dU=ΔQ+δW=δQ-p amb dV+δW` 体积功δW=-p amb dV (1)气体向真空膨胀时体积功所的计算W=0 (2)恒外压过程体积功W=p amb (V 1-V 2)=-p amb △V (3)对于理想气体恒压变温过程W=-p △V=-nR △T (4)可逆过程体积功W r =⎰21p V V dV (5)理想气体恒温可逆过程体积功W r =⎰21p V V dV =-nRTln(V 1/V 2)=-nRTln(p 1/p 2)(6)可逆相变体积功W=-pdV焓Hdef U + p V △H=△U+△(pV) △H=⎰21,T T m p dT nC此式适用于理想气体单纯p VT 变化的一切过程 内能(1)△U=Qv△ U=⎰21,v T T m dT nC =)(12,v T -T m nC 摩尔定容热容C V ,m△ C V ,m =C V /n=(TU mаа)V (封闭系统,恒容,W 非=0)(3)摩尔定压热容C p,m C p,m ==n p C P⎪⎭⎫ ⎝⎛T H m аа (封闭系统,恒压,W 非=0)(4) C p, m 与 C V ,m 的关系系统为理想气体,则有C p, m —C V ,m =R 系统为凝聚物质,则有C p, m —C V ,m ≈0(5)热容与温度的关系,通常可以表示成如下的经验式 C p, m =a+bT+cT2或C p, m =a+b`T+c`T -2式中a 、b 、c 、b`及c`对指定气体皆为常数,使用这些公式时,要注意所适用的温度范围。
(6)平均摩尔定压热容Cp,mCp,m=⎰21,T T m p dT nC (T 2-T 1)四、理想气体可逆绝热过程方程,m2121(/)(/)1V C R T T V V =,m2121(/)(/)1p C RT T p p -= 1)/)(/(1212=r V V p pγγ2211V p V p =ξ=△n B /v BνB 为B 的反应计算数,其量纲为1。
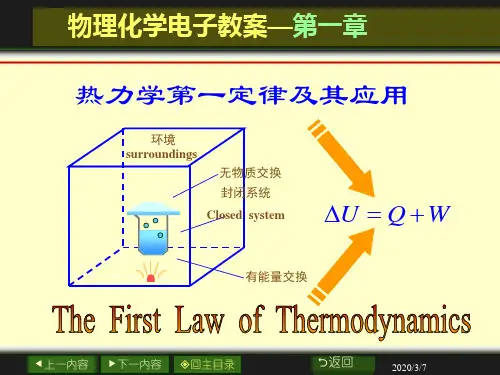
第一章 热力学第一定律一、基本概念系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律热力学第一定律:ΔU =Q +W 。
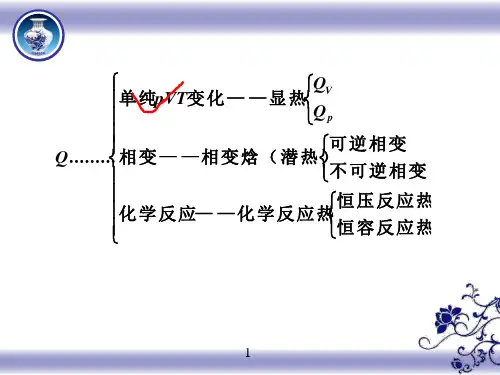
焦耳实验:ΔU =f (T ) ; ΔH =f (T )三、基本关系式1、体积功的计算 δW = -p e d V恒外压过程:W = -p e ΔV可逆过程: W =nRT 1221ln ln p p nRT V V =2、热效应、焓等容热:Q V =ΔU (封闭系统不作其他功)等压热:Q p =ΔH (封闭系统不作其他功)焓的定义:H =U +pV ; d H =d U +d(pV )焓与温度的关系:ΔH =⎰21d p T T T C3、等压热容与等容热容 热容定义:V V )(T U C ∂∂=;p p )(T HC ∂∂=定压热容与定容热容的关系:nR C C =-V p热容与温度的关系:C p =a +bT +c’T 2四、第一定律的应用1、理想气体状态变化等温过程:ΔU =0 ; ΔH =0 ; W =-Q =⎰-p e d V 等容过程:W =0 ; Q =ΔU =⎰T C d V ; ΔH =⎰T C d p 等压过程:W =-p e ΔV ; Q =ΔH =⎰T C d p; ΔU =⎰T C d V可逆绝热过程:Q =0 ; 利用p 1V 1γ=p 2V 2γ求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p不可逆绝热过程:Q =0 ;利用C V (T 2-T 1)=-p e (V 2-V 1)求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p2、相变化可逆相变化:ΔH =Q =n Δ_H ;W=-p (V 2-V 1)=-pV g =-nRT ; ΔU =Q +W3、热化学物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算:)298,()298(B H H m f B mr θθν∆=∆∑ 反应热与温度的关系—基尔霍夫定律:)(])([,p B C T H m p BB m r ∑=∂∆∂ν。