可逆过程与可逆过程体积功的计算
- 格式:ppt
- 大小:913.00 KB
- 文档页数:26






几种常见过程的体积功熊帮云;罗杰;廖爽【摘要】本文给出了热力学中体积功的定义式,并结合定义式,推导出了几种常见过程的体积功的公式,对《普通化学》《无机化学》及《物理化学》等课程中体积功的理解与应用具有指导意义.【期刊名称】《产业与科技论坛》【年(卷),期】2018(017)022【总页数】2页(P69-70)【关键词】体积功;过程推导;热力学【作者】熊帮云;罗杰;廖爽【作者单位】佛山科学技术学院;佛山科学技术学院;佛山科学技术学院【正文语种】中文一、引言在热力学系统中,“功”是系统与环境之间除“热”之外的以其它形式传递的能量[1~2],是由微观粒子的有序运动所引起的。
热力学中又将“功”分为体积功和非体积功两大类,而其中由于系统体积的变化而与环境之间交换的“功”称为体积功。
体积功的概念及其计算在热力学中占有非常重要地位,对理解系统与环境之间的能量交换非常重要,是正确理解和运用热力学基础知识,特别是热力学第一定律的关键[3]。
正因如此,热力学中的体积功是普通高校化学及材料专业课程,如《普通化学》《无机化学》《物理化学》等课程中的重要知识点。
但是,目前部分高校的《无机化学》和《普通化学》课程所采用的教材,如天津大学无机化学教研室编著的普通高等教育“十二五”普通高等教育本科国家级规划教材《无机化学》和赵士铎主编的普通高等教育“十一五”国家级规划教材中,只是简单地给出了体积功的文字定义,并未对其详加说明,显得比较晦涩难懂,学生不明所以。
再加上“功”不是状态函数,其大小与过程有关,准确地说与系统状态具体的变化途径有关[4],对于相同的始态、终态,往往因为过程的不同而所做的功也不同。
这就导致学生在对体积功的概念理解不明的情况下,对具体过程的体积功的计算更是无从下手。
经过近两年的教学实践,发现学生对于体积功概念的理解还不透彻,特别是对不同过程的体积功的计算问题更是含混不清。
为此,从学生的实际情况出发,在体积功这部分的教学中,做了一些尝试,不仅考虑到体积功这一非状态函数本身的特点,给出了体积功的定义式,还推导出了教材里没有的几种常见过程的体积功的计算公式,有助于学生理解掌握。




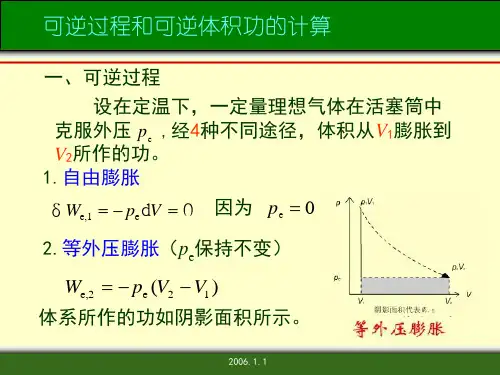
热力学第一定律△U=Q+W 或dU=ΔQ+δW=δQ-p amb dV+δW` 体积功δW=-p amb dV (1)气体向真空膨胀时体积功所的计算W=0 (2)恒外压过程体积功W=p amb (V 1-V 2)=-p amb △V (3)对于理想气体恒压变温过程W=-p △V=-nR △T (4)可逆过程体积功W r =⎰21p V V dV (5)理想气体恒温可逆过程体积功W r =⎰21p V V dV =-nRTln(V 1/V 2)=-nRTln(p 1/p 2)(6)可逆相变体积功W=-pdV焓Hdef U + p V △H=△U+△(pV) △H=⎰21,T T m p dT nC此式适用于理想气体单纯p VT 变化的一切过程 内能(1)△U=Qv△ U=⎰21,v T T m dT nC =)(12,v T -T m nC 摩尔定容热容C V ,m△ C V ,m =C V /n=(TU mаа)V (封闭系统,恒容,W 非=0)(3)摩尔定压热容C p,m C p,m ==n p C P⎪⎭⎫ ⎝⎛T H m аа (封闭系统,恒压,W 非=0)(4) C p, m 与 C V ,m 的关系系统为理想气体,则有C p, m —C V ,m =R 系统为凝聚物质,则有C p, m —C V ,m ≈0(5)热容与温度的关系,通常可以表示成如下的经验式 C p, m =a+bT+cT2或C p, m =a+b`T+c`T -2式中a 、b 、c 、b`及c`对指定气体皆为常数,使用这些公式时,要注意所适用的温度范围。
(6)平均摩尔定压热容Cp,mCp,m=⎰21,T T m p dT nC (T 2-T 1)四、理想气体可逆绝热过程方程,m2121(/)(/)1V C R T T V V =,m2121(/)(/)1p C RT T p p -= 1)/)(/(1212=r V V p pγγ2211V p V p =ξ=△n B /v BνB 为B 的反应计算数,其量纲为1。
理想气体绝热可逆过程体积功计算解析作者:贺晓凌来源:《新一代》2018年第18期摘要:物理化学课程中,理想气体绝热可逆过程体积功计算是学习的难点,结合热力学第二定律,对该知识点进行深入解析。
关键词:物理化学;理想气体;绝热可逆体积功物理化学课程在高等院校化学化工类专业是非常重要的基础课,某些知识点较难理解和掌握,在热力学部分理想气体绝热可逆过程体积功的计算,为一较难理解知识点,其间细节问题需要厘清,本文对该知识点进行深入解析。
一、基本思路可逆过程为系统与环境间在无限接近平衡时所进行的过程,该过程能使系统和环境都恢复到原来的状态而不留下任何永久性的变化。
对于可逆过程体积功的计算,应该从体积功的定义式出发。
由于可逆过程为系统与环境间在无限接近平衡时所进行的过程,也就是内外压力相差无穷小的过程,这样就可以认为内压和外压近似相等。
如果计算理想气体的绝热可逆过程体积功,可将理想气体状态方程与体积功定义式结合,得到式(1),然后对其进行积分运算即可。
?啄WR=-■dV ; (1)但式(1)中存在2个变量T和V,需要找到二者的关系才能进行积分运算。
二、推导过程由热力学第一定律可知,绝热可逆过程δWR=dU。
若系统为理想气体,则nCv,mdT=-(nRT/V)dV,所以■dT=-■dV若Cv,m为常数,进行积分得■=(■)(1-■)再结合理想气体状态方程,从而得到3个理想气体绝热可逆过程方程:其中γ=CP,m/CV,m,称为绝热指数。
从理想气体绝热可逆过程方程可获得p、V、T 之间的关系,从而能进行式(1)的积分运算,因此理想气体绝热可逆过程体积功的计算公式为:WR=-■ (5)三、深入解析关于式(5),必须满足理想气体绝热可逆过程的条件,如果不是可逆过程,不能用式(5)进行体积功的计算。
但应用式(5)计算理想气体绝热可逆过程体积功比较繁琐,更简便方法如下:根据热力学第一定律,因为是绝热过程,则W=△U=nCv,m(T2-T1) ; (Cv,m为常数) ;(6)式(6)不仅局限于计算理想气体绝热可逆过程体积功,对于理想气体绝热非可逆过程体积功的计算也适用,因为在推导过程中并没有可逆因素的限制,只要满足理想气体绝热即可。
第一章 热力学第一定律一、基本概念系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律热力学第一定律:ΔU =Q +W 。
焦耳实验:ΔU =f (T ) ; ΔH =f (T )三、基本关系式1、体积功的计算 δW = -p e d V恒外压过程:W = -p e ΔV可逆过程: W =nRT 1221ln ln p p nRT V V =2、热效应、焓等容热:Q V =ΔU (封闭系统不作其他功)等压热:Q p =ΔH (封闭系统不作其他功)焓的定义:H =U +pV ; d H =d U +d(pV )焓与温度的关系:ΔH =⎰21d p T T T C3、等压热容与等容热容 热容定义:V V )(T U C ∂∂=;p p )(T HC ∂∂=定压热容与定容热容的关系:nR C C =-V p热容与温度的关系:C p =a +bT +c’T 2四、第一定律的应用1、理想气体状态变化等温过程:ΔU =0 ; ΔH =0 ; W =-Q =⎰-p e d V 等容过程:W =0 ; Q =ΔU =⎰T C d V ; ΔH =⎰T C d p 等压过程:W =-p e ΔV ; Q =ΔH =⎰T C d p; ΔU =⎰T C d V可逆绝热过程:Q =0 ; 利用p 1V 1γ=p 2V 2γ求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p不可逆绝热过程:Q =0 ;利用C V (T 2-T 1)=-p e (V 2-V 1)求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p2、相变化可逆相变化:ΔH =Q =n Δ_H ;W=-p (V 2-V 1)=-pV g =-nRT ; ΔU =Q +W3、热化学物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算:)298,()298(B H H m f B mr θθν∆=∆∑ 反应热与温度的关系—基尔霍夫定律:)(])([,p B C T H m p BB m r ∑=∂∆∂ν。